检测患者外周血清CEA、CA15-3水平在乳腺癌手术前后的价值研究
2017-03-31张志勇陈从华明炜龚顺松侯国强
张志勇 陈从华 明炜 龚顺松 侯国强
·论著·
检测患者外周血清CEA、CA15-3水平在乳腺癌手术前后的价值研究
张志勇 陈从华 明炜 龚顺松 侯国强
目的 探讨乳腺癌患者手术前后血清癌胚抗原(CEA)和糖蛋白抗原15-3(CA15-3)水平变化及临床意义。方法 选取收治的行手术治疗的乳腺癌患者78例为乳腺癌组,选取同期收治的60例乳腺良性疾病患者作为良性疾病组,健康体检者60例作为对照组,比较3组对象的血清CEA、CA15-3水平;比较乳腺癌组手术前后及有无复发转移患者血清CEA、CA15-3水平;分析CEA、CA15-3对乳腺癌复发转移的诊断效能。结果 乳腺癌组血清CEA、CA15-3水平明显高于良性疾病组和对照组(P<0.05);术后4周,乳腺癌组血清CEA、CA15-3水平均明显低于术前(P<0.05);复发转移患者的血清CEA、CA15-3水平均明显高于无复发转移患者(P<0.05);CEA、CA15-3联合检测的敏感度、准确度明显高于单项检测(P<0.05)。结论 乳腺癌患者血清CEA、CA15-3水平明显升高,术后则水平显著降低,但术后复发转移患者血清CEA、CA15-3水平则明显升高,CEA、CA15-3联合检测对患者复发转移判断有重要临床价值。
乳腺肿瘤;手术治疗;血清癌胚抗原;糖蛋白抗屎15-3
乳腺癌是我国女性好发的常见恶性肿瘤之一,虽然近年来乳腺癌生存率明显提高,但仍有约50%的患者出现复发转移。手术是治疗乳腺癌的主要方法,不过部分患者在术后会出现复发,导致患者生存周期较短[1]。肿瘤标志物是恶性肿瘤在发生、发展、转移及浸润时产生的一种特异性物质,不仅能够在肿瘤组织内检测到,而且能够在患者体液、血清内检测到,同时经过化疗、手术等治疗后,其水平会出现明显变化,因而对良恶性肿瘤的鉴别诊断以及预后评估等均具有重要作用[2]。有研究显示,癌胚抗原(CEA)及糖蛋白抗原15-3(CA15-3)与肺癌、肝癌、胃癌、乳腺癌等多种恶性肿瘤病情变化及预后密切相关,可作为早期诊断及预后评估的重要指标[3]。本研究分析乳腺癌患者手术前后血清CEA、CA15-3水平变化及其临床意义,旨在为改善患者预后提供参考依据。
1 资料与方法
1.1 一般资料 选取2014年1月至2015年6月我院收治的行手术治疗的乳腺癌患者78例作为乳腺癌组,乳腺癌均符合《乳腺癌》诊断标准[4],且经病理学、强化CT、MRI等检查确诊。入选标准:(1)均为初诊患者,入组前未行放化疗等治疗;(2)患者临床分期、病理分级等一般资料齐全;(3)预计生存期>3个月;(4)Kamofsky评分≥70分;(5)均行手术治疗。排除标准:(1)合并其他部位恶性肿瘤者;(2)入组前1个月内服用过影响血清CEA、NSE及CYFRA21-1水平药物者;(3)围术期死亡者。78例患者中,年龄29~68岁,平均年龄(48.3±9.6)岁;根据美国癌症联合委员会制定的TNM分期分为:Ⅰ期18例,Ⅱ期34例,Ⅲ期16例,Ⅴ期10例;组织学类型:浸润性导管癌64例,浸润性小叶癌8例,肉瘤样癌6例;手术类型:乳腺癌根治术56例,改良根治术15例,保乳术4例,单纯切除术3例。选取同时期本院收治的60例乳腺良性疾病患者作为良性疾病组,年龄30~65岁,平均年龄(47.4±10.2)岁;乳腺纤维瘤18例,乳腺增生27例,乳腺炎15例。选取同期门诊健康体检者60例作为对照组,均为女性,年龄32~67岁,平均年龄(48.6±9.7)岁。
1.2 方法 于术前、术后4周时采集患者空腹外周血5 ml,分离血清后通过电化学发光法测定CEA、CA15-3水平,所需试剂由北京中杉金桥生物技术有限公司,严格按照试剂盒说明操作进行;术后随访12个月,定期行彩超、胸部X线片以及强化CT等检查,对出现复发转移患者于第2天行CEA、CA15-3水平测定。
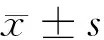
2 结果
2.1 不同对象血清CEA、CA15-3水平比较 乳腺癌组血清CEA、CA15-3水平明显高于良性疾病组和对照组(P<0.05),良性疾病组和对照组患者血清CEA、CA15-3水平比较差异无统计学意义(P>0.05);乳腺癌组患者中,Ⅲ期、Ⅴ期乳腺癌患者血清CEA、CA15-3水平明显高于Ⅰ期和Ⅱ期(P<0.05),Ⅰ期和Ⅱ期患者血清CEA、CA15-3水平比较差异无统计学意义(P>0.05)。见表1。
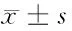

组别CEA(ng/ml)CA15-3(U/ml)对照组(n=60)6.81±3.23*9.47±3.22*良性疾病组(n=60)7.02±1.14*13.17±2.98*乳腺癌组(n=78)25.89±20.6440.94±20.85 Ⅰ期(n=18)7.26±6.88#14.02±8.23# Ⅱ期(n=34)7.58±5.95#16.64±11.75# Ⅲ期(n=16)24.46±17.9330.27±15.89 Ⅴ期(n=10)32.42±21.6942.46±30.21
注:与乳腺癌组比较,*P<0.05;与Ⅲ期、Ⅴ期比较,#P<0.05
2.2 乳腺癌组术后血清CEA、CA15-3水平比较 乳腺癌患者术后血清CEA、CA15-3水平明显低于术前(P<0.05)。见表2。


时间CEA(ng/ml)CA15-3(U/ml)术前25.89±20.6440.94±20.85术后7.72±3.4818.43±13.29t值7.6678.040P值0.0000.000
2.3 术后有无复发转移患者血清CEA、CA15-3水平比较 术后随访12个月,27例患者出现复发转移,其中无复发转移患者血清CEA、CA15-3水平明显低于复发转移患者(P<0.05)。见表3。
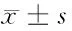

组别CEA(ng/ml)CA15-3(U/ml)复发转移(n=27)26.21±17.8441.56±22.78无复发转移(n=51)7.84±3.0320.09±13.64 t值7.2005.209 P值0.0000.000
2.4CEA、CA15-3联合与单项检测对乳腺癌复发转移的诊断效能CEA、CA15-3联合检测的敏感度、准确度明显高于CEA、CA15-3单项检测(P<0.05);CA15-3+CEA联合检测的ROC曲线下面积为0.806。见表4、5。

表4 CEA、CA15-3联合与单项检测对乳腺癌复发转移的诊断效能 %(例)
注:与CA15-3+CEA比较,*P<0.05

表5 CEA、CA15-3联合与单项检测对乳腺癌复发转移的ROC曲线下面积
3 讨论
乳腺癌是临床中常见的一种妇科恶性肿瘤,手术是治疗早期乳腺癌的重要的重要手段,主要术式包括扩大根治术、保乳手术、根治术、改良根治术、乳房再造等,显著改善了患者的近中期生存状况。有研究发现,原发性乳腺癌患者术后10年内复发转移率在30%以上[5]。因此,探寻评估乳腺癌手术患者疗效、预后和及早发现复发转移的观察指标或方法等,已经成为临床工作者的重要课题。伴随着现代分子生物学飞速发展,越来越多的学者发现乳腺癌的发生与发展是多基因共同参与的一个复杂过程。血清肿瘤标志物为反映肿瘤存在及生长的一些物质,主要包括多胺、酶、蛋白质、激素以及癌基因产物等,多存在于患者的组织、细胞、血液等中,由于这些物质在良性病变或者正常组织中含量极低或者几乎不产生,因而对恶性肿瘤的早期诊断、临床分期以及疗效观察、预后评估具有极其重要的临床价值[6]。临床相关研究指出,相关血清肿瘤标志物的水平对乳腺癌患者早期诊断及预后评估具有重要作用[7]。目前,CEA、CA15-3均是临床常用的几种肿瘤标志物。宋红蕾等[8]研究结果显示,CEA、CA15-3在乳腺癌患者中均呈高表达,且二者联合检测可明显提高乳腺癌的早期诊断效果。本研究中,乳腺癌组血清CEA、CA15-3水平明显高于良性疾病组和对照组,这与临床研究结果[9]基本一致。研究结果提示在乳腺癌患者中,血清CEA、CA15-3水平明显升高。
CEA为具有人类胚胎特性决定簇的一种酸性糖蛋白物质,在正常细胞逐渐向恶性细胞进行转化的过程当中,肿瘤细胞基因调控出现一定损伤,造成胚胎细胞相关的基因调节失调,导致大量CEA产生并被释放。临床中,CEA与组织学类型、病理类型、TNM分期密切相关,腺癌患者CEA阳性表达率明显高于鳞癌患者[10]。CA15-3为腺体所分泌的一种多行上皮黏蛋白,在乳腺癌细胞中是最早发现的一种糖蛋白变异体,多存在于机体腺体内,例如卵巢癌、肺癌、乳腺癌等,尤其对乳腺癌患者治疗后的复发监测具有较高的敏感度[11]。临床研究证实,在乳腺癌患者中血清CA15-3水平与患者的TNM分期、分化程度、病理分型有关,可为乳腺癌患者针对性治疗提供临床指导[12]。本研究中亦发现,随着TNM分期增加,血清CEA、CA15-3水平不断升高。这与临床相关研究结果[13]基本一致。术后4周,乳腺癌患者的血清CEA、CA15-3水平均明显低于术前,与罗金香等[14]研究结果相近,表明经手术治疗后患者血清CEA、CA15-3水平明显降低。术后血清CEA、CA15-3水平变化的作用机制目前尚未完全明确,可能与肿瘤负荷有一定关系,经过乳腺癌根治术、改良根治术等手术治疗后,病情有一定好转,减轻了肿瘤负荷,从而降低了血清CEA、CA15-3水平。
肿瘤标志物不仅对肿瘤的分类、诊断等提供临床指导,还可以作为患者临床疗效、预后评估的重要指标。临床相关研究发现,肿瘤标志物与恶性肿瘤患者的临床预后、复发转移相关[15]。在经过12个月随访之后,出现复发转移27例,其血清CEA、CA15-3水平明显高于无复发转移患者,提示血清CEA、CA15-3水平与乳腺癌患者术后转移复发密切相关,可作为患者术后复发转移评估的重要指标。同时,进一步分析发现,CEA、CA15-3联合检测的敏感度、准确度以及曲线下面积均高于CEA、CA15-3单项检测,再次证明CEA、CA15-3联合检测对患者复发转移判断有重要临床价值。
综上所述,乳腺癌患者血清CEA、CA15-3水平明显升高,术后则水平显著降低,但术后复发转移患者血清CEA、CA15-3水平则明显升高,CEA、CA15-3联合检测对患者复发转移判断有重要临床价值。
1 罗年安,屈亚琦,董瑞.乳腺癌的治疗进展.现代生物医学进展,2015,15:160-162,166.
2BenediktssonKP,PerbeckL.Survivalinbreastcancerafternipple-sparingsubcutaneousmastectomyandimmediatereconstructionwithimplants:aprospectivetrialwith13yearsmedianfollow-upin216patients.
EurJSurgOncol,2008,34:143-148.
3 耿彪,梁曼曼,赵文英,等.转移性乳腺癌患者血清CA15-3和CEA水平与临床病理参数的关系.南昌大学学报(医学版),2014,54:42-45,49.
4 林本耀主编.乳腺癌.第1版.北京:中国医药科技出版社,2006.263-264.
5VaidyaJS,BaumM,TobiasJS,etal.Long-termresultsoftargetedintraoperativeradiotherapy(Targit)boostduringbreast-conservingsurgery.IntJRadiatOncolBiolPhys,2011,81:1091-1097.
6 屈会青,陈建中,宋宁宁,等.Ⅲ、Ⅳ期乳腺癌及乳腺癌术后患者血清标志物检测的临床应用价值.重庆医科大学学报,2013,38:538-541.
7 李楠,毛夕保,丁晨旻,等.18F-FDGSPECT/CT显像联合CA15-3、CA125和CEA诊断乳腺癌术后复发和(或)转移.现代肿瘤医学,2015,23:3477-3481.
8 宋红蕾,陈慧暖,洪春霖,等.血清胸腺嘧啶核苷激酶1癌胚抗原糖类抗原153与进展期乳腺癌化疗疗效及预后的关系.中国肿瘤临床与康复,2015,22:675-677.
9 刘苑欢,魏荣兴,邱群芳.联合检测CA15-3、CA125、CEA对乳腺癌临床诊断价值探讨.实用癌症杂志,2014,29:406-408.
10LeeJS,ParkS,ParkJM,etal.ElevatedlevelsofpreoperativeCA15-3andCEAserumlevelshaveindependentlypoorprognosticsignificanceinbreastcancer.AnnOncol,2013,24:1225-1231.
11PedersenAC,SorensenPD,JacobsenEH,etal.SensitivityofCA15-3,CEAandserumHER2intheearlydetectionofrecurrenceofbreastcancer.ClinChemLabMed,2013,51:1511-1519.
12ParkS,AhnHK,ParkLC,etal.ImplicationsofdifferentCA15-3levelsaccordingtobreastcancersubtypeatinitialdiagnosisofrecurrentormetastaticbreastcancer.Oncology,2012,82:180-817.
13 许立生,王水,黄中晶,等.ER、PR、VEGF、CA15-3、CA125 和CEA水平在乳腺癌预后判断中的临床意义.实用医学杂志,2012,28:3565-3567.
14 罗金香,于春波.检测乳腺癌患者术后血清肿瘤指标的临床价值.中国医药导刊,2013,15:172-173.
15 廖洪宇,龚建.血清CA15-3、CA125、CEA和PRL水平与乳腺癌及骨转移的关系.蚌埠医学院学报,2014,39:1418-1420.
Clinical value of detection of serum levels of CEA and CA15-3 in peripheral blood of patients with breast cancer before and after surgery
ZHANGZhiyong,CHENConghua,MINGWei,etal.
DepartmentofGastrointestinalSurgery,People’sHospitalofYangxinCounty,Hubei,Yangxin435200,China
Objective To investigate the changes and clinical significance of detection of serum levels of carcinoembryonic antigen (CEA) and glycoprotein antigen 15-3 (CA15-3) in peripheral blood of patients with breast cancer before and after surgery.Methods Seventy-eight patients with breast cancer who received surgical treatment in our hospital from January 2013 to June 2015 were served as breast cancer group,at the same time, 60 patients with benign breast diseases were selected as benign disease group,moreover 60 healthy subjects were served as control group.The serum levels of CEA and CA15-3 were detected and compared among the three groups,The serum levels of CEA and CA15-3 in patients with breast cancer before and after operation and in patients with or without relapse and metastasis were observed and compared,furthermore,the diagnostic value of detection of CEA,CA15-3 levels in evaluating relapse and metastasis of breast cancer were analyzed.Results The serum levels of CEA and CA15-3 in breast cancer group were significantly higher than those in benign disease group and control group (P<0.05).On4weeksafteroperation,theserumlevelsofCA15-3andCEAinbreastcancergroupweresignificantlylowerthanthosebeforeoperation(P<0.05).MoreovertheserumlevelsofCEAandCA15-3inpatientswithrelapseandmetastasisweresignificantlyhigherthanthoseofpatientswithoutrelapseandmetastasis(P<0.05).ThesensitivityandaccuracyofcombinationdetectionofCEAandCA15-3weresignificantlyhigherthanthoseofsingledetection(P<0.05).Conclusion The serum levels of CEA,CA15-3 in patients with breast cancer are significantly increased,however,which are obviously decreased after operation,but the serum levels of CEA,CA15-3 in patients with postoperative relapse and metastasis are significantly increased,moreover,the combination detection of CEA and CA15-3 has important clinical value for evaluating relapse and metastasis of breast cancer.
mammary cancer;surgical treatment;serum carcinoembryonic antigen; proteantigen15-3
10.3969/j.issn.1002-7386.2017.06.015
435200 湖北省阳新县人民医院胃肠甲乳外科(张志勇),心胸外科(陈从华、明炜、龚顺松、侯国强)
R
A
1002-7386(2017)06-0857-04
2016-10-17)
