CT灌注成像预测宫颈鳞癌新辅助化疗后微小淋巴结转移
2017-03-31雷军强郭顺林翟亚楠郭奇虹
殷 亮,雷军强,郭顺林,翟亚楠,郭奇虹
(兰州大学第一医院放射科,甘肃 兰州 730000)
CT灌注成像预测宫颈鳞癌新辅助化疗后微小淋巴结转移
殷 亮,雷军强*,郭顺林,翟亚楠,郭奇虹
(兰州大学第一医院放射科,甘肃 兰州 730000)
目的 探讨CT灌注成像预测宫颈鳞癌新辅助化疗后微小淋巴结转移的价值。方法 收集在我院接受新辅助化疗并手术的46例宫颈鳞癌患者,根据术后病理是否存在微小淋巴结转移(转移淋巴结短轴径<10 mm)及短期随访淋巴结转移的情况将其分为无微小淋巴结转移组(n=32)和存在微小淋巴结转移组(n=14),比较其CT灌注参数并分析其诊断价值。结果 存在微小淋巴结转移组的肿瘤化疗前肿瘤最大直径、血流量(BF)、血容量(BV)均大于无微小淋巴结转移组(P均<0.05);两组间化疗后肿瘤最大直径、渗透性、达峰时间(TTP)差异无统计学意义(P均>0.05)。多因素Logistic回归分析结果显示BF、化疗前肿瘤最大直径是新辅助化疗后微小淋巴结转移的独立影响因素。ROC曲线显示BF[AUC=0.86,P<0.001,95%CI(0.75,0.96)]较化疗前肿瘤最大直径[AUC=0.70,P=0.02,95%CI(0.54,0.88)]对宫颈鳞癌新辅助化疗后是否存在微小淋巴结转移具有更高的预测价值。结论 CT灌注成像对预测宫颈鳞癌新辅助化疗后微小淋巴结转移具有较高的应用价值。
子宫肿瘤;体层摄影术,X线计算机;化疗法,辅助;淋巴转移
在国际妇产科联盟(international federation of gynecology and obstetrics, FIGO)临床分期虽然不包括宫颈癌淋巴结转移,但后者是影响患者预后及生存率的重要因素[1-3]。CT、MR及PET/CT诊断正常体积(淋巴结短轴径<10 mm)的淋巴结转移及淋巴结微转移(lymph nodes micrometastasis, LNM)的敏感度和特异度均存在一定的局限性[4-5],且这部分淋巴结转移亦易造成手术和病理检查的漏诊。近期多项研究[6-7]表明,CT灌注成像对于肿瘤术前评价、治疗效果监测及预后评估等方面均展现出良好应用价值。本研究采用CT灌注成像预测宫颈鳞癌新辅助化疗后是否存在微小淋巴结转移,以期为患者手术方式及术后辅助放化疗提供参考依据。
1 资料与方法
1.1 一般资料 选取2012年5月—2016年2月在我院经病理证实并接受新辅助化疗后择期行经腹或腹腔镜下子宫广泛切除术+盆腔淋巴结清扫及腹主动脉旁淋巴结活检的宫颈鳞癌患者46例,年龄38~62岁,平均(47.5±7.6)岁,肿瘤最大直径3.50~5.20 cm,平均(4.32±1.12)cm。根据FIGO临床分期标准,Ⅰb期17例、Ⅱa期15例、Ⅱb期14例,患者均于术前1周内接受CT灌注扫描。纳入标准:①采用顺铂+紫杉醇(TP)联合化疗方案治疗2个疗程,全身静脉滴注给药,每个疗程21天,第1疗程与第2疗程间隔2周;②化疗后经妇产、影像各2名高级职称医师共同行临床触诊、影像检查评估,根据实体肿瘤疗效的判断标准(response evaluation criteria in solid tumor, RECIST),所有样本均为部分缓解(partial remission, PR);③患者无其他部位恶性肿瘤病史,于新辅助化疗前未曾接受放化疗及手术干预(不包括活检);④无对比剂过敏及妊娠试验阳性;⑤术后病理证实淋巴结存在微小转移且淋巴结短轴径均<10 mm;⑥病理未检出阳性淋巴结的患者于术后接受6~12个月随访,接受腹部MR或CT扫描,综合病理结果(活检)、影像及临床检查以确认病情,复查间隔时间为3或6个月,中位随访时间10个月。根据有无微小淋巴结转移,将患者分为无微小淋巴结转移组和存在微小淋巴结转移组。本研究获得我院伦理委员会批准,所有患者均签署知情同意书。
1.2 仪器与方法 采用Siemens Sensation 64层MSCT扫描仪。扫描前行呼吸训练并用腹带固定盆腔。增强扫描使用高压注射器经肘静脉注射非离子型对比剂碘普胺(300 mgI/ml)50 ml,流率6 ml/s,后以相同流率注射等量生理盐水,延迟10 s后扫描[7]。扫描参数为:管电压100 kV,管电流100 mA,扫描时间40 s,剂量长度乘积(dose-length product, DLP)平均(257.24±51.37)mGy·cm。灌注扫描范围28.8 mm,单层扫描层厚7.2 mm,重建层厚2.4 mm。
1.3 图像分析 采用CT机自带体部灌注软件包处理分析图像。由2名高级职称影像医师对比肿瘤化疗前后CT增强图像,采用多平面重建技术共同确定肿瘤的实性成分,测量肿瘤最大直径并选择ROI,以肿瘤最大直径层面为灌注中心层面,根据肿瘤形态及体积选取3或4个连续层面为靶层面,每层选取3~5个ROI。选择ROI时避开肿瘤边缘、大血管及坏死区域[增强扫描为低密度且血流量值<5 ml/(100 ml·min)],每个ROI直径约5 mm,间距≥5 mm。测量ROI的血流量(blood flow, BF)、血容量(blood volume, BV)、渗透性、达峰时间(time to peak, TTP)。取患者所有层面ROI测得各参数的算术平均值。

2 结果
46例患者共获取淋巴结956枚,术后病理证实有淋巴结转移阳性9例(9/46,19.57%),共54个阳性淋巴结(54/956,5.65%),平均直径(5.47±2.21)mm,其中宫旁淋巴结19枚、闭孔淋巴结14枚、髂血管旁淋巴结11枚、腹股沟淋巴结7枚、腹主动脉旁淋巴结3枚;未检出阳性淋巴结的37例(37/46,80.43%)。随访发现5例患者出现淋巴结转移,其中3例宫旁淋巴结转移,1例髂血管旁淋巴结转移,1例腹主动脉旁淋巴结转移。无微小淋巴结转移组32例,术后病理及随访6~12个月均未发现淋巴结转移;存在微小淋巴结转移组14例,包括术后病理发现及随访出现淋巴结转移患者。
两组间FIGO分期、病理分级及年龄构成差异无统计学意义(P均>0.05,表1)。存在微小淋巴结转移组的化疗前肿瘤最大径、BF、BV均大于无微小淋巴结转移组(P均<0.05;表1、2,图1、2);化疗后肿瘤最大径、渗透性、TTP差异无统计学意义(P均>0.05)。将化疗前肿瘤最大径、BF、BV作为自变量进行多因素Logistic回归分析,结果显示BF和化疗前肿瘤最大径是新辅助化疗后微小淋巴结转移的独立影响因素(表3)。
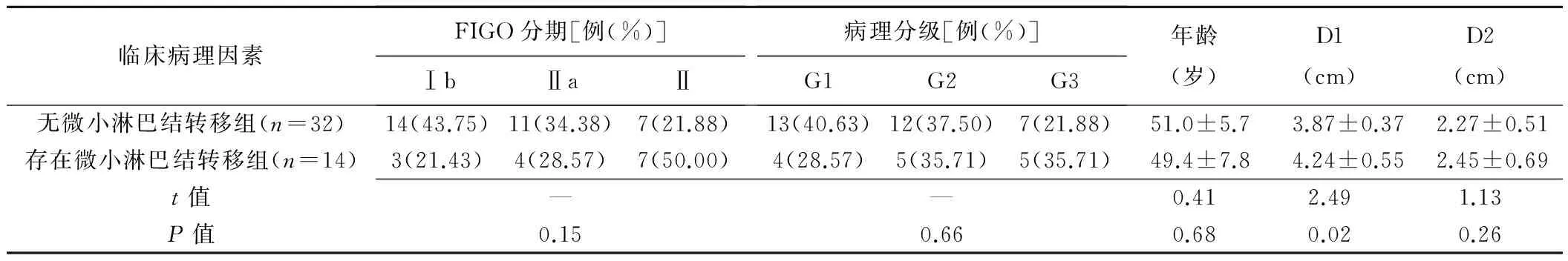
表1 两组间临床病理因素的比较
注:D1:化疗前肿瘤最大径;D2:化疗后肿瘤最大径
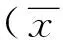
表2 两组间灌注参数比较±s)
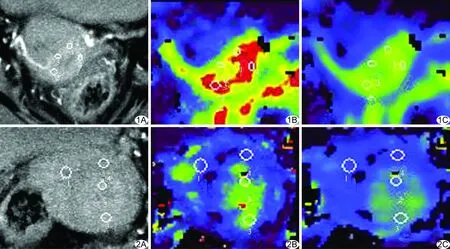
图1 存在微小淋巴结转移组 化疗后CT扫描(A)及同层面BF(B)、BV伪彩图(C) 红色、黄绿色代表高灌注区,蓝色和紫色代表低灌注区 图2 无微小淋巴结转移组 化疗后CT扫描(A)及同层面BF(B)、BV伪彩图(C) 红色、黄绿色代表高灌注区,蓝色和紫色代表低灌注区
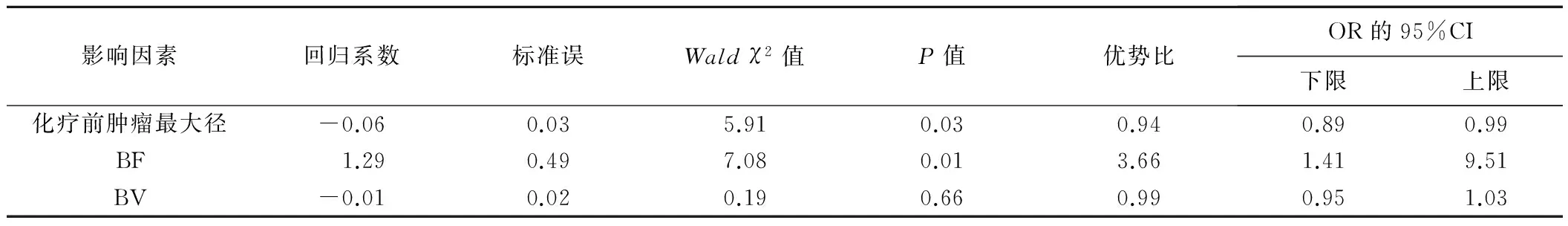
影响因素回归系数标准误Waldχ2值P值优势比OR的95%CI下限上限化疗前肿瘤最大径-0.060.035.910.030.940.890.99BF1.290.497.080.013.661.419.51BV-0.010.020.190.660.990.951.03
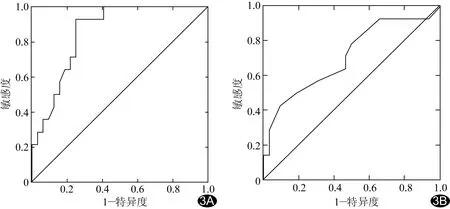
图3 BF(A)、化疗前肿瘤最大径(B)预测宫颈鳞癌新辅助化疗后微小淋巴结转移的ROC曲线
ROC曲线显示BF[AUC=0.86,P<0.001,95%CI(0.75,0.96)]较化疗前肿瘤最大径[AUC=0.70,P=0.02,95%CI(0.54,0.88)]预测宫颈鳞癌新辅助化疗后是否存在微小淋巴结转移更具价值(图3)。BF、化疗前肿瘤最大径分别以59.85 ml/(100 ml·min)、3.75 cm为阈值,预测化疗后存在微小淋巴结转移的敏感度、特异度、准确率分别为100%(14/14)、87.50%(28/32)、91.31%(42/46)和78.57%(11/14)、81.25%(26/32)、80.43%(37/46)。
3 讨论
肿瘤血管生成是肿瘤的侵袭性和转移潜力的重要影响因素,同时也与化疗疗效密切相关[8]。减少淋巴结转移概率和/或缩小淋巴结转移灶是宫颈癌新辅助化疗的目的之一[9-10]。CT灌注成像可提供定性和定量血流动力学信息,能够准确反应肿瘤的血管生成状况[6-7]。由于宫颈癌淋巴结转移与肿瘤血管生成密切相关[11],因此,利用CT灌注成像预测宫颈鳞癌新辅助化疗后是否存在微小淋巴结转移具有理论依据和临床意义。
目前普遍认为新辅助化疗可有效控制和减少宫颈癌淋巴结转移[12-13],但也有学者研究[14-15]发现,与其他治疗方法相比,新辅助化疗并不能明显改善患者的生存率和复发率。对于上述情况,笔者认为有两种可能:①新辅助化疗仅能缩小淋巴转移灶的体积和减少数量,并不能降低淋巴结转移的出现概率[16];②新辅助化疗存在“掩盖作用”[17],即新辅助化疗会缩小转移淋巴结的体积,造成一些微小病灶难以被常规手术、病理检查发现,导致部分有淋巴结转移的患者免于术后放化疗,从而降低了整体预后。同时,LNM也是影响预后的重要因素[18]。总之,对于化疗后短轴直径<10 mm的淋巴结转移及LNM仅通过临床及传统影像方法难以做出客观评价进而影响预后,也是学术界对于宫颈癌新辅助化疗存在争议的重要原因之一。故本研究将术后病理未发现淋巴结转移,但短期内出现淋巴转移的样本视为存在未检出的小淋巴结转移灶或LNM,亦纳入存在微小淋巴转移组。
本研究结果显示,化疗前最大径越大的肿瘤,化疗后存在微小淋巴结转移的可能性越高。研究[19-20]表明宫颈癌最大径与淋巴结转移密切相关。BF、BV取决于肿瘤内血管数量、管径和开放程度,血流速度越快、血容量越高,提示更多新生的功能血管开放和更快的氧气、营养成分交换[6-7]。因此,BF、BV增大,反映肿瘤目前处于更为活跃的代谢状态,其出现转移的概率增加。本研究结果显示,化疗后肿瘤血运状况的改变较肿瘤径线的变化更能反映肿瘤目前的病理学状态,且对微小淋巴结的转移具有更高的预测价值。当BF>59.85 ml/(100ml·min)时,肿瘤存在微小淋巴结转移和/或LNM的可能性较大,对于这部分患者,术中应行更仔细、系统、广泛地进行淋巴结清扫,术后病理有必要行免疫组化检查。对于未发现淋巴结阳性的患者,建议缩短复查间隔(建议3个月)以及早发现可能的转移或复发。由于本研究样本小,结果能否成为术后辅助放疗的依据尚待进一步研究。
CT灌注成像的辐射剂量依旧是目前关注的焦点。Ringelstein等[21]研究发现管电压对CT灌注扫描的辐射剂量有显著影响,100 kV较120 kV辐射剂量下降约40%,但图像质量下降不明显。另外,当灌注扫描层厚>5 mm时,图像的空间分辨率和信噪比间能够得到良好的平衡[22]。
综上所述,本研究采用管电压100 kV,扫描层厚为7.2 mm,在降低剂量的同时可保证图像质量,扫描中利用CARE Dose4D技术调节管电流,使CT灌注扫描剂量控制在可接受水平[平均DLP为(257.24±51.37)mGy·cm]。本研究显示CT灌注成像可良好地反应宫颈鳞癌新辅助化疗后的病理状况,对预测微小淋巴结转移展现出了良好的应用前景,但本研究为小样本试验,结果的准确率仍需大样本证实。
[1] Mabuchi Y, Yahata T, Kobayashi A, et al. Clinicopathologic factors of cervical adencarcinoma stages ⅠB to ⅡB. Int J Gynecol Cancer, 2015,25(9):1677-1682.
[2] Kyung MS, Kim HB, Seoung JY, et al. Tumor size and lymph node status determined by imaging are reliable factors for predicting advanced cervical cancer prognosis. Oncol Lett, 2015,9(5):2218-2224.
[3] Cibula D, Zikan M, Slama J, et al. Risk of micrometastases in non-sentinel pelvic lymph nodes in cervical cancer. Gynecol Oncol, 2016,143(1):83-86.
[4] Bourgioti C, Chatoupis K, Moulopoulos, et al. Current imaging strategies for the evaluation of uterine cervical cancer. World J Radiol, 2016,8(4):342-354.
[5] Sala E, Rockall AG, Freeman SJ, et al. The added role of MR imaging in treatment stratification of patients with gynecologic malignancies: What the radiologist needs to know. Radiology, 2013,266(3):717-740.
[6] Kim SH, Kamaya A, Willmann JK. CT perfusion of the liver: Principles and applications in oncology. Radiology, 2014,272(2):322-344.
[7] García-Figueiras R, Goh VJ, Padhani AR, et al. CT perfusion in oncologic imaging: A useful tool? AJR Am J Roentgenol, 2013,200(1):8-19.
[8] Jayson GC, Kerbel R, Ellis LM, et al. Antiangiogenic therapy in oncology: Current status and future directions. Lancet, 2016,388(10043):518-529.
[9] Osman M. The role of neoadjuvant chemotherapy in the management of locally advanced cervix cancer: A systematic review. Oncol Rev, 2014,8(2):250.
[10] 董霞,王刚.局部晚期宫颈癌新辅助化疗影响因素研究进展.中华临床医师杂志(电子版),2012,6(15):4412-4415.
[11] Sun H, Tang F, Zhou S, et al. Association between vascular endothelial growth factor expression and lymph node metastasis in cervical cancer: A meta-analysis. J Obstet Gynaecol Res, 2016,42(10):1310-1316.
[12] He D, Duan C, Chen J, et al. The safety and efficacy of the preoperative neoadjuvant chemotherapy for patients with cervical cancer: A systematic review and meta analysis. Int J Clin Exp Med, 2015,8(9):14693-14700.
[13] Kim HS, Sardi JE, Katsumata N, et al. Efficacy of neoadjuvant chemotherapy in patients with FIGO stage ⅠB1 to ⅡA cervical cancer: An international collaborative meta-analysis. Eur J Surg Oncol, 2013,39(2):115-124.
[14] Lee DW, Lee KH, Lee JW, et al. Is neoadjuvant chemotherapy followed by radical surgery more effective than radiation therapy for stage ⅡB cervical cancer? Int J Gynecol Cancer, 2013,23(7):1303-1310.
[15] Lee J, Kim TH, Kim GE, et al. Neoadjuvant chemotherapy followed by surgery has no therapeutic advantages over concurrent chemoradiotherapy in International Federation of Gynecology and Obstetrics stage ⅠB—ⅡB cervical cancer. J Gynecol Oncol, 2016,27(5):e52.
[16] Guo L, Liu X, Wang L, et al. Outcome of international Federation of gynecology and obstetrics stage ⅡB cervical cancer from 2003 to 2012: An evaluation of treatments and prognosis: A retrospective study. Int J Gynecol Cancer, 2015,25(5):910-918.
[17] Kim K, Kim MJ, Chung HH, et al. Inadvertent potential risk of neoadjuvant chemotherapy in cervical cancer. Med Hypotheses, 2009,73(6):1005-1007.
[18] Colturato LF, Signorini Filho RC, Fernandes RC, et al. Lymph node micro-metastases in initial stage cervical cancer and temporal recurrence. Int J Gynaecol Obstet, 2016,133(1):69-75.
[19] Horn LC, Bilek K, Fischer U, et al. A cut-off value of 2 cm in tumor size is of prognostic value in surgically treated FIGO stage ⅠB cervical cancer. Gynecol Oncol, 2014,134(1):42-46.
[20] Horn LC, Fischer U, Raptis G, et al. Tumor size is of prognostic value in surgically treated FIGO stage Ⅱ cervical cancer. Gynecol Oncol, 2007,107(2):310-315.
[21] Ringelstein A, Lechel U, Fahrendorf DM, et al. Radiation exposure in perfusion CT of the brain. J Comput Assist Tomogr, 2014,38(1):25-28.
[22] Othman AE, Afat S, Brockmann MA, et al. Radiation dose reduction in perfusion CT imaging of the brain: A review of the literature. J Neuroradiol, 2016,43(1):1-5.
Effect of different delivering methods on pelvic floor function in vaginal delivery
ZHOUZheng,SHITiemei*,WANGXinlu,LIUChen,NIUWang,ZHANGYuanxi
(DepartmentofUltrasound,ShengjingHospitalofChinaMedialUniversity,Shenyang110004,China)
Objective To explore the effect of different delivering methods on the pelvic floor function in vaginal delivery by transvaginal three-dimensional ultrasound. Methods Eighty-four patients delivered transvaginal were classified into three groups according to the mode of delivery (perineal integrity group [n=32], episiotomy group [n=30] and forceps delivery group [n=22]). The hiatal images at resting, Valsalva, levator ani muscle maximum contraction were obtained and compared in three groups. Results There were no differences between perineal integrity group and episiotomy group in hiatal diameter and area (P>0.05). There were significantly differences between perineal integrity group and forceps delivery group in hiatal diameter, area and change in hiatal area from rest to pelvic floor muscle contraction and from rest to Valsalva (allP<0.05). Conclusion The injury of the pelvic floor of forceps delivery group is bigger than perineal integrity. And episiotomy is no significant difference with pelvic floor function injury.
Pelvic floor; Ultrasonography; Parturition
2013年甘肃省卫生行业科研计划管理项目(GWGL2013-27)。
殷亮(1980—),男,甘肃酒泉人,硕士,主治医师。研究方向:腹部影像诊断。E-mail: sese1980128@163.com
雷军强,兰州大学第一医院放射科,730000。E-mail: leijq1990@163.com
2016-10-09
2016-12-15
R737.33; R814.42
A
1003-3289(2017)03-0428-05
10.13929/j.1003-3289.201610083
