CT能谱定量分析对肺腺癌与鳞癌的鉴别诊断价值
2017-03-30宁先英李浩杨明范文亮余建明
宁先英, 李浩, 杨明, 范文亮, 余建明
·胸部影像学·
CT能谱定量分析对肺腺癌与鳞癌的鉴别诊断价值
宁先英, 李浩, 杨明, 范文亮, 余建明
目的:探讨宝石能谱CT对肺腺癌和肺鳞癌的鉴别诊断价值。方法:搜集临床上怀疑肺占位性病变需要增强CT扫描进一步确诊的病例,经病理证实为肺腺癌41例(腺癌组)及肺鳞癌30例(鳞癌组)。在能谱CT上用肺部GSI序列扫描,测得两组的有效原子序数及动静脉期的能谱衰减曲线的斜率K、碘浓度、水浓度及标准化碘浓度NIC,采用独立样本t检验比较两组相关数据的差异。结果:肺腺癌与鳞癌的有效原子序数eff-Z(分别为9.39±0.77与7.22±0.76)、动脉期碘含量(分别为7.17±0.71与6.25±1.65)、 动脉期NIC(分别为0.088±0.007与0.654±0.120)、静脉期水含量(分别为1032.54±3.41与1022.72±35.31)及动脉期能谱曲线斜率K值差异均有统计学意义(P均<0.05)。两组静脉期碘含量(P=0.851)、NIC(P=0.104)及动脉期水含量(P=0.317)差异均无统计学意义。结论:能谱CT的多项定量分析对于鉴别肺腺癌和鳞癌具有一定的价值。
体层摄影术,X线计算机; 能谱成像; 肺肿瘤; 肺腺癌; 肺鳞癌; 鉴别诊断
近年来,随着空气污染日益严重及吸烟等多重因素的影响,肺癌的发病率显著增高[1]。肺腺癌和鳞癌是肺癌中最常见的病理类型,而两者在临床上治疗方案不一样,尤其是化疗方案有较大的区别。普通CT仅能从形态学和CT值上为肺占位性病变提供评价依据,对于鉴别肺腺癌和鳞癌有一定的局限性。能谱CT采用瞬切能谱成像,通过利用特征能谱图像的工具对物质进行多参数的定量分析[2]使得对疾病的分析更为准确,从而为临床提供更可靠的影像依据。本研究探讨能谱CT在鉴别肺腺癌和鳞癌中的临床应用价值。
材料与方法
1.研究对象
搜集2015年10月-2016年7月临床怀疑肺占位在本院行CT增强扫描的病例。纳入研究标准的肺腺癌和鳞癌共71例,其中腺癌41例,鳞癌30例。所有纳入的病例均在1~2周内经手术或穿刺活检病理证实。纳入标准:所有患者均为初诊,未经药物及手术治疗;无碘对比剂过敏史者;无严重心、肝、肾功能不全者;无甲状腺功能障碍者;配合检查、图像质量符合诊断及后处理要求者;无其他合并肿瘤。
2.检查设备及方法
所有患者均为仰卧位,足先进,双手上举,采用GE Discovery 750HD宝石能谱CT 在吸气末单次屏气扫描进行扫描。扫描范围为从胸廓入口到膈肌尖端水平,包含整个肺野。管电压:140 kVp和80 kVp瞬时切换,管电流采用自动毫安调制。球管转速0.5 s/r,层厚层间距均为5 mm ,螺距为0.984 。增强扫描采用MEDRAD双筒高压注射器,经肘静脉注射非离子型碘对比剂碘克沙醇(320 mg I/mL ),剂量60~80 mL(1.0 mL/kg),注射流率3.0~3.5 mL/s。
平扫与增强均采用GSI(gemstone spectral imaging)模式扫描,增强扫描采用Smart-pre软件自动实时监控,监测层面选择在气管分叉肺动脉位置,设定阈值为80 HU,监测层面肺动脉CT值达到阈值时自动憋气口令并触发扫描动脉期。静脉期设置在动脉期扫描结束后12 s开始扫描。
3.图像后处理与分析
将扫描完成的原始数据重建成层厚为1.25 mm的mono图像,在平扫期及动、静脉期图像中找出病灶区域,在显示病灶的最大层面及上下两层划出病灶兴趣区(region of interest,ROI),对于同一病例,ROI的形状及大小尽量一致,ROI的直径约占病灶最大截面最短径的1/2,对于密度均匀的病灶,ROI距离病灶边缘2 mm以上;对于密度不均的病灶,画ROI时尽量避开囊性、气体及钙化灶区域。分别对数据进行以下后处理:①CT值的测量,测量各能量水平40~140 keV下病灶区域的CT值(间隔为10 keV)。②平均有效原子序数的测定(eff-Z)。③能谱衰减曲线的绘制及斜率K的计算。利用能谱后处理软件重建出单能量(40~140 keV)图像的能谱衰减曲线,在曲线以40 keV为起点,从70 keV开始,每隔10 keV与起点划一直线,测得每条直线的斜率(共8条)。斜率表示为:Kx=(HU40-HUx)/(x-40),HU40表示40 keV下ROI的CT值, HUx表示x keV下ROI的CT值。如K140即表示为140 keV与40 keV连线的斜率。④标准化碘含量(normalized iodine concentration,NIC),测得病灶的碘-水含量(iodine content of tumor,ICtu),及相同层面胸主动脉的碘-水含量(iodine content of thoracic aorta,ICta),通过公式NIC= ICtu/ICta计算得出标准化碘含量。其中胸主动脉的ROI面积与病灶ROI面积相同。⑤影像评估,由两名高年资影像医师评估,分析病灶位置、大小、形态。当两者意见不一致时,由第三名医师仲裁达成一致。
4.统计学方法

结 果
动脉期肺腺癌与鳞癌间8组能谱曲线斜率K值差异均有统计学意义(P≤0.05),鳞癌K值较腺癌大(表1、图1)。静脉期肺腺癌与鳞癌间8组能谱曲线斜率K值差异均无统计学意义(P>0.05,表2、图1)。肺腺癌和鳞癌的有效原子序数、动脉期碘含量、静脉期水含量及动脉期NIC差异均有统计学差异(P≤0.05),静脉期碘含量、动脉期水含量及静脉期NIC差异无统计学意义(P>0.05),见表3、图2~3。肺腺癌和鳞癌的CT征象中,胸膜凹陷征差异有统计学意义(P≤0.05),余各征象均无统计学差异,见表4。

表1 肺腺癌和鳞癌动脉期K值
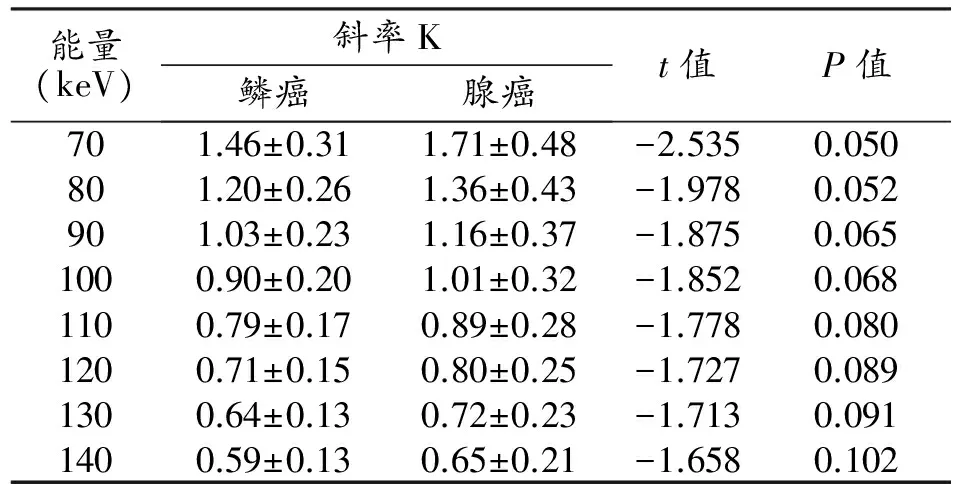
表2 肺腺癌和鳞癌静脉期K值
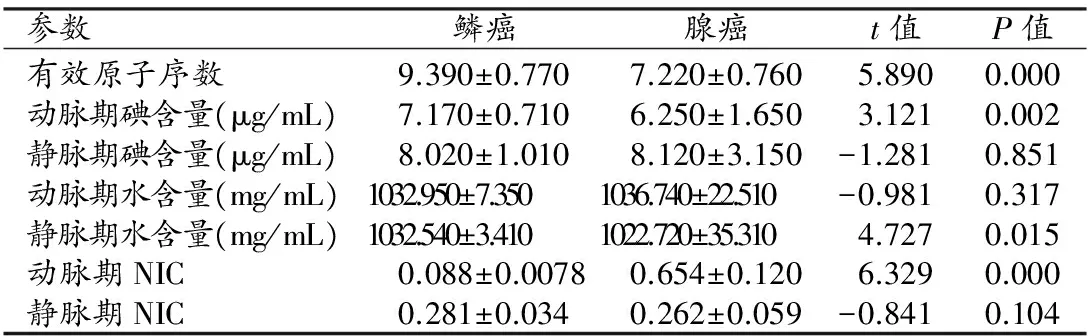
表3 肺腺癌和鳞癌的eff-Z、碘含量、水含量及NIC
讨 论
CT在肺部不同组织类型肿瘤的影像诊断方面并没有权威性的评价标准,而能谱CT在肿瘤鉴别的研究上已经起步[3-5]。能谱CT利用其特有的定量功能进行分析,本研究主要从以下几个方面进行评价:平均有效原子序数、能谱衰减曲线、斜率K和标准化碘含量及病灶形态及大小,探讨不同组织来源的肿瘤能谱多参数的差异。
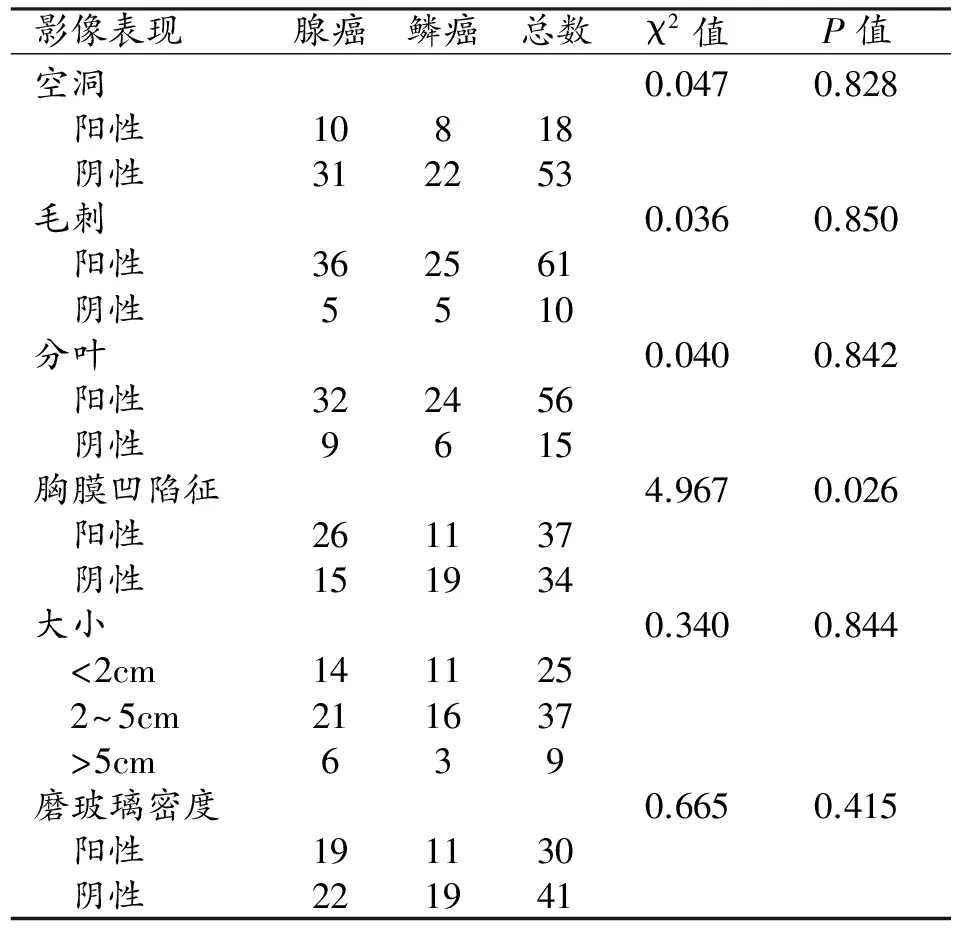
表4 肺腺癌和鳞癌影像表现
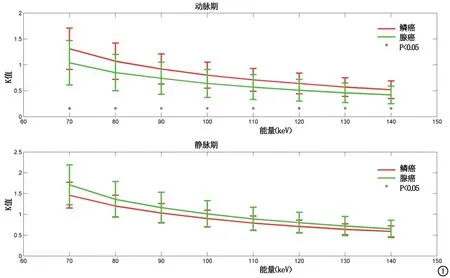
图1 肺腺癌和鳞癌动静脉各K值对应图。
1.平均有效原子序数对鉴别肺腺癌和鳞癌的价值
平均有效原子序数的概念是基于有效原子序数的,如果人体的某一种元素对X线的吸收衰减系数与某化合物或混合物的吸收衰减系数是一样的,那么该元素的原子序数就可以认定为是该化合物或混合物的有效原子序数[6]。平均有效原子序数与病灶的组织成分的关系密切,在X射线下不同的组织成分的各个单能量的衰减曲线不一样,故对应的平均有效原子序数不同。本研究中,肺腺癌和鳞癌的平均有效原子序数分别为7.22±0.76和9.39±0.77,差异有统计学意义(P≤0.05),说明有效原子序数在肺腺癌和鳞癌的诊断鉴别上具有一定的意义。两种病理类型的肺癌有效原子序数的差异可能与两者的组织结构致密度及组织类型有关。肺鳞癌的组织结构较致密,而腺癌中的腺泡型腺癌或细支气管肺泡癌组织密度较疏松。
2.能谱衰减曲线对鉴别肺腺癌和鳞癌的价值
不同X线能量下物质的CT值反映了不同能量下吸收衰减系数不一致,其所构成的能谱衰减曲线反应了ROI内的组织成分及构成,也反应了肺病灶对碘对比剂的吸收情况。而能谱衰减曲线的差异由能谱衰减曲线的斜率来衡量评估,本研究通过分别比较肺腺癌和鳞癌动、静脉期的不同能量级K值,获得肺腺癌和鳞癌差异最大的K值,两组动脉期差异有统计学意义(P≤0.05),说明动脉期能谱衰减曲线对于鉴别肺腺癌和鳞癌有较大的意义。
3.碘含量、水含量及NIC对鉴别肺腺癌和鳞癌的价值
碘是CT增强检查中对比剂的主要成分,而水是人体组织中最主要的成分,碘-水组合是能谱CT最基础最常用的基物质对,它包含了从影像中常见物质和碘对比剂的范围。有对肺部肿瘤的平均碘浓度的测定的研究表明平均碘浓度降低的肿瘤预后更差[7]。本研究中能谱CT的物质密度图像能够直观的看到被检部位的碘水含量情况,并且通过测得病灶内增强后的碘的含量来间接反映病灶的血流动力学。

图2 男,51岁,肺鳞癌。右肺上叶前段肺门旁见软组织肿块影,最大截面积约为4.7 cm×5.6 cm,呈分叶状,边缘小毛刺,邻近胸膜牵拉,右肺上叶前尖段支气管截断,走形僵直,周围肺纹理增多、紊乱,右肺门及纵隔淋巴结增大。a) 平扫期有效原子序数柱状图; b) 动脉期能谱衰减曲线; c) 动脉期碘、水散点图; d) 动脉期CT图像; e) 病理诊断为角化型鳞状细胞癌(×200,HE)。
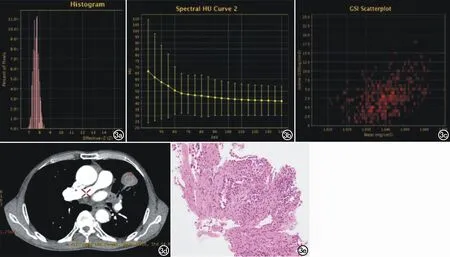
图3 男,72岁,肺腺癌。左肺上叶见不规则形团块影,呈分叶状,大小约为3.6 cm×3.4 cm,病灶边缘毛糙似可见毛刺征,内部支气管走形截断,邻近胸膜牵拉增厚。最终病理活检结果为。a) 平扫期有效原子序数柱状图; b) 动脉期能谱衰减曲线; c) 动脉期碘、水散点图; d) 动脉期CT图像; e) 浸润性腺癌(腺泡状生长为主)(×200,HE)。
本研究中,肺鳞癌和腺癌的动脉期碘含量分别为(7.17±0.71)μg/mL和(6.25±1.65)μg/mL,差异有统计学意义(P≤0.05)。而两者静脉期碘含量、动脉期水含量及静脉期水含量差异均无统计学意义。其可能原因为病灶的碘含量反应了该部位的微血管情况,而肺腺癌和鳞癌的微血管成熟度不一致[8-9]。以往的研究显示[10]增强CT中肺腺癌的CT值的变化与其内部的微血管密度有关,而CT值反映了病灶内碘含量的变化,故本研究中二者动脉期碘含量的差异性可能与病灶微血管的密度与成熟度的差异有联系。但是理论上肺腺癌的血管较鳞癌丰富,且研究表明肺腺癌的增生型血管成熟度高于肺鳞癌[9],增强后病灶内碘含量腺癌应该高于腺癌,本研究中动脉期碘含量与以上依据相冲突,可能原因为本研究中的动脉期病灶中的碘对比剂并未达到高峰段,大部分腺癌增强CT值在60 s左右达到峰值[11]。也可能与本研究样本量较小有关。
本研究中两种病理类型的NIC在动脉期有显著差异,而静脉期没有明显差异,其可能原因为肺腺癌和鳞癌的组织细胞渗透性、血流量、血液体积平均通过时间不一致,Shi等[12]对肺非小细胞肺癌的亚型做了定量评估,表明不同病理类型的肺癌肿瘤渗透性有明显差异。肺腺癌与鳞癌动静脉期碘含量及NIC的差异性可能与张周芳等[13]研究表明不同病理类型肺肿瘤CT值达到峰值时间的差异性有关。
4.病灶形态及大小对鉴别肺腺癌和鳞癌的价值
病灶的形态及大小的评价是能谱CT和普通CT均能做到的,纳入本研究讨论是因为病灶的不同病理类型有不一样的生长方式,形态及大小是对病灶最直观也最重要的评估。本研究中将CT征象中的有无毛刺、磨玻璃样改变、胸膜凹陷征、分叶及病灶大小对肺鳞癌和腺癌进行比较,其中两者胸膜凹陷征的差异有统计学意义(P≤0.05);余各征象差异均无统计学意义。其中磨玻璃样改变在腺癌与鳞癌间差异无统计学意义(P=0.415),分别有19及11例;但是,含磨玻璃病灶的肺癌大多数为腺癌[14-15],其病理基础为癌细胞沿肺泡间隔生长导致肺泡壁增厚而肺泡腔未完全闭塞,内有脱落的伏壁式生长的癌细胞及少量粘液[16];而鳞癌的肿块边缘可以出现磨玻璃密度,但是该类病灶多数是腺鳞癌或肿块周围的炎症或渗出改变,与半实性结节的腺癌不同。
综上所述,能谱CT作为一种全新的技术,能为肺部肿瘤分型提供多项定量分析的参数依据。随着临床经验的积累与能谱CT参数越来越透彻的研究,相信在不远的未来能谱CT将为临床提供更可靠的包括肺腺癌与鳞癌在内的肺部肿瘤的影像鉴别诊断依据,能谱CT将为临床诊断提供更多的应用价值。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] 邓凯,张成琪,李伟,等.宝石能谱CT的特点及临床应用价值[J].中国医药导报,2011,8(25):16-17.
[3] 张静,林晓珠,徐学勤,等.CT能谱成像在胰岛素瘤诊断中的初步研究[J].放射学实践,2012,27(3):250-253.
[4] 郁义星,林晓珠,陈克敏,等.CT能谱成像在诊断肝癌和血管平滑肌脂肪瘤中的价值[J].临床放射学杂志,2012,31(9):1274-1278.
[5] 郭浩,邵伟光,张东雯,等.CT能谱曲线对肝脏小肿瘤性病变的鉴别诊断价值初探[J].中国医学影像技术,2014,30(4):552-555.
[6] 黄仁军.能谱CT的临床应用与研究进展[J].放射学实践,2015,30(1):81-83.
[7] Aoki M,Hirose K,Sato M,et al.Prognostic impact of average iodine density assessed by dual-energy spectral imaging for predicting lung tumor recurrence after stereotactic body radiotherapy[J].J Radiat Res,2016,57(4):381-386.
[8] Liu J,Xiong Z,Hu C,et al.Correlation between multi-slice spiral CT pulmonary perfusion imaging and cavity of microvessel in lung cancer[J].中南大学学报医学版,2010,35(12):1242-1247.
[9] Padera TP,Stoll BR,Tooredman JB,et al.Pathology:cancer cells compress intratumour vessels[J].Nature,2004,427(6976):695.
[10] Tateishi U,Nishihara H,Watanabe S,et al.Tumor angiogenesis and dynamic CT in lung adenocarcinoma:radiologic-pathologic correlation[J].J Comput Assist Tomogr,2001,25(1):23-27.
[11] Zhang M,Kono M.Solitary pulmonary nodules:evaluation of blood flow patterns with dynamic CT[J].Radiology,1997,205(2):471-478.
[12] Shi J,Schmid-Bindert G,Fink C,et al.Dynamic volume perfusion CT in patients with lung cancer:baseline perfusion characteristics of different histological subtypes[J].Eur J Radiol,2013,82(12):e894-e900.
[13] 张周芳,黄洁惠,邵国良.双源CT双能量成像在肺癌病理类型鉴别中的应用价值[J].肿瘤学杂志,2015,21(5):392-395.
[14] Park CM,Goo JM,Lee HJ,et al.Nodular ground-glass opacity at thin-section CT:histologic correlation and evaluation of change at follow-up[J].Radiographics,2007,27(2):391-408.
[15] Nakajima R,Yokose T,Kakinuma R,et al.Localized pure ground-glass opacity on high-resolution CT:histologic characteristics[J].J Comput Assist Tomogr,2002,26(3):323-329.
[16] Engeler CE,Tashjian JH,Trenkner SW,et al.Ground-glass opacity of the lung parenchyma:a guide to analysis with high-resolution CT[J].AJR,1993,160(2):249-251.
Value of spectral CT quantitative analysis in the differential diagnosis of pulmonary adenocarcinoma and squamous cell carcinoma
NING Xian-ying,LI Hao,YANG Ming,et al.
Department of Radiology,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Whuhan 430022,China
Objective:To evaluate the value of spectrum CT in the differential diagnosis of pulmonary adenocarcinoma and squamous cell carcinoma.Methods:Patients with clinically suspicious pulmonary space occupying lesion requiring further examination were collected.There were 41 cases with pathology proven adenocarcinoma and 30 cases with squamous cell carcinoma.Using GSI (Gemstone Spectral Imaging) sequence for lung scanning with spectrum CT,the repetition of iodine concentration,water concentration,and effective atomic number in the region of interest were measured.The slope of spectral curve (K) and NIC in the region were also calculated.Independent-samplesttest was used to analyze the parameters of the two groups.Results:The effective atomic number (eff-Z) of adenocarcinoma and squamous cell carcinoma was 9.39±0.77 and 7.22±0.76 respectively,the iodine concentration at arterial phase was 7.17±0.71 and 6.25±1.65 respectively,the NIC at arterial phase was 0.088±0.007 and 0.654±0.120 respectively,the water concentrations at venous phase was 1032.54±3.41 and 1022.72±35.31 respectively,all with significant statistical difference and the K value as well (allP<0.05).No significant difference was existed in iodine concentration (P=0.851) and NIC at venous phase (P=0.104),as well as water concentrations at arterial phase (P=0.317).Conclusion:Quantitative parameters analysis using spectral CT provides certain significance in the differential diagnosis of pulmonary adenocarcinoma and squamous cell carcinoma.
Tomography,X-ray computed; Spectral imaging; Lung neoplasms; Lung adenocarcinoma; Squamous cell lung carcinoma; Diagnosis,differential
430022 武汉,华中科技大学同济医学院附属协和医院放射科
宁先英(1986-),女,湖南常德人,硕士,技师,主要从事CT影像技术工作。
余建明,E-mail:cjr.yujianming@vip.163.com
R814.42; R734.2
A
1000-0313(2017)03-0237-05
10.13609/j.cnki.1000-0313.2017.03.007
2016-07-07)
