孕早期流产物的高通量测序研究
2017-03-30乞艳华余珊珊李小鹏麻妙艳邬晋芳雷小莹
乞艳华,余珊珊,李小鹏,麻妙艳,邬晋芳,周 琦*,雷小莹
(1西安交通大学第二附属医院超声科,西安 710032;2西安交通大学第二附属医院妇产科;*通讯作者,E-mail:13909232905@163.com)
孕早期流产物的高通量测序研究
乞艳华1,余珊珊1,李小鹏1,麻妙艳1,邬晋芳2,周 琦1*,雷小莹1
(1西安交通大学第二附属医院超声科,西安 710032;2西安交通大学第二附属医院妇产科;*通讯作者,E-mail:13909232905@163.com)
目的 探讨高通量测序技术在孕早期流产物检测中的应用价值。 方法 收集2014-02~2016-10在西安交通大学第二附属医院就诊的胚胎停止发育孕妇45例。取流产物组织,进行高通量测序及染色体核型分析。 结果 共收集到有效样本44例,高通量测序11例(25.00%)在检测范围内未检出已知致病性染色体畸变;19例(43.18%)染色体数目异常或嵌合体;14例(31.82%)染色体部分片段拷贝缺失或呈多态性。核型分析12例(27.27%)染色体数目异常或嵌合体。 结论 高通量测序技术对流产物的检出阳性率高于核型分析,尤其在染色体微缺失和微重复检出上有明显优势,可用于临床上不明原因流产的病因学检查。
高通量测序技术; 染色体核型分析; 流产
近年来,随着国家计划生育政策的调整以及人们生育观念的转变,高龄高危孕妇逐年增多。孕妇早期出血、胚胎停止发育者比例升高,引起了医务工作者的注意。自然流产的病因复杂,包括胚胎染色体异常、孕妇内分泌失调、母胎血型不合、免疫因素、精神因素以及孕妇全身心疾病等都会导致流产的发生,其中胎儿染色体异常在早期流产中占据很大比例[1]。目前对染色体异常的检测手段主要是核型分析,因受细胞培养及核型显带分辨率的影响,检出率为5 Mb左右[2]。随着高通量测序技术在产前诊断中的逐步应用,我们采用高通量测序技术检测孕早期流产物,明确流产原因,为下次妊娠提供遗传指导。
1 对象与方法
1.1 对象
2014-02~2016-10在西安交通大学第二附属医院就诊的胚胎停止发育孕妇45例,孕妇年龄21-38岁,平均年龄30岁,孕周7-20周,平均孕周12周。45例孕妇均为自然受孕,26例为初次妊娠,19例为复发性妊娠,复发性流产中流产2次的共7例。
1.2 流产物测序及核型分析方法
取流产物10 mg,无菌PBS缓冲液冲洗,提取DNA,超声波打断使基因组DNA成小片段核酸。采用酶反应的方法,将打断后的DNA小片段5′端突出末端补平或将3′端突出末端削平。T4 DNA连接酶将接头连接在DNA片段两端,琼脂糖凝胶切胶回收合适范围的片段。PCR扩增、纯化,构建测序文库。多个测序文库index标记后测序,测序采用Hiseq2000高通量测序仪(美国Illumina公司)。对测得的序列片段与已知人类参考基因组比对(hgl9)进行数据分析。参照已发表研究中的Fused Lasso算法确定染色体片段的重复或缺失[3]。在全基因组水平筛选出待检样本的DNA重复或缺失区域,并将检测数据与基因变异数据库(database of genomic variants,DGV)、人类染色体变异数据库(database of chromosomal imbalance and phenotype in humans using ensembl resources,DECIPHER)和在线人类孟德尔遗传数据库(online Mendelian inheritance in man,OMIM)进行匹配得出拷贝数变异的意义。
流产物核型分析:流产物采用常规消化法处理,5%CO2,37 ℃温箱培养,收获分离,滴片制片烤片,胰蛋白酶消化,吉姆萨染色,G显带,每例镜下计数30个核型,分析5个核型,嵌合体加倍计数,必要时做C带和N带。G带分辨率为320-400条带。
2 结果
共计检测45例流产物,其中1例因母源性污染被排除,因此有效样本为44例,阳性结果见表1。
表1 流产物测序及核型分析结果
Table 1 The results of sequencing technology and karyotype analysis for the abortion
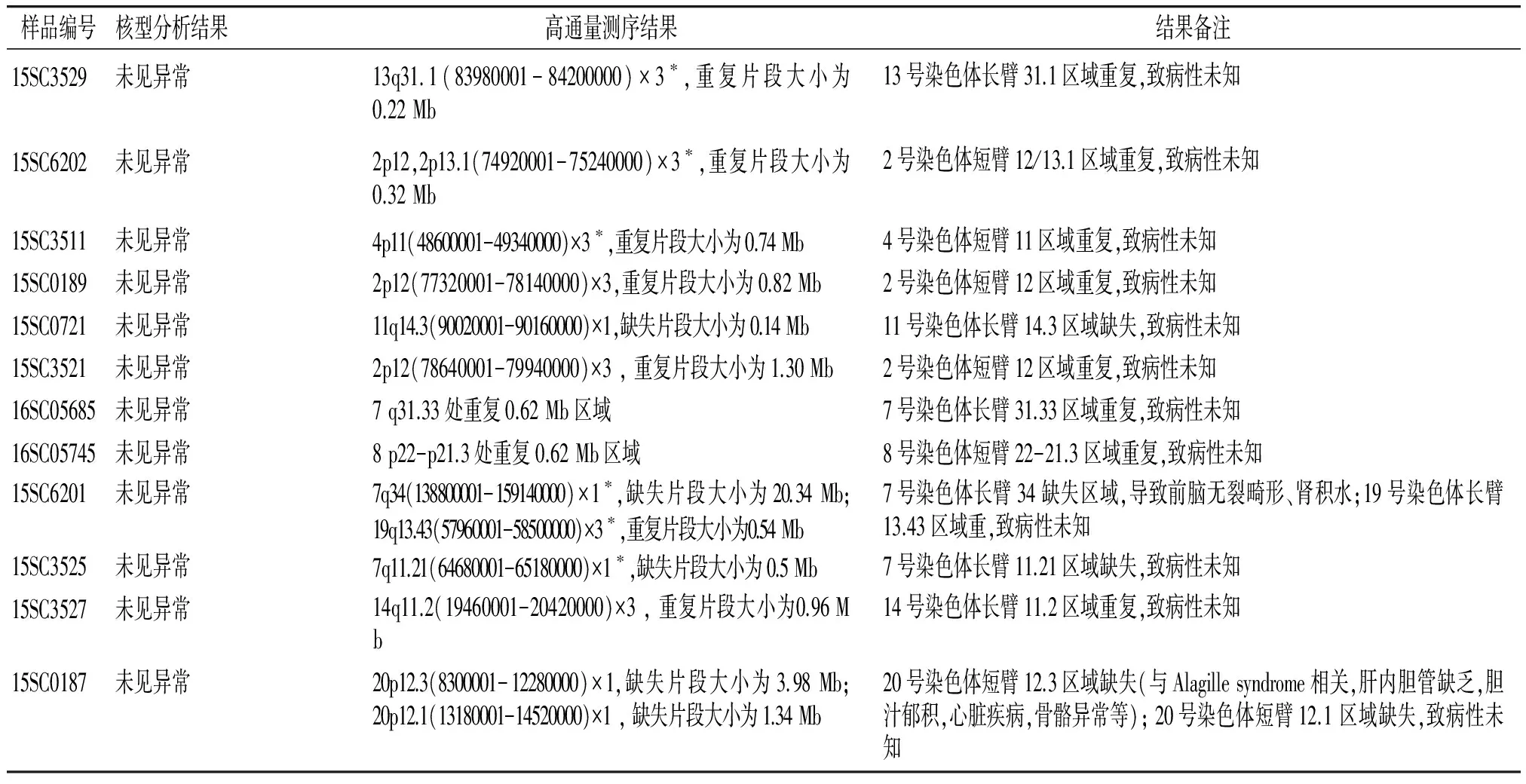
样品编号核型分析结果高通量测序结果结果备注15SC3529未见异常13q31.1(83980001-84200000)×3∗,重复片段大小为0.22Mb13号染色体长臂31.1区域重复,致病性未知15SC6202未见异常2p12,2p13.1(74920001-75240000)×3∗,重复片段大小为0.32Mb2号染色体短臂12/13.1区域重复,致病性未知15SC3511未见异常4p11(48600001-49340000)×3∗,重复片段大小为0.74Mb4号染色体短臂11区域重复,致病性未知15SC0189未见异常2p12(77320001-78140000)×3,重复片段大小为0.82Mb2号染色体短臂12区域重复,致病性未知15SC0721未见异常11q14.3(90020001-90160000)×1,缺失片段大小为0.14Mb11号染色体长臂14.3区域缺失,致病性未知15SC3521未见异常2p12(78640001-79940000)×3,重复片段大小为1.30Mb2号染色体短臂12区域重复,致病性未知16SC05685未见异常7q31.33处重复0.62Mb区域7号染色体长臂31.33区域重复,致病性未知16SC05745未见异常8p22-p21.3处重复0.62Mb区域8号染色体短臂22-21.3区域重复,致病性未知15SC6201未见异常7q34(138800001-159140000)×1∗,缺失片段大小为20.34Mb;19q13.43(57960001-58500000)×3∗,重复片段大小为0.54Mb7号染色体长臂34缺失区域,导致前脑无裂畸形、肾积水;19号染色体长臂13.43区域重,致病性未知15SC3525未见异常7q11.21(64680001-65180000)×1∗,缺失片段大小为0.5Mb7号染色体长臂11.21区域缺失,致病性未知15SC3527未见异常14q11.2(19460001-20420000)×3,重复片段大小为0.96Mb14号染色体长臂11.2区域重复,致病性未知15SC0187未见异常20p12.3(8300001-12280000)×1,缺失片段大小为3.98Mb;20p12.1(13180001-14520000)×1,缺失片段大小为1.34Mb20号染色体短臂12.3区域缺失(与Alagillesyndrome相关,肝内胆管缺乏,胆汁郁积,心脏疾病,骨骼异常等);20号染色体短臂12.1区域缺失,致病性未知
表1 流产物测序及核型分析结果 (续表)
Table 1 The results of sequencing technology and karyotype analysis for the abortion (continuing)
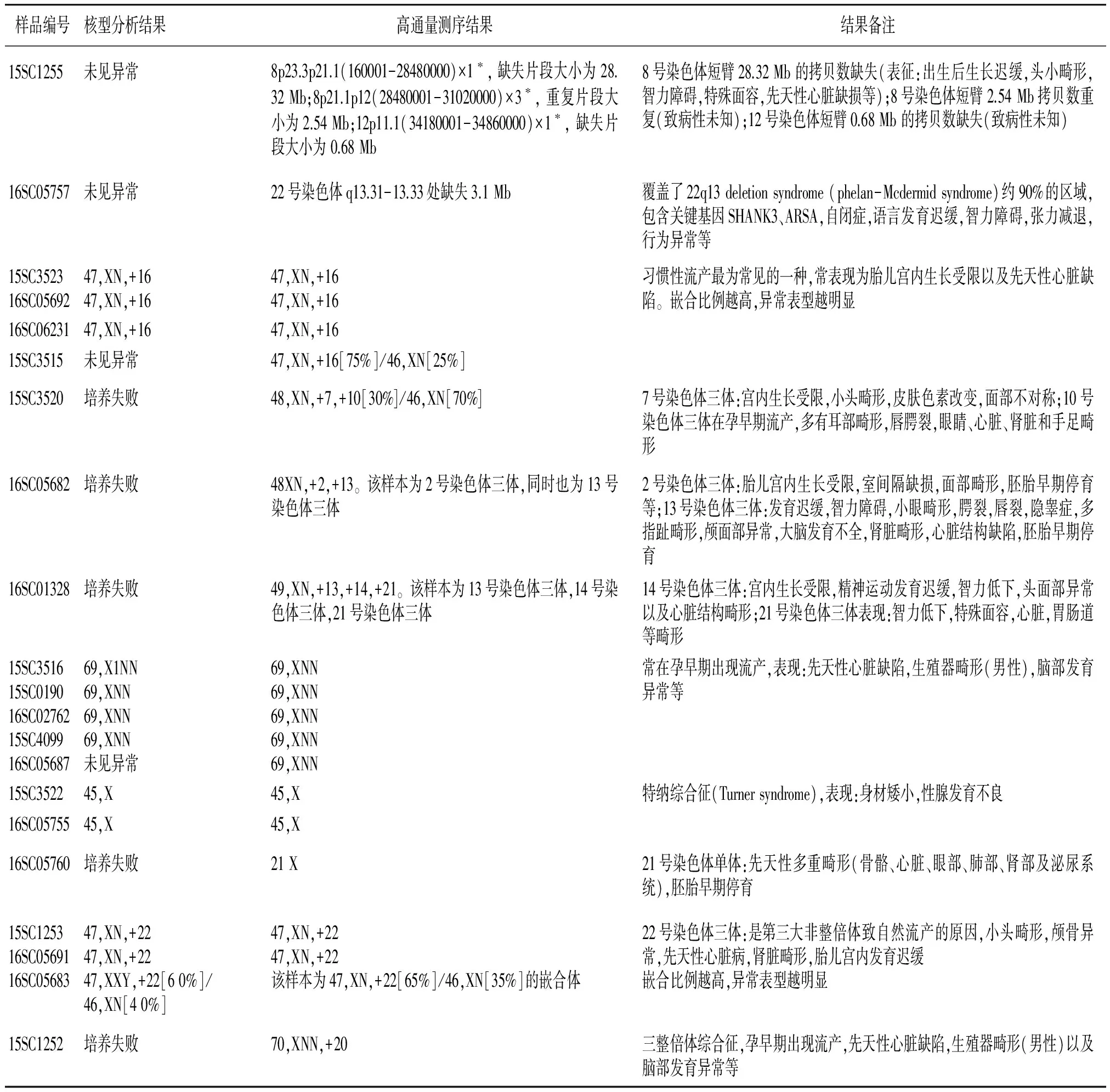
样品编号核型分析结果高通量测序结果结果备注15SC1255未见异常8p23.3p21.1(160001-28480000)×1∗,缺失片段大小为28.32Mb;8p21.1p12(28480001-31020000)×3∗,重复片段大小为2.54Mb;12p11.1(34180001-34860000)×1∗,缺失片段大小为0.68Mb8号染色体短臂28.32Mb的拷贝数缺失(表征:出生后生长迟缓,头小畸形,智力障碍,特殊面容,先天性心脏缺损等);8号染色体短臂2.54Mb拷贝数重复(致病性未知);12号染色体短臂0.68Mb的拷贝数缺失(致病性未知)16SC05757未见异常22号染色体q13.31-13.33处缺失3.1Mb覆盖了22q13deletionsyndrome(phelan-Mcdermidsyndrome)约90%的区域,包含关键基因SHANK3、ARSA,自闭症,语言发育迟缓,智力障碍,张力减退,行为异常等15SC352316SC0569247,XN,+1647,XN,+1647,XN,+1647,XN,+16习惯性流产最为常见的一种,常表现为胎儿宫内生长受限以及先天性心脏缺陷。嵌合比例越高,异常表型越明显16SC0623147,XN,+1647,XN,+1615SC3515未见异常47,XN,+16[75%]/46,XN[25%]15SC3520培养失败48,XN,+7,+10[30%]/46,XN[70%]7号染色体三体:宫内生长受限,小头畸形,皮肤色素改变,面部不对称;10号染色体三体在孕早期流产,多有耳部畸形,唇腭裂,眼睛、心脏、肾脏和手足畸形16SC05682培养失败48XN,+2,+13。该样本为2号染色体三体,同时也为13号染色体三体2号染色体三体:胎儿宫内生长受限,室间隔缺损,面部畸形,胚胎早期停育等;13号染色体三体:发育迟缓,智力障碍,小眼畸形,腭裂,唇裂,隐睾症,多指趾畸形,颅面部异常,大脑发育不全,肾脏畸形,心脏结构缺陷,胚胎早期停育16SC01328培养失败49,XN,+13,+14,+21。该样本为13号染色体三体,14号染色体三体,21号染色体三体14号染色体三体:宫内生长受限,精神运动发育迟缓,智力低下,头面部异常以及心脏结构畸形;21号染色体三体表现:智力低下,特殊面容,心脏,胃肠道等畸形15SC351615SC019016SC0276215SC409916SC0568769,X1NN69,XNN69,XNN69,XNN未见异常69,XNN69,XNN69,XNN69,XNN69,XNN常在孕早期出现流产,表现:先天性心脏缺陷,生殖器畸形(男性),脑部发育异常等15SC352245,X45,X特纳综合征(Turnersyndrome),表现:身材矮小,性腺发育不良16SC0575545,X45,X16SC05760培养失败21X21号染色体单体:先天性多重畸形(骨骼、心脏、眼部、肺部、肾部及泌尿系统),胚胎早期停育15SC125316SC0569116SC0568347,XN,+2247,XN,+2247,XXY,+22[60%]/46,XN[40%]47,XN,+2247,XN,+22该样本为47,XN,+22[65%]/46,XN[35%]的嵌合体22号染色体三体:是第三大非整倍体致自然流产的原因,小头畸形,颅骨异常,先天性心脏病,肾脏畸形,胎儿宫内发育迟缓嵌合比例越高,异常表型越明显15SC1252培养失败70,XNN,+20三整倍体综合征,孕早期出现流产,先天性心脏缺陷,生殖器畸形(男性)以及脑部发育异常等
高通量测序结果:11例在检测范围内未检出已知致病性染色体畸变(见图1A),阴性率为25.00%(11/44)。19例染色体数目异常或嵌合体,占比43.18%(19/44),其中5例69XNN(样本编号15SC3516,15SC0190,16SC02762,15SC4099,16SC05687)、3例16-三体(样本编号15SC3523,16SC05692,16SC06231)、2例22-三体(15SC1253,16SC05691)、2例45X(样本编号15SC3522,16SC05755)、1例70XNN(样本编号15SC1252)、1例21单体(样本编号16SC05760)、2例多条染色体异常(样本编号16SC05682,16SC01328),3例多条染色体嵌合体(样本编号15SC3515,15SC3520,16SC05683)(见图1B,16-三体;图1C,69,XNN)。14例检测结果中存在染色体部分片段拷贝缺失或呈多态性,占比31.82%(14/44)(见图1D)。
核型分析结果:5例培养失败,27例未见异常,12例染色体数目异常或嵌合体(27.27%,12/44)。
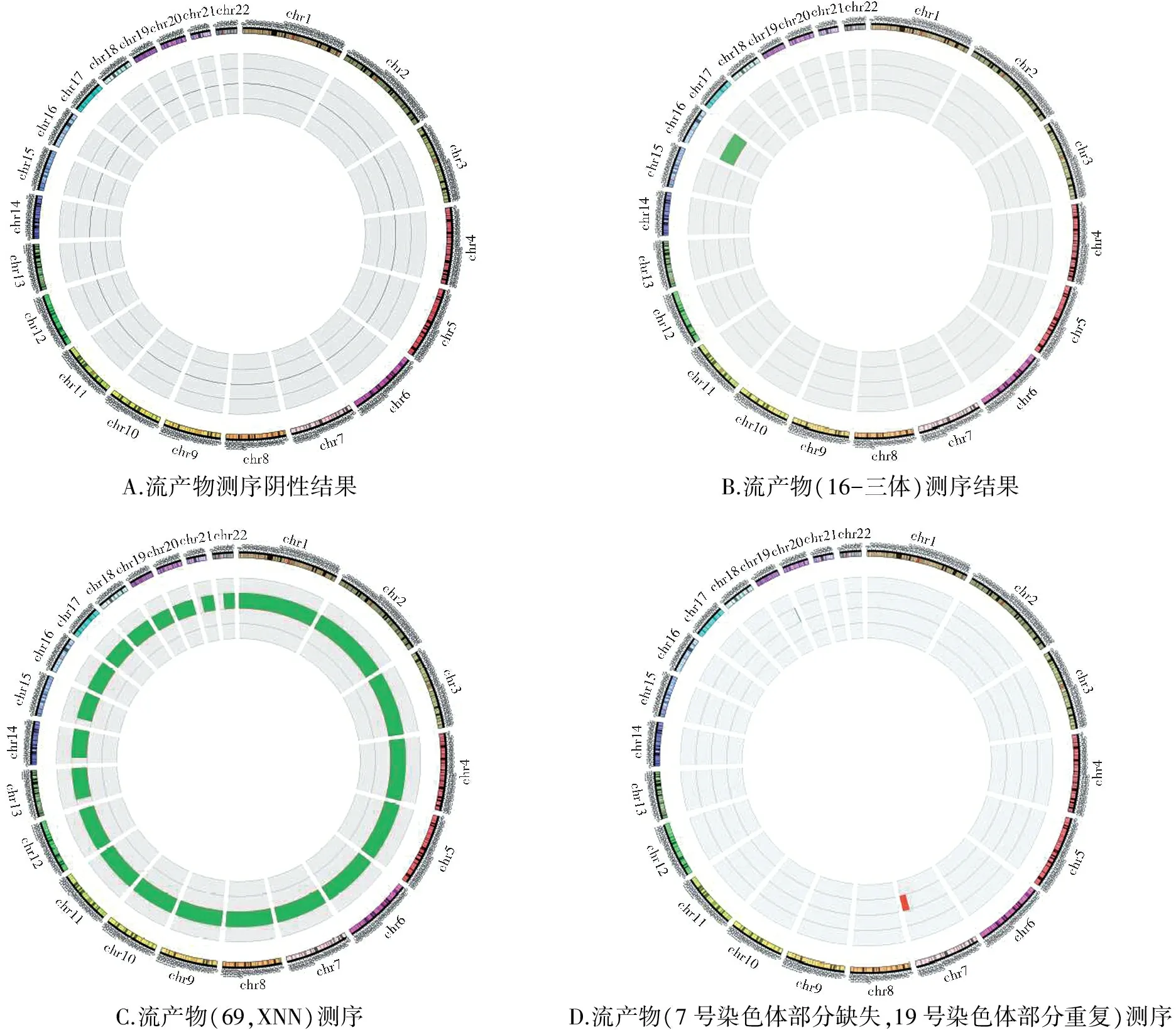
A.流产物测序阴性结果B.流产物(16-三体)测序结果C.流产物(69,XNN)测序D.流产物(7号染色体部分缺失,19号染色体部分重复)测序
1-22号染色体用环形图表示,内圈红色表示该区域存在缺失,绿色表示该区域存在重复
图1 不同流产物测序结果
Figure 1 The sequencing results of the abortion tissues
3 讨论
在人类妊娠过程中,自然流产已成为一种非常重要的优胜劣汰法则。据资料统计,孕早期自然流产发生率占10%-15%,对患者产生较大的心理负担。造成流产的病因非常复杂,如遗传、免疫、解剖、内分泌、感染、环境及其他未知因素等,而遗传因素对自然流产发生的影响更加突出,占50%-60%,其中染色体的异常最为常见[1]。
染色体异常的检测手段随着近年来生物检测技术的发展而更加丰富多样,如荧光原位杂交技术(FISH)、多重探针扩增技术(MLPA)、基因芯片法(arrayCGH、SNParray)等,这些技术虽能将检出率提高一些,但是受限于技术原理,只能检测到芯片探针覆盖的染色体区域,这就限制了发现新的染色体畸变,因而限制了其临床广泛应用。高通量测序技术明显优于其他技术[4],可以覆盖46条染色体非整倍体以及大于100 kb的染色体拷贝数变异(copy number variation,CNVs),由于是全基因组均匀覆盖,因此能发现芯片平台未覆盖到的CNVs[5],进而发现新的染色体疾病,且还能检出5%以上的嵌合体[6,7]。因此与其他技术相比更适用于临床应用,有学者尝试了羊水中游离胎儿DNA的测序,取得了较为理想的结果[8]。
我们用高通量测序及核型分析检测了45例自然流产的绒毛组织,有效样本44例。高通量测序共计检出33例(75%)染色体异常,其中19例为染色体数目异常或嵌合体,占比43.18%,5例69XNN、3例16-三体、2例22-三体、2例45X、1例70XNN、1例21单体、2例多条染色体异常,3例多条染色体嵌合体。本研究结果发现,与早期流产密切相关的染色体异常为69XNN,16-三体及其嵌合体,22-三体等,未见集中在13号、18号、21号上,所以临床上曾经选用FISH做流产物分析,因探针受限,常选择13号、18号、21号、X、Y染色体探针进行流产物分析意义不大,检出率低[9]。核型分析仅发现12例(27.27%)染色体异常,检出率明显低于高通量测序。高通量测序检测出14例存在染色体部分片段拷贝缺失或呈多态性,占比31.82%,染色体的部分片段拷贝缺失或多态性,可能影响胚胎早期发育,但是其致病性未知,这一部分是需要更进一步研究改变和致病性间的关系。本研究结果与其他学者报道相一致[10]。2014年Liang等[11]研究发现从疑难家系揭示CNVs与疾病之间的关系,当CNVs缺失未达到一定的剂量时,相应缺失部分的基因补代偿,疾病不表现,当缺失到达一定剂量,相应缺失部分的基因无法补偿时产生临床表现。
本研究中的高通量测序方法是单端测序,尚不能解决易位、倒位问题。随着双端测序,环形测序、单细胞测序,到文库构建中优化后的CSMART(循环单分子扩张和重测序技术)、Meta pair(双端末端配对测序)等方法的发展,解决易位、倒位、嵌合、微缺失、微重复、单基因、单亲二倍体等都会成为现实。最新研究结果显示,CSMART方法[12]已经成功产前无创诊断了Wilson单基因疾病,同样也可应用于检测其他单碱基变异、微缺失或插入等致病突变,而且还能运用于肿瘤早期诊断,定量血液中低水平的肿瘤特异性循环DNA和检测患者对治疗的反应。
综上所述,高通量测序技术对流产物的检出阳性率高于核型分析,尤其在染色体微缺失微重复检出上有明显优势,可用于临床上不明原因流产的病因学检查。胚胎早期停止发育绝大多数是由胚胎染色体异常导致的。随着高通量测序技术的不断发展,流产物测序所能带给人们的遗传信息也会更加丰富,进一步后续研究缺失与致病性的关系显得更为重要,这将为孕妇遗传学咨询开辟新的前景。
[1] Islam MM,Bakheit CS.Advanced maternal age and risks for adverse pregnancy outcomes:a population-based study in oman[J].Health Care Women Int,2015,36(10):1081-1103.
[2] Rajcan-Separovic E.Chromosome microarrays in human reproduction[J].Hum Reprod Update,2012,18(5):555-567.
[3] Wang Y,Chen Y,Tian F,etal.Maternal mosaicism is a significant contributor to discordant sex chromosomal aneuploidies associated with noninvasive prenatal testing[J].Clin Chem,2014,60(1):251-259.
[4] Cohen K,Tzika A,Wood H,etal.Diagnosis of fetal submicroscopic chromosomal abnormalities in failed array CGH samples:copy number by sequencing as an alternative to microarrays for invasive fetal testing[J].Ultrasound Obstet Gynecol,2015,45(4):394-401.
[5] Wang Z,Andrews P,Kendall J,etal.SMASH,a fragmentation and sequencing method for genomic copy number analysis[J].Genome Res,2016,26(6):844-851.
[6] Ruttanajit T,Chanchamroen S,Cram DS,etal.Detection and quantitation of chromosomal mosaicism in human blastocysts using copy number variation sequencing[J].Prenat Diagn,2016,36(2):154-162.
[7] Campuzano O,Sarquella-Brugada G,Mademont-Soler I,etal.Identification of genetic alterations,as causative genetic defects in long QT syndrome,using next generation sequencing technology[J].Plos One,2014,9(12):e114894.
[8] Qi Q,Lu S,Zhou X,etal.Copy number variation sequencing-based prenatal diagnosis using cell-free fetal DNA in amniotic fluid[J].Prenat Diagn,2016,36(6):576-583.
[9] 周佳,蔡彩萍,姚红霞,等.FISH技术在检测自然流产绒毛组织非整倍体异常中的应用研究[J].生殖与避孕,2013,33(5):351-353.
[10] Liu S,Song L,Cram DS,etal.Traditional karyotyping vs copy number variation sequencing for detection of chromosomal abnormalities associated with spontaneous miscarriage[J].Ultrasound Obstet Gynecol,2015,46(4):472-477.
[11] Liang D,Peng Y,LV W,etal.Copy number variation sequencing for comprehensive diagnosis of chromosome disease syndromes[J].J Mol Diagn,2014,16(5):519-526.
[12] Lv W,Wei X,Guo R,etal.Non-invasive prcnatal testing for wilson disease by use of circulating single-molecule amplification and resequeneing technology(cSMART)[J].Clin Chem,2015,61(1):172-181.
Application of high-throughput sequencing technology for analying the abortion of the early pregnancy
QI Yanhua1,YU Shanshan1,LI Xiaopeng1,MA Miaoyan1,WU Jinfang2,ZHOU Qi1*,LEI Xiaoying1
(1DepartmentofUltrasound,SecondAffiliatedHospital,Xi’anJiaotongUniversity,Xi’an710032,China;2DepartmentofObstetricsandGynecology,SecondAffiliatedHospital,Xi’anJiaotongUniversity;*Correspondingauthor,E-mail:13909232905@163.com)
ObjectiveTo explore the value of high-throughput sequencing technique in detection of the abortion of the early pregnancy.MethodsForty-five cases of abortion tissue from Second Affiliated Hospital of Xi’an Jiaotong University from February 2014 to October 2016 were selected.The tissues of abortion were collected to perform high-throughput sequencing technology and chromosomal karyotypes analysis.ResultsA total of 44 cases of effective samples were collected.The results of high-throughput sequencing technology showed that 11 cases(25.00%)were not found the known pathogenic chromosome aberration in the test range,and there were 19 cases(43.18%)of abnormal chromosome number or chimera and 14 cases(31.82%)of chromosome fragment copies part missing or polymorphism.Twelve cases(27.27%)of abnormal chromosome number or chimera were found by chromosomal karyotypes analysis.ConclusionThe positive rate of abortion tissue by high-throughput sequencing technology is higher than that of chromosomal karyotype analysis,especially in chromosome micro-deletion and micro-duplication.High-throughput sequencing technology is recommended to be applied to clinical diagnosis of unknown reason abortion.
high-throughput sequencing technology; chromosome karyotype analysis; abortion
陕西省社会发展科技攻关项目(2015SF126,2016SF014)
乞艳华,女,1981-10生,在读博士,主治医师,E-mail:18991188001@189.cn
2016-12-12
R741.21
A
1007-6611(2017)03-0271-05
10.13753/j.issn.1007-6611.2017.03.016
