两株耐高温酵母菌的鉴定及其特性研究
2017-03-30宋培勇曾伯平肖仲久
宋培勇,曾伯平,肖仲久
(遵义师范学院生物与农业科技学院,贵州 遵义 563000)
随着石油资源的日渐枯竭,寻找并开发可再生能源是人类的必然选择。可再生能源包括太阳能、水能、潮汐能、风能和生物质能等。乙醇就是一种生物质能,用途广泛,可用作燃料、饮料、化工原料、溶剂和消毒剂等。作为车用燃料的乙醇汽油在减少CO、HC、NOx、颗粒物和苯系物等有毒物质排放方面具有显著功效,可以减少环境污染物的排放,显著改善空气质量[1]。 酵母菌利用EMP途径进行同型乙醇发酵,而细菌利用ED途径进行同型乙醇发酵。酵母菌由于其卓越的发酵性能和耐受高温以及在预处理和发酵过程中产生副产物的能力,用作乙醇生产比细菌更有效[2]。有多种原料可以用作乙醇生产的潜在底物,如甘蔗、糖用甜菜、甜高粱、乳清和糖蜜等糖类,玉米、小麦、木薯和马铃薯等淀粉类,柴草、农作物秸秆和残茬等木质纤维素类[2]。纤维素是地球上含量最丰富的可再生资源[3],用木质纤维素类物质通过微生物乙醇发酵生产燃料乙醇是解决当今能源短缺的理想途径,而在各种乙醇发酵方法中,最具发展潜力和优势的方法之一就是同步糖化发酵法(simultaneous saccharification and fermentation,SSF)。同步糖化发酵法这一概念最早是由Gauss等[4]于1976年提出的,所谓同步糖化发酵就是纤维素的酶解(即糖化)和乙醇发酵在同一装置内同步进行。同步糖化发酵法工艺流程短、设备投资少、乙醇产量高、生产成本低。但是SSF法也存在致命缺点,即酶水解的最适温度(55℃)和发酵温度(30℃)不一致。为此,人们把目光投向了耐高温酵母菌。耐高温酵母是高温条件下成功生产乙醇的关键因素,高温发酵生产乙醇具有冷却成本低、污染风险小、节约糖化酶的使用等多种优点[5]。选育耐高温酵母可以采取高温驯化[6-8]、杂交育种、诱变育种、原生质体融合[9]和基因工程等技术措施。从高温自然环境中筛选耐高温酵母,虽然工作量较大,但筛选获得的酵母遗传性状稳定,仍不失为一种可行、可靠和可取的方法。
1 材料与方法
1.1 试验材料
土样:试验土样从贵州茅台酒厂附近常年堆放酒糟的地段采集。
培养基:YEPD培养基[10]、胡萝卜块培养基[11],PDA培养基、McClary培养基、蛋白胨水培养基、硝酸盐还原培养基、碳源同化基础培养基、氮源同化基础培养基[12-13]、种子培养基[14],EFM 培养基[15],均参考相关文献进行配制。
主要仪器设备:PCR扩增仪S1000TM Thermal Cycler(Bio-Rad),WD-9413A凝胶成像分析仪、DYY-10C型电泳仪(北京六一),GC7890型气相色谱仪(美国安捷伦),T6紫外可见分光光度计(北京普析通用仪器公司)。
主要药品及试剂:PCR引物NL-1:5′-GC ATATCAATAAGCGGAGGAAAAG-3′、NL- 4:5′-GGTCCGTGTTTCAAGACGG- 3′(上海生工生物技术有限公司合成),200 bp DNA Ladder(北京天根生化科技); PCR试剂盒(北京全式金生物技术有限公司)。
1.2 试验方法
1.2.1 酵母菌的分离 称取土样,用无菌水进行梯度稀释制成10-3、10-4的土壤悬液,然后采取无菌操作技术吸取0.1 mL涂布于PDA平板上,每个稀释度接2个平板,于28~30℃培养,待长出菌落后,挑取单菌落划线转接于PDA平板,连续2 次,以获得纯培养,斜面保存备用。
1.2.2 高温酵母的筛选 从PDA斜面挑取酵母菌纯培养物转接到YEPD平板上,分别在37、40、 41、42、43、44、45、46、47℃下培养 48 h,观察其生长状况。通过菌落形态、细胞形态、产生子囊孢子和掷孢子与否及是否形成假菌丝等进行形态学及生理鉴定鉴定。
1.2.3 生化特征测试 进行硝酸盐还原试验、糖发酵试验、碳源同化试验、氮源同化试验、产类淀粉化合物测定。
1.2.4 PCR扩增 酵母菌基因组DNA模板按文献[16]方法准备并略作改动:从长出酵母菌菌落且经4℃过夜的YEPD平板上挑取菌落,悬浮在100 μL灭菌去离子水中,放超低温冰箱(-75℃)中冻透,然后取出放沸水中煮10 min,放-20℃保存备用。26S rDNA D1/D2区序列PCR扩增引物为NL-1、NL-4[17],扩增程序为:94℃ 3 min;94℃ 40 s,48℃ 45 s,72℃ 45 s,5 个循环;94℃ 40 s,53℃ 45 s,72℃ 45 s,25 个循环;72℃ 8 min[18]。扩增结果用1.6%琼脂糖凝胶电泳检测。
1.2.5 测序及Blast比对分析 PCR扩增产物交上海生工生物技术有限公司测序,将测序结果登录NCBI进行Blast比对。
1.2.6 耐性测试 (1)耐糖性:制备初始糖浓度分别为5%、10%、15%、20%、25%、30%、35%、40%的培养基,无菌操作接种耐高温酵母,45℃培养24 h,在OD660下测其生物量。
(2)耐酸性:制备初始pH分别为2、2.5、3、3.5、4、4.5、5的种子培养基,无菌操作接种耐高温酵母,45℃培养24 h,在OD660下测其生物量。
(3)耐乙醇性:制备初始乙醇体积分数分别为6%、8%、10%、12%、14%、16%、18%、20%的种子培养基,无菌操作接种耐高温酵母,45℃培养24 h,在OD660下测其生物量。
1.2.7 产乙醇能力测试 乙醇发酵参照文献[15]介绍的方法并略作改动:将YEPD斜面上活化的酵母菌株接种于2 mL YEPD液体培养基中,分别在30℃和45℃、120 r/min条件下培养16 h,转接到10 mL YEPD液体培养基中在30℃和45℃、120 r/min条件下培养18 h,再转接到100 mL EFM培养基中在30℃和45℃、120 r/min条件下培养6 h,然后进行厌氧发酵,72 h后取样,用气相色谱法测定发酵液的乙醇含量。
2 结果与分析
2.1 耐高温酵母菌分离筛选
从供试土样中共分离得到12株酵母菌,经48 h耐高温培养筛选,得到2株能耐45℃以上高温的酵母菌,分别编号为Y1、Y2,在45℃时能正常生长,且Y1的长势比Y2稍好。但在46、47℃温度条件下两菌株长势弱、菌落小。
2.2 耐高温酵母菌的形态及生理特征
菌株Y1、Y2在PDA平板上菌落大而突起,湿润,圆形或椭圆形,表面光滑,无皱褶,边缘整齐,乳白色;菌体细胞呈圆形或卵圆形,单边芽殖或多边芽殖。在产孢培养基上培养7~15 d,结果在麦氏培养基上两菌株均未见子囊孢子形成,而在胡萝卜块培养基上却能形成子囊孢子;经倒置培养观察,两菌株均不见产生掷孢子;在PDA平板上划线盖玻片压片培养,显微镜观察,Y1、Y2均能形成藕节状假菌丝。
2.3 耐高温酵母菌生化特征
糖发酵及碳源同化试验表明,在9种供试糖或碳源中,除甘露糖外,在其余8种碳源上的Y1、Y2均表现一致(表1);氮源利用试验表明,在5种供试氮源中,Y1、Y2均可生长,只是在以KNO3为氮源时生长弱(表2);硝酸盐还原试验测试,Y1、Y2均为阴性;产类淀粉化合物测定,菌落周围均未呈现出蓝色,结果为阴性;产酸试验,菌落周围的碳酸钙未溶解,说明无酸产生。
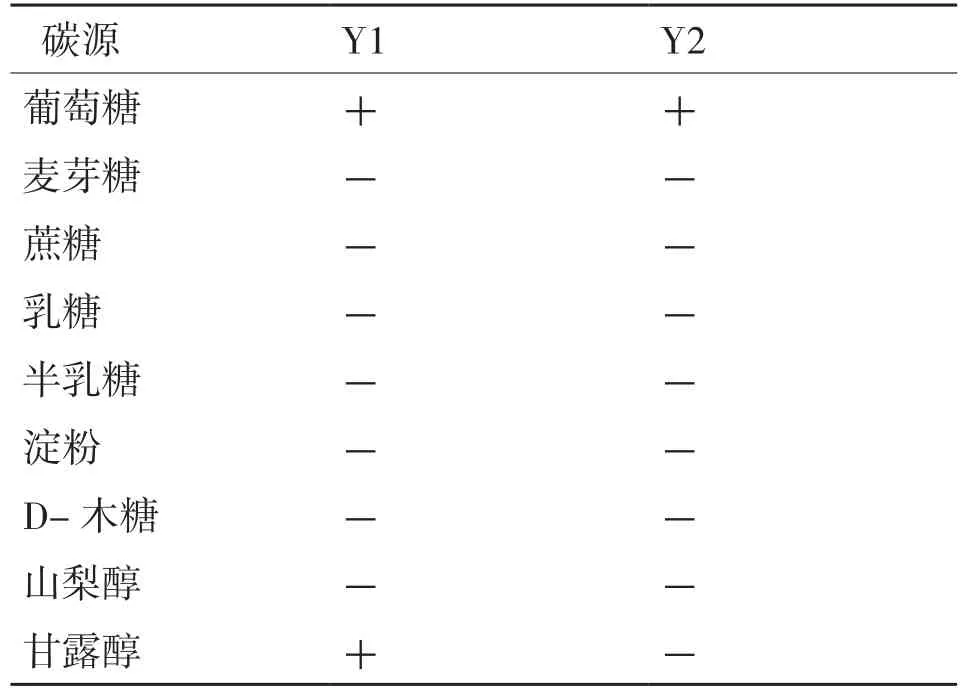
表1 糖发酵及碳源同化结果
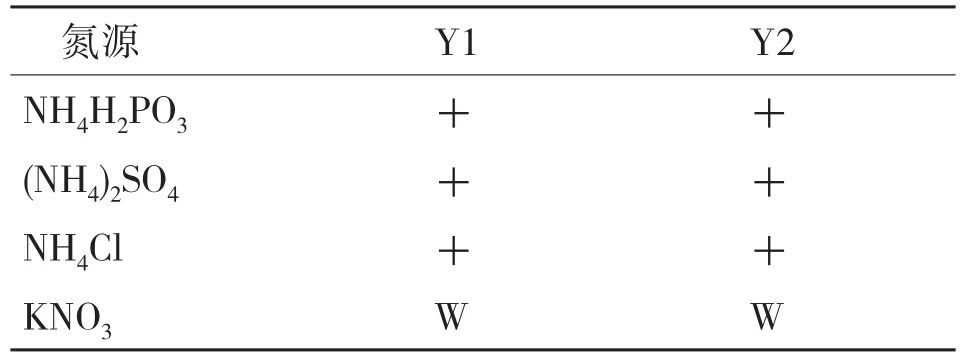
表2 氮源同化结果
2.4 26S rDNA D1/D2区PCR扩增及测序比对分析
用26S rDNA D1/D2区PCR扩增引物NL-1和NL-4[17],扩增到约600 bp大小的DNA条带(图 1),与付俊淑等[18]、马凯等[19]、张晓娟等[20]、赵丽丽等[21]的报道基本一致。据刘宁等[22]报道,26S rDNA 的 D1/D2 区域位于大亚基的 5′端,序列长度在600 bp左右,说明本试验已成功扩增到了目的条带。
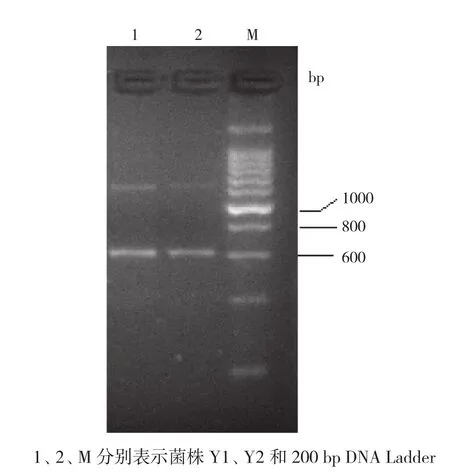
图1 酵母菌26S rDNA D1/D2 区PCR 扩增结果
将PCR扩增产物交上海生工生物技术有限公司测序,Y1和Y2均获得预期结果,登录NCBI输入测序结果进行Blast比对,结果见表3。

表3 26S rDNA D1/D2区PCR扩增产物BLAST比对结果
利用Y1、Y2及其最高相似性菌株序列,并以Saccharomyces cerevisiae strain NL18(与Y1和Y2的相似性均为77%)作为参比菌株,用MEGA4.0中的邻接法(重复值1 000)构建出系统发育树(图2),结果显示,Y1、Y2及其最相似性菌株聚为一支,而Saccharomyces cerevisiae strain NL18 单独一支。Kurtzman 等[17]对子囊菌纲近500种酵母菌的26S rDNAD1/D2区序列进行了测定,认为种内序列变异≤1%,而种间序列差异>1%。据此,Y1和Y2可分别归类为东方伊萨酵母和库德毕赤酵母。

图2 根据酵母菌26S rDNA D1/D2区序列构建的系统发育树
2.5 高温酵母耐性测试
2.5.1 耐糖性 在初始糖浓度范围内,其糖浓度越高,OD660值就越大,但当糖浓度达到并高于25%时出现抑制(表4),表明其耐糖性为25%,较刘畅等[23]报道的耐糖性(10%)高。
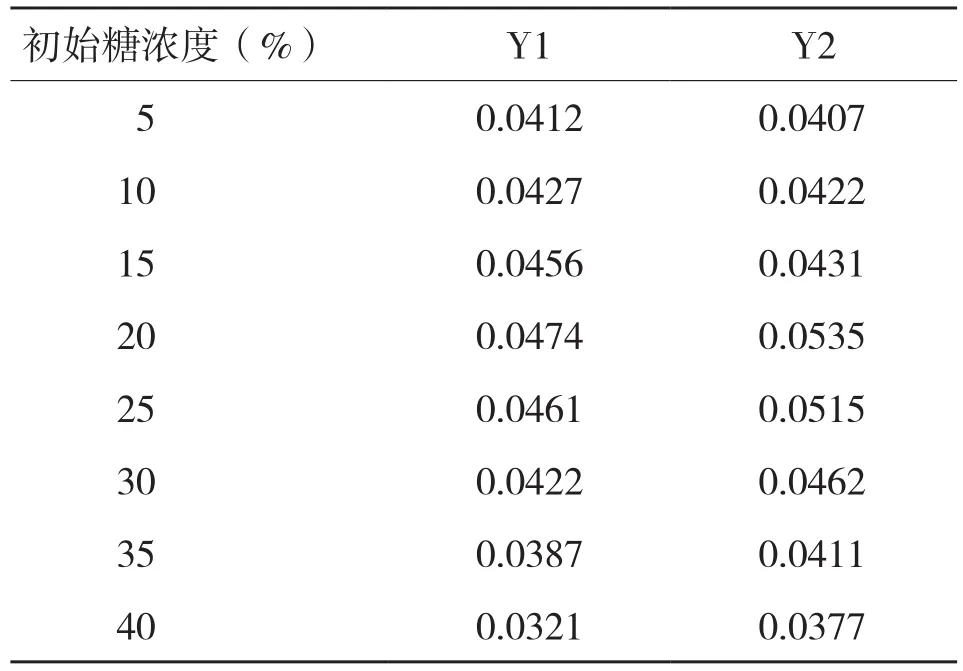
表4 初始糖浓度对酵母菌Y1、Y2生长(OD660值)的影响
2.5.2 耐酸性 耐酸性测试结果(表5)显示,Y1和Y2菌株的最适pH=4,较刘畅等[23]的报道(pH 5.5)低。
2.5.3 耐乙醇性 在测试浓度下,Y1和Y2都随初始乙醇浓度的升高,其OD值逐渐降低,Y1在8%及以上浓度时出现抑制作用,Y2在10%及以上出现抑制作用(表6),低于Atiya Techaparin等[2]报道的5株酵母菌(酿酒酵母KKU-VN8、KKU-VN20、KKU-VN27和库德毕赤酵母KKU-TH33、KKU-TH43)13%的乙醇耐受水平。
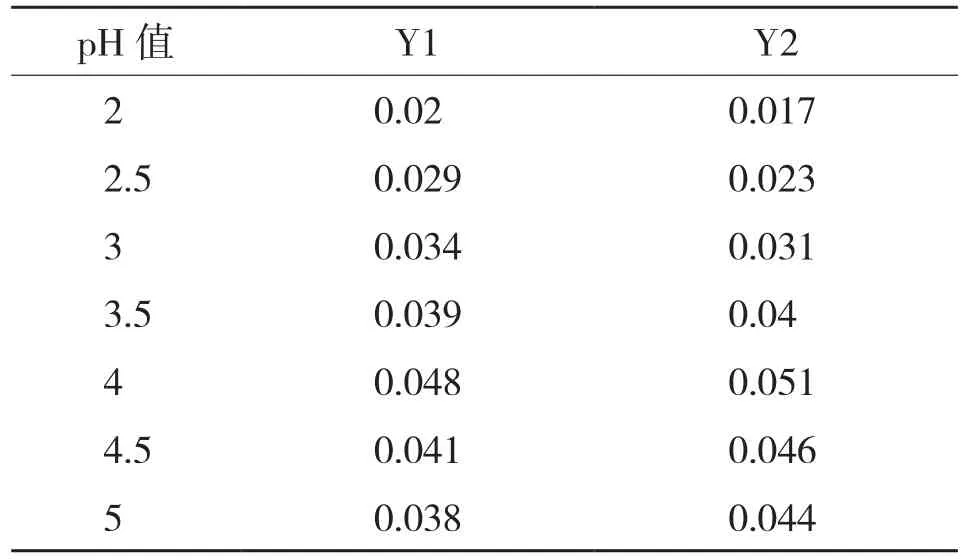
表5 初始pH对酵母菌Y1、Y2生长(OD660值)的影响
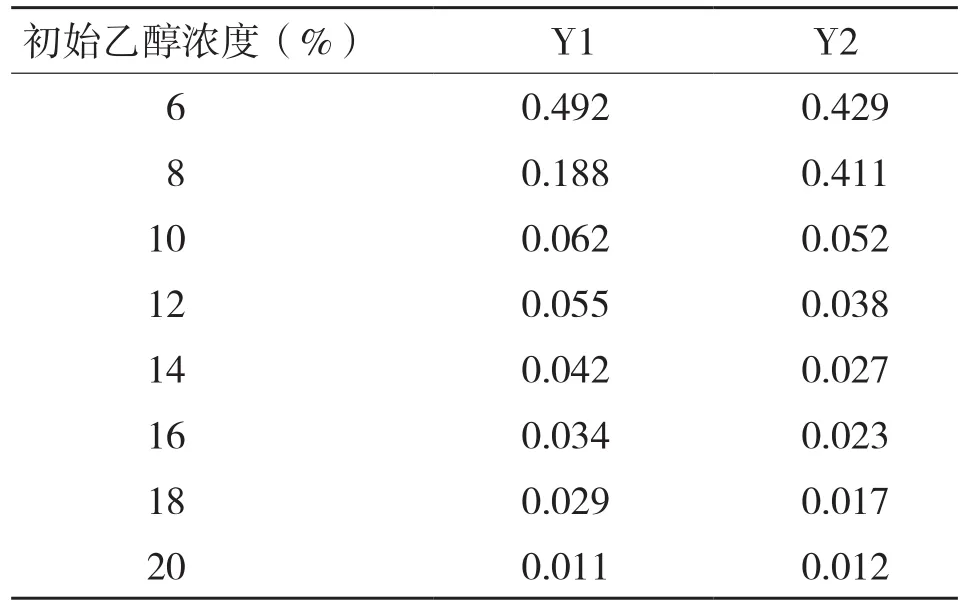
表6 初始乙醇浓度对酵母菌Y1、Y2生长(OD660值)的影响
2.5.4 产乙醇性能 酵母菌Y1、Y2在不同温度条件下发酵72 h后的乙醇产量(V/V)存在差异,在30℃下乙醇产量分别为3.8%、8.7%,45℃下分别为5.1%、9.8%,均高于30℃;Y2在两种温度条件下的乙醇产量均高于Y1,亦均高于刘超帝等[5]报道的耐高温能力和乙醇发酵能力最强的马克斯克鲁维酵母(40℃、72 h,6.56%)。
3 结论与讨论
本试验经分离、筛选得到2株耐高温酵母菌Y1和Y2,经形态学、生理生化、分子鉴定及系统发育分析,初步鉴定Y1为东方伊萨酵母(Issatchenkia orientalis),Y2为库德毕赤酵母(Pichia kudriavzevii)。Y1和Y2在45℃时均能正常生长,在46、47℃时能微弱生长,但其长势明显变弱,菌落形态也有明显变化。就高温下的长势而言,Y1稍优于Y2,说明Y1比Y2对高温的耐受性能略强。耐性测试结果表明,初始糖浓度对两株酵母菌的影响相差不大,在25%时出现抑制现象;初始乙醇浓度达8%时Y1出现抑制,初始乙醇浓度达10 % 时Y2出现抑制,说明Y2比Y1对乙醇的耐受性要好;Y1、Y2的最适pH均为4;Y1、Y2在45℃下的乙醇产量高于30℃,且Y2在两种温度条件下的乙醇产量均高于Y1。说明Y1、Y2可能具有潜在的利用价值,尤其是Y2有较好的乙醇发酵性能,通过诱变或原生质体融合等技术提高其耐乙醇能力,可望获得用于同步糖化乙醇发酵的优良菌株。
耐高温酵母一般从酒醅、腐烂的水果、热带温泉土等环境样品中筛选[23-25]。从酒糟堆放地土样中筛选耐高温酵母尚未见报道。常年堆放酒糟的土壤由于温度较高,酒糟中的一些微生物如酵母菌等可进入土壤中。本试验结果表明,从酒糟堆放地土壤分离的酵母菌中筛选耐高温酵母是可行的。
传统权威的酵母菌鉴定方法是依据形态学及生理生化特征,可将待检菌株分类到属和种[26]。随着分子生物学的发展和一系列核酸数据库的建立,通过核糖体RNA基因序列比对鉴定微生物菌种越来越盛行。鉴定酵母菌常用核糖体大亚基26S rRNA的D1/D2基因序列,该序列位于5′端。研究表明,26S rRNA的Dl/D2区域具有较高的变异率,同种不同菌株的碱基差异一般不超过1%[27],而属于不同种的菌株其核苷酸序列差异一般较大,根据这一标准,可以将绝大部分酵母鉴定到种。因此很多酵母菌的鉴定多用此分析方法[28-29]。该方法以通用引物扩增26S rRNA D1/D2区基因并测序,然后利用核酸序列数据库进行Blast比对分析就可以对酵母菌进行鉴定,其分辨率高于18S rRNA基因序列。该区域基因序列对未知菌种的快速鉴定和系统发育树的构建具有很大优势。我们根据26S rDNA D1/D2 区序列比对和系统发育分析,并结合其形态学和生理生化特征,鉴定菌株Y1为东方伊萨酵母(Issatchenkia orientalis),Y2鉴定为库德毕赤酵母(Pichia kudriavzevii)。
耐性试验表明,当初始糖浓度达25%时分离菌株出现生长抑制,因此在进行乙醇发酵性能测试时我们选择含糖20%的发酵培养基;菌株生长的最适pH值为4,比徐大鹏等[14]、刘畅等[23]报道的低;当初始乙醇浓度达8%时Y1出现抑制,10%时Y2出现抑制,均比刘畅等[23]报道的低,但均比徐大鹏等[14]报道的高。酵母菌发酵过程产生的乙醇,当达到一定浓度时,抑制其生长发育并影响乙醇产率[30],因此对乙醇的耐受能力也是筛选乙醇高产菌株的前提条件之一。乙醇发酵试验表明两菌株在45℃条件下的乙醇产量都比30℃高,说明高温有利于乙醇发酵,尤其是Y2的乙醇发酵性能更胜一筹。这是耐高温酵母可用于同步糖化发酵的潜在优势。
据孙剑秋等[31]报道,东方伊萨酵母、库德毕赤酵母和酿酒酵母可能在白酒酿造过程中发挥更重要的作用。刘婷婷[32]通过研究发现,东方伊萨酵母是兼香型白酒白云边酒发酵堆积料和出池酒醅中的优势菌,而库德毕赤酵母是香型独特的衡水老白干大曲中特有的重要功能菌之一。本试验从茅台酒酒糟堆放地土壤中分离到东方伊萨酵母和库德毕赤酵母,说明东方伊萨酵母和库德毕赤酵母在多种香型白酒酿造和风味成型过程中可能都起一定作用。
[1]苏会波,林海龙,李凡,等. 乙醇汽油对减少机动车污染排放的机理研究与分析[J]. 环境工程学报,2015,9(2):823-828.
[2]Atiya T,Pornthap T,Preekamol K. Hightemperature ethanol production using thermotolerant yeast newly isolated from Greater Mekong Subregion[J]. Brazilian Journal of Microbiology,2017,48(3):461-475.
[3]施雪华,余敏,曲有鹏,等. 利用木质纤维素类生物质生产燃料酒精[J]. 酿酒,2008,35(6):64-68.
[4]Gauss W F,Suzuki S,Takagi M. Manufacture of Alcohol from Cellulosic Materials Using Plural Ferments[P]. US Pat. :3990944,1976-11-09.
[5]刘超帝,缪礼鸿,陈瑾,等. 耐高温酵母菌的筛选及其乙醇发酵特性[J]. 食品科学,2016,37(19):128-134.
[6]田沈,任普鲜,周桂雄,等. 一株酵母菌高温驯化与同步糖化发酵研究[J]. 太阳能学报,2011,32(3):373-377.
[7]王昌魁,张利莉,贺江舟,等. 耐高温耐高糖酵母的筛选与驯化[J]. 江西农业学报,2008,20(5):100-101.
[8]Satomura A,Katsuyama Y,Ueda M,et al.Acquisition of thermotolerant yeast Saccharomyces cerevisiae by breeding via stepwise adaptation[J]. Biotechnology Progress,2013,29(5):1116-1123.
[9]Gera R,Dhamija S S,Gera T,et al. Intergeneric ethanol producing hybrids of thermotolerant Kluyveromyces and non-thermotolerant Saccharomyces cerevisiae[J]. Biotechnology Letters,1997,19(2):189-194.
[10]J 萨姆布鲁克,D W 拉塞尔. 分子克隆实验指南[M]. 第3版. 黄培堂等译. 北京:科学出版社,2002:1604.
[11]北京师范大学生物系微生物教研组. 怎样观察与培养微生物[M]. 北京:北京师范大学出版社,1982:43-44.
[12]钱存柔,黄仪秀. 微生物学实验教程[M]. 北京:北京大学出版社,2008.
[13]杜连祥,路福平. 微生物学实验技术[M]. 北京:中国轻工业出版社,2006.
[14]徐大鹏,李云杰,张栩,等. 耐高温酵母菌的筛选及特性[J]. 生物加工过程,2011,9(3):17-21.
[15]刘秀颖,何秀萍,卢莹,等. 基于基因组DNA诱变的遗传重组改造乙醇工业酵母的耐热性及发酵性能[J]. 生物工程学报,2011,27(7):1049-1056.
[16]Barros M,Soden A,Anna L,et al. Differentiation and species identification of yeasts using PCR[J]. Systematic Bacteriology,1998,48(3):279-286.
[17]Kurtzman C P,Robnett C J. Identification and phylogeny of ascomycetous yeasts from analysis of nuclear large subunit(26S)ribosomal DNA partial sequences[J]. Antomie Leeuwenhoek ,1998,73(4):331-371.
[18]付俊淑,庄世文,徐丹丹,等. 酵母分离株分子鉴定及其挥发性香气成分检测分析[J]. 食品与发酵工业,2010,36(2):44-48.
[19]马凯,刘光全,李金霞,等. 基于26SrDNA D1/D2区序列分析的15株白地霉分子分类学研究[J]. 微生物学报,2007,47(2):359-362.
[20]张晓娟,王柱,周光燕,等. 西南菌种站20株酵母菌种基于26SrDNA D1/D2区序列分析研究[J]. 四川食品与发酵,2008,44(3):1-4.
[21]赵丽丽,陈存社,郭凤莲. 26SrDNA序列分析法鉴定酵母菌[J]. 中国酿造,2008(8):49-51.[22]刘宁,刘延琳. 核糖体 RNA 基因在酵母分类鉴定中的应用[J]. 中国农业科学,2010,43(22):4701-4708.
[23]刘畅,王涛,石翠芳. 耐高温酵母菌的筛选及特性研究[J]. 酿酒,2007,34(2):52-54.
[24]毕金丽,刘娅,张殿朋,等. 耐高温酵母的筛选鉴定及发酵性能的初步研究[J]. 中国酿造,2013,32(5):107-110.
[25]陈叶福,王正祥,王晨霞,等. 耐高温酵母菌株的分离、鉴定及其酒精发酵初步研究[J]. 微生物学通报,2003,30(5):24-27.
[26]杭姣,陈亚利,陈可泉,等. 酵母核酸常用的鉴定方法及其应用[J]. 食品科技,2014,39(12):2-7.
[27]Peterson S W,Kurtzman C P. Ribosomal RNA sequence divergence among sibling species of yeasts[J]. Syst Appl Microbiol,1991(14):124-129.
[28]Sun Y,Guo J J,Liu F B,et al. Identification of indigenous yeast flora isolated from the five winegrape varieties harvested in Xiangning,China[J]. Antonie van Leeuwenhoek,2014,105:533-540.
[29]Kurtzman C P,Robnett C J. Identification of clinically Important ascomycetous yeasts based on nucleotide divergence in the 5’end of the large subunit(26S)ribosomal DNA gene[J].Journal of Clinical Microbiology,1997,35(5):1216-1223.
[30]Pina C,Couto J A,Hogg T. Inferring ethanol tolerance of Saccharomyces and non-Saccharomyces yeasts by progressive inactivation[J]. Biotechnol Lett,2004,26(19):1521-1527.
[31]孙剑秋,刘雯雯,臧威,等. 基于 26S rDNA D1/D2序列分析酱香型白酒酒醅中酵母菌的群落结构[J]. 微生物学报,2012,52(10):1290-1296.
[32]刘婷婷. 白云边酒酿造微生物分析及东方伊萨酵母发酵特性研究[D]. 武汉:武汉工业学院,2011.
