大田苦瓜的离体快繁研究
2017-03-30戴修纯郑岩松张木清李光光陈胜文刘绍钦
吴 蓓,戴修纯,郑岩松,张木清,李光光,陈胜文,刘绍钦
(广州市农业科学研究院,广东 广州 510335)
苦瓜(Momordica charantia Linn.)为葫芦科苦瓜属1年生或2年生攀援草本植物[1]。其诸多保健功能得到人们的高度重视,现代医学也证明,苦瓜具有降低血糖、抗肿瘤以及提高人体免疫力等作用[2]。喜食苦瓜的人群越来越多,苦瓜栽培面积和范围越来越大,现在苦瓜在很多地区已成为主要蔬菜种类之一,特别是在华南地区,苦瓜已成为最重要的瓜类作物之一。随着苦瓜食用、药用价值的开发,对其优良品种的需求越来越大。目前,人们普遍认识到杂种优势利用是提高作物产量、品质、抗逆、抗病等性状最有效的方法[3-4],但育成苦瓜杂交种需要经历亲本多代自交纯化[5],费时费工,而为了提高苦瓜的育种效率,可以将具有不同性状优点的育种材料的F1代种子直接进行杂交,得到具有不同基因型的F2代种子,在大田中观察F2代种子长出来的植株表现,选取综合性状优良的植株进行组培育苗,以保持其母体植株的生物学特性和遗传性状,生产出性状高度一致的种苗。鉴于此,本研究选取不同取材时间(包括大田已结成熟瓜的顶芽和侧芽作为外植体)、不同激素类型及配比组合对苦瓜诱导不定芽形成、芽增殖以及不定根形成的影响,建立了大田苦瓜的离体再生体系。这将是蔬菜品种创新中有意义的一项技术革新,可为其他蔬菜育种工作提供有益借鉴。
1 材料与方法
1.1 试验材料
以2016年3月在广州市农业科学研究院南沙展示基地种植的苦瓜F1代商品种碧丰3号和选育的大顶杂交品种单株(编号SDZ-36)的顶芽和侧芽为试验材料。
1.2 试验方法
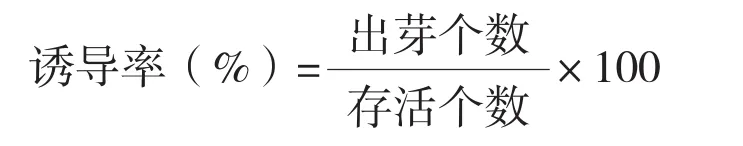
1.2.1 消毒时间对接种污染率的影响 分别选取碧丰3号和SDZ-36的株龄15 d、30 d和已结成熟商品瓜的苦瓜枝条,去除表面污垢后切成带芽的节段,在流水下冲洗10 min,然后在超净工作台上进行表面灭菌。先用75%乙醇浸泡30 s、无菌水冲洗3~4遍,然后用0.1%升汞进行消毒处理(消毒时间设 3、5、7、9、11 min),再用无菌水冲洗5~6次,最后接种在MS基本培养基上,置于温度26(±2)℃、空气相对湿度为60%左右、光照强度1 500~2 000 lx、光照时间16 h/d的条件下培养。MS基本培养基均含3%蔗糖、0.7%琼脂,pH为5.7~5.8,121℃高压灭菌20 min。每个品种各取30个节段,即每个处理共60个节段,每瓶接种1个节段,3次重复。接种后10~15 d统计污染率,比较不同消毒时间对消毒效果的影响,计算公式为:

1.2.2 诱导培养基对不定芽诱导的影响 将上述消毒好的不同生长阶段的苦瓜枝条节段外植体接入以下4种不定芽诱导培养基中培养:MS+6-BA 0.7 mg/L+NAA 0.7 mg/L、MS+6-BA 0.5 mg/L+NAA 0.5 mg/L、MS+6-BA 0.3 mg/L+NAA 0.3 mg/L、MS+6-BA 0.1 mg/L+NAA 0.1 mg/L。每个品种各取30个节段,即每个处理共60个节段,每瓶接种1个节段,3次重复,培养条件同
1.2.1 。接种28 d后统计不定芽诱导率,比较不同培养基的诱导效果,计算公式为:
1.2.3 增殖培养基对不定芽增殖的影响 将诱导28 d后分化出的苦瓜不定芽转入以下10种增殖培养基中:MS+6-BA 0.7 mg/L+NAA 0.7 mg/L、MS+6-BA 0.7 mg/L+IAA 0.7 mg/L、MS+6-BA 0.7 mg/L、MS+6-BA 0.5 mg/L+NAA 0.5 mg/L、MS+6-BA 0.5 mg/L+IAA 0.5 mg/L、MS+6-BA 0.5 mg/L、MS+6-BA 0.3 mg/L+NAA 0.3 mg/L、MS+6-BA 0.3 mg/L+IAA 0.3 mg/L、MS+6-BA 0.3 mg/L、MS+6-BA 0.1 mg/L。每个处理10瓶,每瓶接种4株,3次重复,培养条件同1.2.1,28 d后调查不定芽的增殖情况。
1.2.4 生根培养基对生根效果的影响 切取伸长的不定芽转入生根培养基中,可促进不定芽生根长成完整的植株。生根培养基设以下6个处理:MS+IBA 0.5 mg/L、MS+IBA 0.3 mg/L、MS+IBA 0.1 mg/L、1/2MS+IBA 0.5 mg/L、1/2MS+IBA 0.3 mg/L、1/2MS+IBA 0.1 mg/L。每个处理10瓶,每瓶接种4株,3次重复,培养条件同1.2.1,8 d后观察不同培养基下苦瓜不定芽的生根天数、根长及根的质量对组培苗移栽成活率的影响。
1.2.5 组培苗的田间培育 苦瓜组培苗的不定芽在生根培养基的瓶中培养若干天后,至一定的根长及数量时,移至有自然光照、温度为28(±2)℃的炼苗棚炼苗3~5 d,再移栽至有营养土的杯中育苗,至苗高15 cm以上后移至大田栽培。初步观察比较组培苗和实生苗的长势情况以及果实外观性状(如瓜形、瓜色、瘤状)和口感是否改变。
2 结果与分析
2.1 消毒时间对苦瓜外植体接种污染率和不定芽诱导率的影响
消毒时间对不同生长阶段(株龄15 d、株龄30 d和已结成熟商品瓜)的苦瓜外植体接种污染率和不定芽诱导率的影响见表1。由表1可知,株龄15 d的苦瓜外植体,当0.1%升汞消毒时间为5 min时,污染率很低(0.1%),而不定芽诱导率很高(94.8%);当0.1%升汞消毒时间大于7 min时,外植体容易死亡,因此升汞消毒时间以5 min最佳。株龄30 d和已结成熟商品瓜的外植体,当1%升汞消毒时间为7 min时,污染率均低于1%,不定芽诱导率均高于90%;1%升汞消毒时间在9 min以上时,外植体容易死亡,因此升汞消毒时间以7 min为佳。

表1 消毒时间对苦瓜外植体接种污染率和不定芽诱导率的影响
2.2 诱导培养基对苦瓜不定芽诱导的影响
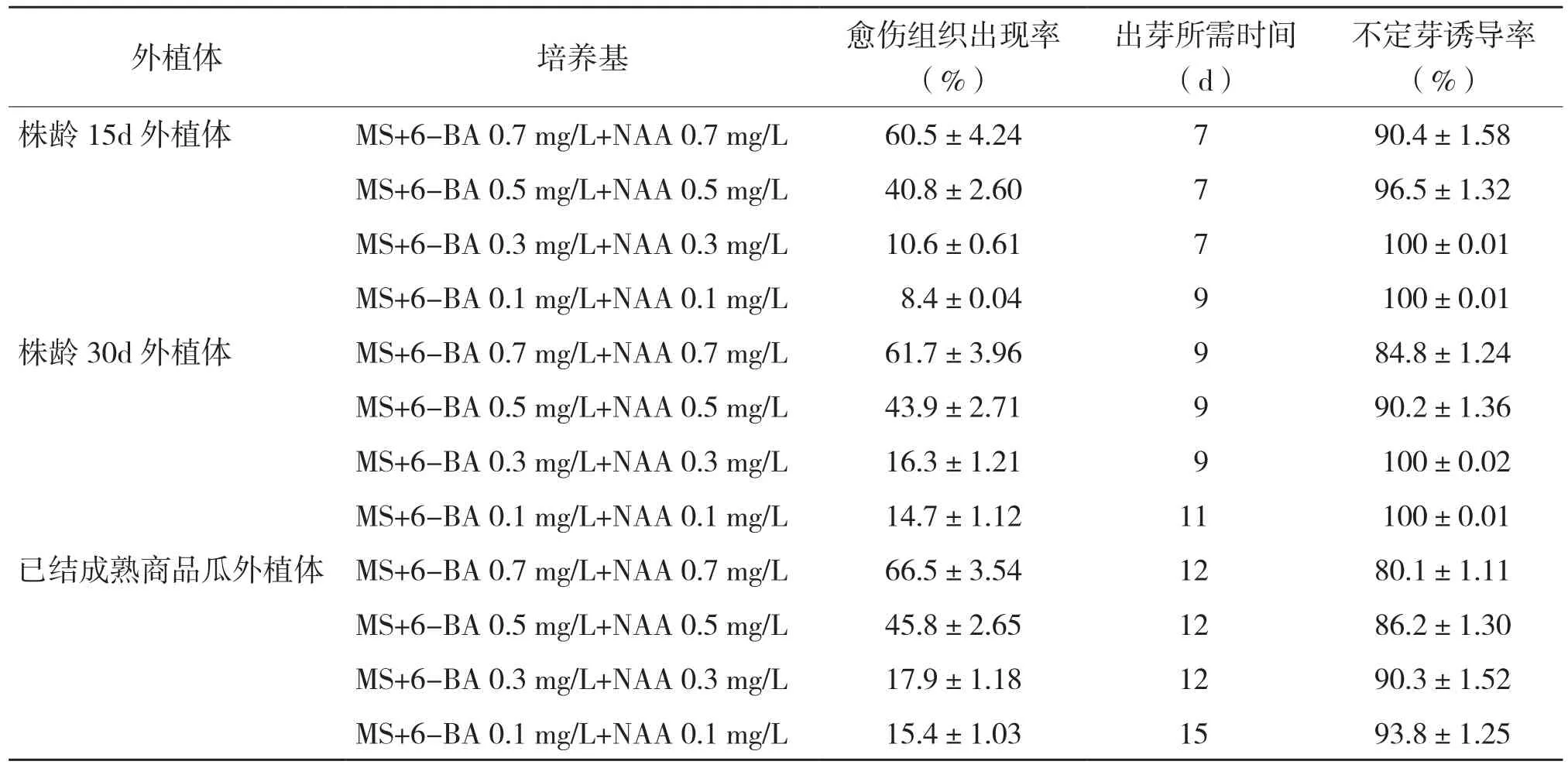
表2 诱导培养基对苦瓜不定芽诱导的影响
从表2可以看出,不同株龄的苦瓜外植体均能很好地在4种激素组合的培养基中诱导出不定芽,不定芽诱导率均在80%以上。但外植体株龄越长,其诱导出芽所需时间越长,出芽时间均在7~15 d之间。据观察,当激素浓度较
高时,愈伤组织出现率会增加,由于愈伤组织会增加组培苗的变异率,因此MS+6-BA 0.7 mg/L+NAA 0.7 mg/L和MS+6-BA 0.5 mg/L+NAA 0.5 mg/L不予采用,MS+6-BA 0.1 mg/L+NAA 0.1 mg/L中激素浓度太低,虽然能降低愈伤组织出现率,但也使不定芽诱导所需时间延长,因此选取MS+6-BA 0.1 mg/L+NAA 0.1 mg/L诱导各生长阶段的外植体不定芽最为合适(图1,彩插二)。

图1 MS+6-BA 0.3 mg/L+NAA 0.3 mg/L诱导培养15 d的不定芽
2.3 增殖培养基对苦瓜不定芽增殖的影响
影响苦瓜组培苗扩大生产的关键问题之一是诱导的不定芽增殖时容易出现愈伤组织,而由愈伤组织诱导出的不定芽的变异率很高,为保持选育出的苦瓜品种的优良性状,我们将尽量避免愈伤组织的出现。将诱导出的不定芽转入附加适宜浓度激素的培养基中,可以促进不定芽的增殖。由于外植体的取材时间会影响前期不定芽的诱导时间和诱导率,因此,在扩大生产苦瓜组培苗时,通常只取株龄15 d的外植体节段作为试材。而在需要进行品种选育时,必须从已结瓜的苦瓜植株上取外植体进行培育。从表3可以看出,MS+6-BA 0.1 mg/L培养基中不定芽增殖系数较大,且愈伤组织出现率最小,是苦瓜不定芽增殖最适培养基(图2,彩插二)。
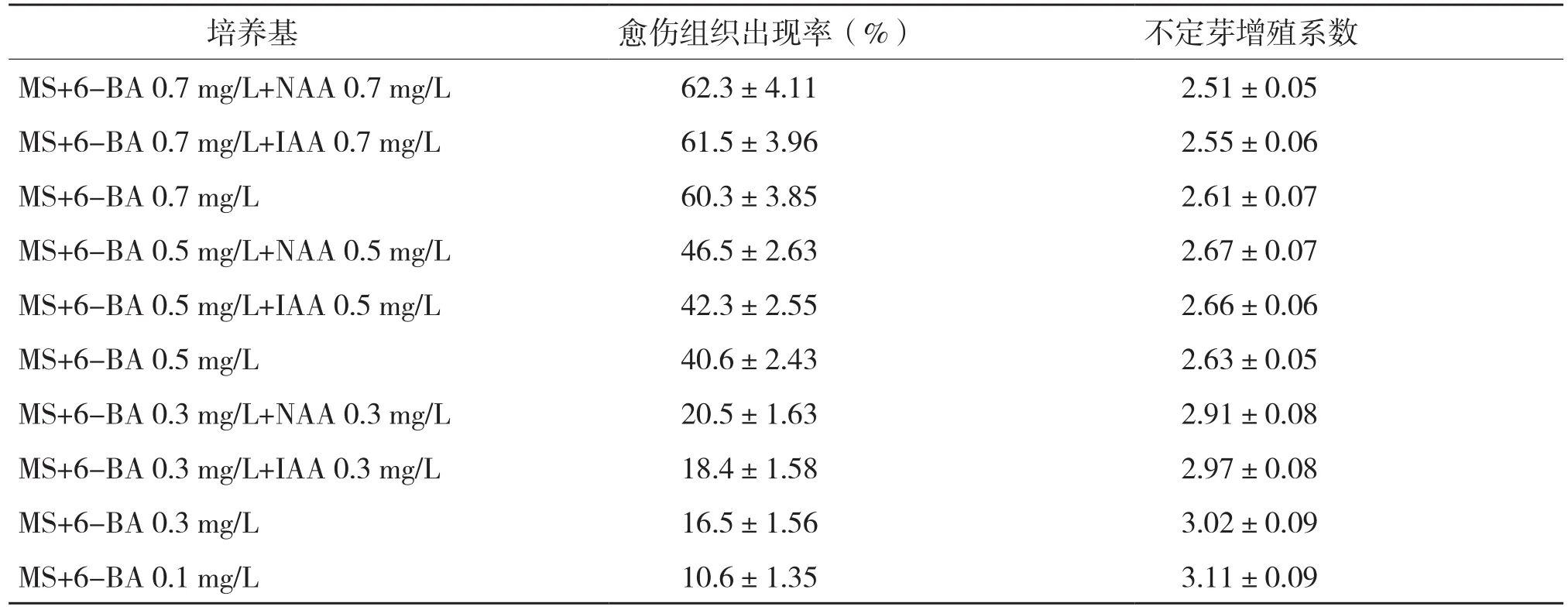
表3 增殖培养基对苦瓜不定芽增殖的影响

图2 MS+6-BA 0.1 mg/L增殖培养21 d不定芽增殖情况
2.4 生根培养基对苦瓜不定芽生根效果的影响
在诱导苦瓜组培苗不定芽生根时,需选择合适的培养基和激素配比,否则容易出现泡沫根,降低组培苗成活率。表4显示,随着激素浓度的降低,诱导出的不定根出现泡沫根越少,而当MS培养基换成1/2MS时,泡沫根出现比例提高,其中MS+IBA 0.1 mg/L较适合诱导苦瓜不定根。经过观察发现,在MS+IBA 0.1 mg/L培养基中诱导8 d后都开始产生不定根,培养15 d后不定根长度达到4~5 cm,此时组培苗的成活率最高,培养22 d后出现泡沫根的比例在50%以上,组培苗成活率极低(表5)。因此,选用MS+IBA 0.1 mg/L为不定根培养基,培养15 d后移至营养杯中为最适种植条件(图3,彩插二)。
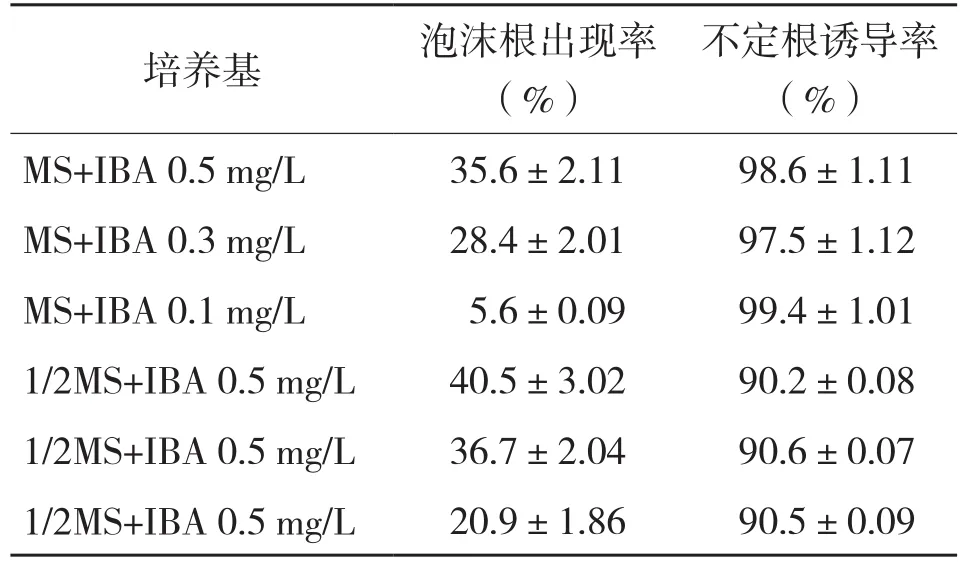
表4 不定根诱导15 d后生根培养基对苦瓜生根效果的影响
2.5 苦瓜组培苗的田间培育
苦瓜组培苗的不定芽在生根培养基中培养15 d后,当根数5~6条、根长4~5 cm时,将其移至有自然光照、温度28(±2)℃的大棚中炼苗3~5 d,再移至有营养土的杯中育苗,至苗高15 cm以上后可移至大田栽培。初步发现,在同样的栽培条件下,苦瓜组培苗在长势方面不如种子苗(图4~图7,彩插二),但是其果实外观性状(如瓜形、瓜色、瘤状情况和口感等)与种子苗无异(图8~图9,彩插二),且具有提早成熟、整齐度高等优点。

表5 不定根诱导时间对苦瓜组培苗成活率的影响

图3 MS+IBA 0.1 mg/L培养15 d的生根苗

图4 碧丰3号苦瓜组培苗

图5 碧丰3号苦瓜种子苗

图6 大顶苦瓜组培苗(SDZ-36)

图7 大顶苦瓜种子苗

图8 碧丰3号苦瓜组培苗(左)和种子苗(右)所结果实

图9 大顶苦瓜所结果实
3 结论与讨论
植物组织培养的初代培养外植体取自自然生长的植物,都带有各种各样的微生物,只有对这些材料进行成功消毒,才是建立起高效组培系统的第一步。而不同生长阶段的外植体,由于其老嫩不同,所带微生物程度不同,所需的消毒时间也不同,因此,找出适合不同生长阶段外植体的合适消毒时间对组培系统的建立非常重要[6]。本研究结果表明,为了大量生产苦瓜组培苗,可以取株龄15 d内的苦瓜苗顶芽或侧芽,这些外植体生长时间短,较为幼嫩,带菌较少,因此0.1%升汞消毒控制在5 min能达到很好的消毒效果。
目前苦瓜采用常规杂交育种方法得到纯化的父本母本需要5年以上的时间[7],而为了提高苦瓜的育种效率,可以把具有不同性状优点的育种材料的F1代种子直接进行杂交,其F2代就是具有不同基因型的杂合体种子群体,这个群体保持了极丰富的表现性状,我们就可以通过在大田中对其进行大量的观察筛选,从中直接选择综合性状优良的植株进行组培育苗,因此试验中必须选取已结成熟商品瓜的植株顶芽或侧芽作为外植体。而种子萌发30 d后直至结出成熟商品瓜的材料带内生菌较多,消毒难彻底,但外植体较成熟,能承受更长的消毒时间,因此0.1%升汞消毒时间控制在7 min左右为宜。
研究苦瓜不定芽的诱导时发现,愈伤组织非常容易形成,与前人结论[8-12]是一致的。但由于愈伤组织的分化能力与品种基因型等因素有关[13],且通过愈伤组织分化得到的组培苗变异率更高,不适合用于苦瓜组培苗的生产和苦瓜育种。因此,我们适当降低外源激素浓度以减少愈伤组织的产生。在不定芽诱导培养中,不定芽能否顺利被诱导与培养基中外源激素的浓度有很大关系,而不同生长阶段的外植体均能被很好地诱导,只是生长时间越长的材料诱导不定芽所需时间稍长。在不定芽的增殖阶段,继续降低外源激素的浓度至适宜程度,能很好地控制愈伤组织的形成,并不影响芽的增值系数[14]。在不定根的诱导时,较容易产生泡沫根,选取适宜的激素浓度,以及将不定根的诱导时间控制在15 d以内,及时炼苗并移入营养杯中培养,能很好地诱导不定根的形成并提高组培苗的大田成活率。
经对苦瓜组培苗的长势初步分析发现,其生长势普遍比其对应的种子苗弱,但组培苗的叶色、分枝性以及各种果实形态特征、单瓜重量和单株产量与种子苗无明显差异,这与谢启鑫等[15]的研究结果也一致,说明苦瓜组培苗在常规育苗栽培条件下产量水平不高,需要进行相关的配套技术研究来提高产量水平。
[1]黄泰康,丁志遵,赵守训,等. 现代本草纲目(上卷)[M]. 北京:中国医药科技出版社,2000.
[2]许红心,倪坚军. 苦瓜的药用研究概况[J]. 浙江中医学院学报,2001,25(4):73-75.
[3]林永胜,张玉灿,张武君,等. 苦瓜品种资源对枯萎病的抗性评价[J]. 蔬菜,2017(11):46-51.
[4]黄亚杰,运广荣,李梅,等. 苦瓜遗传育种研究进展[J]. 中国蔬菜,2012(8):11-19.
[5]陈小凤,黄如葵,黄玉辉. 等,苦瓜育种及相关基础研究进展[J]. 南方农业学报,2011,42(3):246-249.
[6]刘玉晗,王永清,秦红梅. 田间“碧秀”苦瓜茎段离体启动培养的研究[J]. 北方园艺,2008(11):148-150.
[7]朱文斌,沈文杰,龚颖婷,等. 苦瓜基本特征及其自交系的选育[J]. 长江蔬菜,2014(8):17-22.
[8]申洪业. 苦瓜下胚轴离体培养研究诱导形成愈伤组织[J]. 吉林蔬菜,1997(1):3-4.
[9]杨满业,赵茂俊,苗琛,等. 苦瓜营养器官愈伤组织发生的比较研究[J]. 四川大学学报(自然科学版),2002,39(6):1155-1156.
[10]宋莉英,谭铮,高峰. 苦瓜愈伤组织诱导的多因子正交试验研究[J]. 西南师范大学学报(自然科学版),2004,29(3):462-465.
[11]张丽,李玉锋,代娟. 苦瓜愈伤组织的诱导及培养条件优化[J]. 食品与生物技术学报,2007,26(3):116-120.
[12]郑阳霞,李焕秀,严泽生,等. 苦瓜子叶离体再生体系的建立[J]. 北方园艺,2011(15):163-165.
[13]武鹏,方锋学,黄如葵,等. 苦瓜离体再生体系建立的研究[J]. 北方园艺,2012(2):124-126.
[14]马超. 苦瓜离体再生体系的建立及根癌农杆菌介导Pti4基因的遗传转化[D]. 成都:四川农业大学,2012.
[15]谢启鑫,万新建,缪南生,等. 赣优3号苦瓜离体快繁体系的建立[J]. 江西农业学报,2012,24(5):71-72.
