曲张大隐静脉源性血管平滑肌细胞表型与功能的变化
2017-03-30李源贝媛媛于丹徐永波李坤褚海波
李源,贝媛媛,于丹,徐永波,李坤,褚海波
(1. 潍坊医学院 研究生部,山东 潍坊 261053;2. 中国人民解放军第八十九医院 普外中心,山东 潍坊 261021)
下肢静脉曲张是血管外科的常见疾病,发病率为30%,其发病机制仍不清楚[1-2]。静脉曲张的风险因素与女性、站立职业、肥胖、妊娠、老年、深静脉血栓及家庭遗传相关[3]。研究[4]表明,静脉高压和缺氧可导致静脉膨胀、重塑及结构改变,同时还可触发大分子和红细胞外溢,微血管内皮激活,白细胞渗出,细胞外基质(ECM)改变,胶原沉积。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)分为收缩型和合成型,两种表型分别具有收缩和产生细胞外基质功能。合成型VSMCs可以过度增殖和迁移进而导致血管病理性改变,形成静脉曲张[5]。因此,研究VSMCs表型与功能的变化,可从细胞和分子水平阐明静脉曲张的发病机制。本文通过建立曲张静脉和正常静脉VSMCs的培养方法,采用多种手段检测两种静脉VSMCs的表型和功能,并比较两者之间的差异性。
1 材料与方法
1.1 标本来源
选取2015年1月—2016年6月中国人民解放军第八十九医院收治的大隐静脉曲张患者13例(曲张组),其中男8例,女5例;年龄51~60(平均56)岁。同期获取冠状动脉搭桥手术患者的大隐静脉15例(正常组),其中男8例,女7例;年龄52~60(平均56)岁。所有病例获中国人民解放军第八十九医院人类研究伦理委员会批准(编号:1538)和患者的知情同意。排除标准:下肢严重水肿、静脉曲张伴皮肤改变、急性或亚急性血栓性静脉炎(血栓形成时间<14 d或<30 d)、慢性血栓性静脉炎、非血栓性静脉炎、动脉疾病及糖尿病患者。
1.2 主要试剂和设备
DMEM高糖培养基(HyClone,美国);胎牛血清(HyClone,美国);胰蛋白酶(HyClone,美国);特异性α平滑肌肌动蛋白(α-SMA)抗体(北京中杉金桥生物有限公司,中国);Cell Counting Kit试剂盒(碧云天生物科技有限公司,中国);纤维连接蛋白(Roche,德国);β-半乳糖苷酶试剂盒(上海杰美基因医药科技有限公司,中国);FITC-Phalloidin(Enzo Life Sciences,瑞士);TRIzol(北京康为世纪生物技术有限公司,中国);SYBR PrimeScript RTPCR Kit II及相关引物设计合成(大连宝生物工程有限公司,中国);MMP-2、MMP-9、TIMP-1、TIMP-2抗体(Abcam,英国);小鼠抗β-actin抗体(北京中杉金桥生物有限公司,中国);Bax、Bcl-2、caspase-3抗体(Cell Signaling Technology,美国);CO2培养箱(Thermo,美国);Boyden小室(江苏海门麒麟医用仪器厂,中国);酶标仪(Bio-Rad Laboratories, 美国);荧光显微镜(Leica,德国);荧光定量PCR仪(Bio-RadIQ5,美国)。
1.3 方法
1.3.1 VSMCs分离培养 术中获取膝下无菌大隐静脉标本3 cm,眼科镊撕去外膜及脂肪组织,眼科剪纵向剖开血管,牙科探针刮去内膜,用PBS漂洗干净。将血管中层剪成1.0 mm×1.0 mm大小组织块,用吸管将组织块按3~5块/cm2的密度平铺于25 mL玻璃培养瓶中,加入含20%胎牛血清的DMEM培养液3~4 mL。粘有植块的瓶底朝上,在37 ℃、含5%CO2的培养箱中放置4~5 h后,轻轻翻转培养瓶,使培养液缓慢浸入植块。每3 d更换1次培养液,12~14 d后,倒置显微镜下观察,植块周围有细胞爬出,待3~4周后细胞融合成片,常规消化传代。选择传代的第3~5代细胞进行后续实验检测。
1.3.2 VSMCs鉴定 原代培养的VSMCs 12~14 d,倒置显微镜下显示:细胞沿组织块边缘爬出,呈放射状向外生长形成细胞晕;细胞贴壁生长,多呈长梭形,突起相互接触。部分呈多角形或不规则形,有长短不一的胞突;3~4周后,细胞汇合成片并平行排列,细胞呈“峰谷”状生长。部分细胞呈旋涡状生长或呈多重叠生长,在瓶底形成一层厚厚的膜;平滑肌α-SMA免疫荧光染色后可见胞浆内染成红色,即呈阳性染色(图1)。

图1 正常VSMCs表型 A:VSMCs形成细胞晕(×40);B:VSMCs呈长梭形或多角形(×100);C:VSMCs呈“峰谷”状生长(×40);D:α-SMA免疫荧光染色阳性(×400)Figure 1 Normal phenotype of the VSMCs A: Halo formation of the VSMCs (×40); B: VSMCs presenting a fusiform or polygonal shape(×100); C: Peak-valley-like growth of the VSMCs (×40); C: Positive immunofluorescent staining for α-SMA (×400)
1.3.3 细胞增殖检测 采用CCK-8试剂检测细胞增殖。取对数生长期的VSMCs用胰蛋白酶消化后按2×103细胞/mL密度接种至96孔板。每孔接种细胞悬液100 μL,每组设5个复孔。待细胞融合至80%,吸弃各孔培养基,CCK-8试剂和培养基以1:10比例混合后加入孔内,培养箱内孵育60 min,酶标仪测定各孔波长450 nm处吸光度。
1.3.4 细胞迁移检测 采用改良Boyden小室法观察细胞迁移。以2×104细胞/mL密度将100 μL细胞悬液注入Boyden小室上室,培养基加满下室。置于37 ℃、含5% CO2的培养箱内孵育8 h后,取出滤膜,刮除滤膜上面的未移动细胞,用PBS洗涤3次,4%多聚甲醛固定,DAPI染色,显微镜下(×100)随机选取5个视野拍照,计数每个视野内的迁移细胞,取其平均数。
1.3.5 细胞黏附检测 将VSMCs用胰蛋白酶消化,按1×104细胞/mL密度接种至预先用人纤维连接蛋白包被的24孔板中。每孔接种细胞悬液500 μL,置于37℃,含5% CO2培养箱内孵育30 min后,PBS洗涤3次清除未贴壁细胞。显微镜下(×100)随机选取5个视野拍照,计数每个视野内的贴壁细胞, 取其平均数。
1.3.6 细胞衰老检测 采用β-半乳糖苷酶法检测细胞衰老。将VSMCs用胰蛋白酶消化后接种至24孔板,每孔接种细胞悬液500 μL。待细胞铺满板底后按照β-半乳糖苷酶检测试剂盒说明书进行洗涤、固定、染色,37 ℃无CO2培养箱中避光反应18 h。衰老特异性β-半乳糖苷酶的细胞呈现蓝绿色为阳性表达。显微镜下(×100)观察并拍照,分别计数3个不同视野,计算阳性细胞数,取其平均数。
1.3.7 细胞骨架检测 采用F-actin荧光标记染色法检测细胞骨架。VSMCs用胰蛋白酶消化后接种于玻片上,细胞长至40%左右,PBS清洗2遍,4%多聚甲醛固定10 min,PBS清洗3遍。1% BSA室温封闭30 min后加入FITC-Phalloidin(5 μg/mL),37 ℃闭光染色30 min,PBS清洗3遍,加入DAPI,37 ℃闭光染色15 min,PBS清洗3次,荧光封片剂封片,荧光显微镜下(×400)观察并拍照。
1.3.8 荧光定量PCR检测凋亡相关分子与ECM代谢相关因子mRNA表达 细胞总RNA按TRIzol试剂说明书提取,溶于DEPC 处理的去离子水中,-80℃保存备用。荧光定量RT-PCR采用SYBR Green法。相关基因引物序列如表1所示,实验中以管家基因GAPDH作为内参,以超纯水(PCR级,无RNase)作为阴性对照。结果分析按2-ΔΔCt来计算出各组扩增效率。
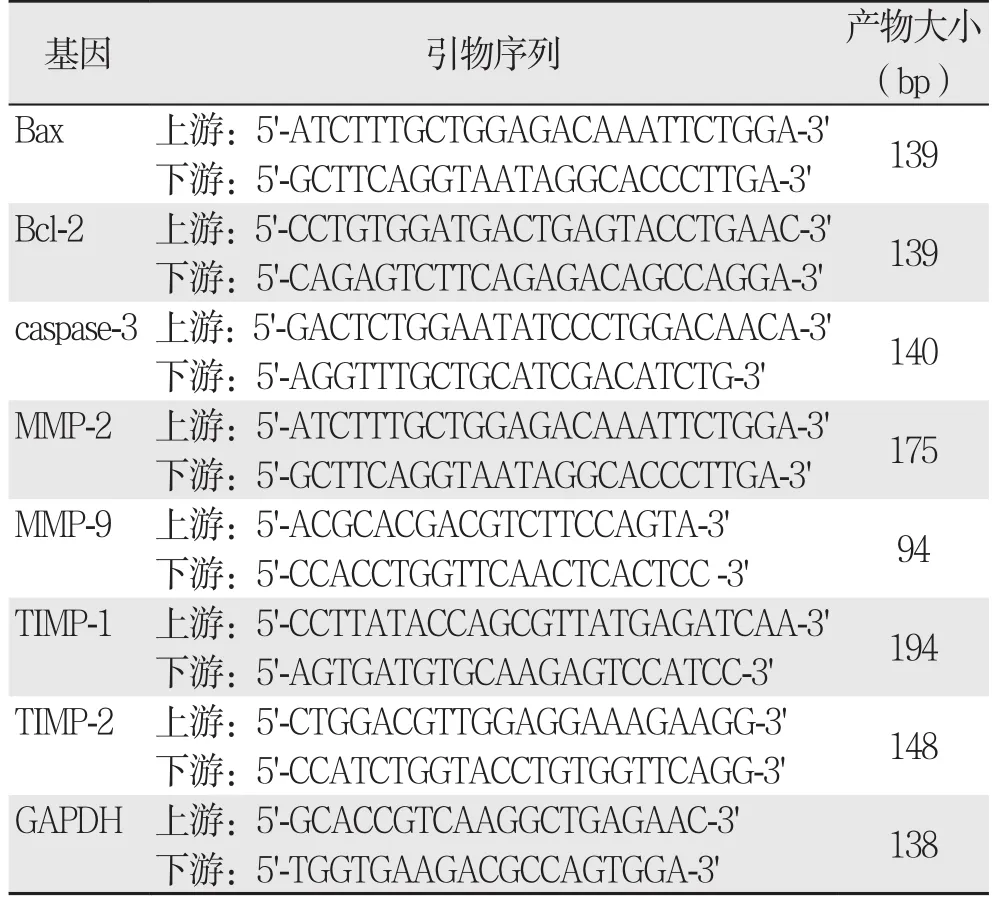
表1 相关基因的引物序列及扩增产物大小Table 1 Sequences of the primers and lengths of their products
1.3.9 Western blot检测凋亡相关分子与ECM代谢相关因子蛋白表达 细胞总蛋白按蛋白提取试剂说明书提取,4 ℃ 12 000 r/min离心5 min,取上清,加入蛋白上样缓冲液混匀,100 ℃沸水煮5 min,-20℃冰箱保存备用。制浓缩胶、分离胶,灌胶后加入蛋白样品,进行SDS-PAGE电泳约3.5 h,转膜用湿转法,200 mA恒流30~120 min。脱脂奶粉封闭1 h,一抗4 ℃冰箱孵育过夜。TBST震荡洗涤5×10 min/count,二抗室温孵育1 h。TBST震荡洗涤5×10 min/count,滴加ECL发光液于暗室内曝光显色,蛋白条带采用Image-J图像分析软件进行扫描和分析。
1.4 统计学处理
采用SPSS 18.0统计学软件进行分析,数据以均数±标准差(±s)表示,两组间计量资料比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 VSMCs增殖能力检测
CCK-8检测结果显示,曲张组VSMCs细胞增殖数量与正常组VSMCs相比明显增多,差异有统计学意义(P<0.05)(图2)。

图 2 两组VSMCs增殖能力比较Figure 2 Comparison of the proliferative abilities between the twogroups of VSMCs
2.2 VSMCs黏附能力检测
曲张组VSMCs和正常组VSMCs细胞黏附密度不同。与正常组VSMCs比较,曲张组VSMCs细胞黏附数量增多,差异有统计学意义(P<0.05)(图3)。

图 3 两组VSMCs黏附细胞分布(×100)与数量比较Figure 3 Comparison of the distribution (×100) and number of the adherent cells between the two groups of VSMCs
2.3 VSMCs迁移能力检测
两组VSMCs迁移细胞密度不同。与正常组VSMCs比较,曲张组VSMCs迁移细胞数量明显增多,差异有统计学意义(P<0.05)(图4)。
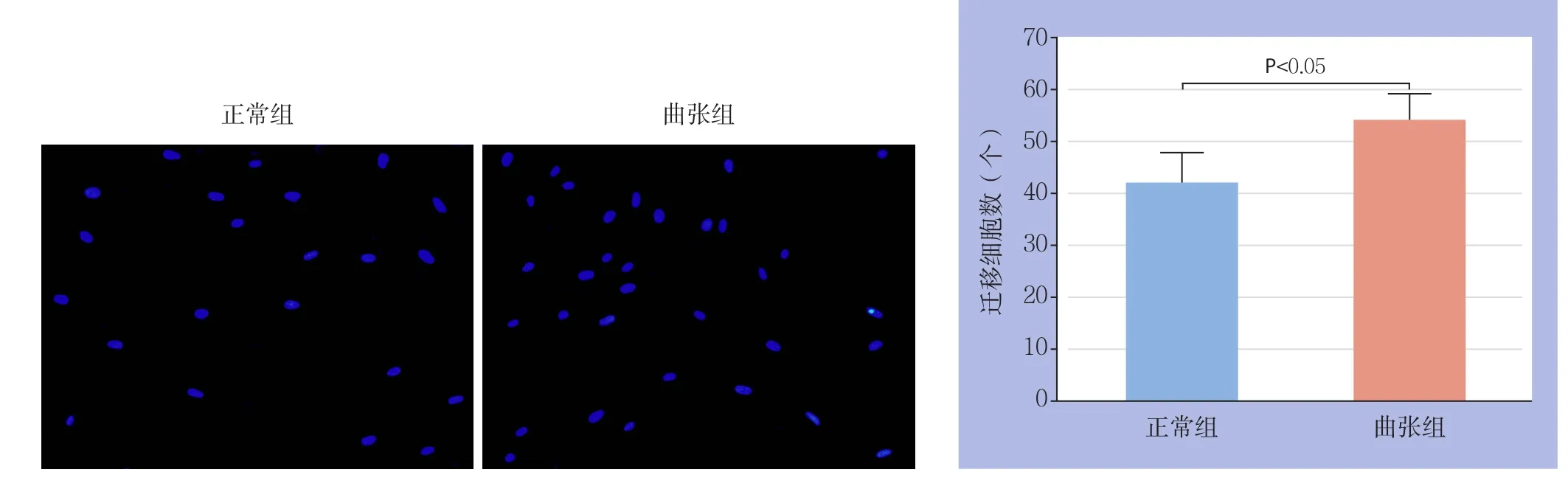
图4 两组VSMCs迁移细胞分布(×100)与数量Figure 4 Comparison of the distribution (×100) and number of the migrating cells between the two groups of VSMCs
2.4 VSMCs衰老能力检测
两组VSMCs衰老细胞密度不同。与正常组VSMCs比较,曲张组VSMCs衰老细胞数量明显增多,差异有统计学意义(P<0.05)(图5)。

图5 两组VSMCs衰老细胞分布(×100)与数量比较Figure 5 Comparison of the distribution (×100) and number of the aging cells between the two groups of VSMCs
2.5 VSMCs骨架染色
曲张组VSMCs内F-actin增多,胞浆中可见应力纤维丝,绿色荧光强度增强;正常组VSMCs的F-actin分布较为分散,细胞内隐约可见丝状结构,胞浆中未见密集的应力纤维,绿色荧光强度低(图6)。

图6 两组VSMCs细胞骨架染色(×400)Figure 6 Cytoskeleton staining of the two groups of VSMCs (×400)
2.6 细胞凋亡相关检测
2.6.1 Bax、Bcl-2、caspase-3 mRNA表达与正常组VSMCs比较,曲张组VSMCs的Bax与caspase-3 mRNA表达明显减少,而Bcl-2 mRNA表达则明显增加,差异均有统计学意义(均P<0.05)(图 7)。

图7 两组VSMCs凋亡相关因子mRNA表达Figure 7 The mRNA expressions of the apoptosis associated factors in the two groups of VSMCs
2.6.2 Bax、Bcl-2、caspase-3蛋白含量 与正常组VSMCs比较,曲张组VSMCs的Bax与caspase-3蛋白表达明显减少,而Bcl-2蛋白表达则明显增加,差异均有统计学意义(均P<0.05)(图8)。
2.7 基质金属蛋白酶及抑制物表达
2.7.1 MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA表达 与正常组VSMCs比较,曲张组VSMCs中MMP-2、MMP-9、TIMP-1、TIMP-2 mRNA表达均明显增加,差异均有统计学意义(均P<0.05)(图9)。
2.7.2 MMP-2、MMP-9、TIMP-1、TIMP-2蛋 白含量 与正常组VSMCs比较,曲张组VSMCs中MMP-2、MMP-9、TIMP-1、TIMP-2蛋白含量均明显增加,差异均有统计学意义(均P<0.05)(图10)。

图8 两组VSMCs凋亡相关因子蛋白的表达Figure 8 The protein expressions of the apoptosis associated factors in the two groups of VSMCs

图9 两组VSMCs基质金属蛋白酶及抑制物mRNA表达Figure 9 The mRNA expressions of the extracellular matrix metabolism associated factors in the two groups of VSMCs
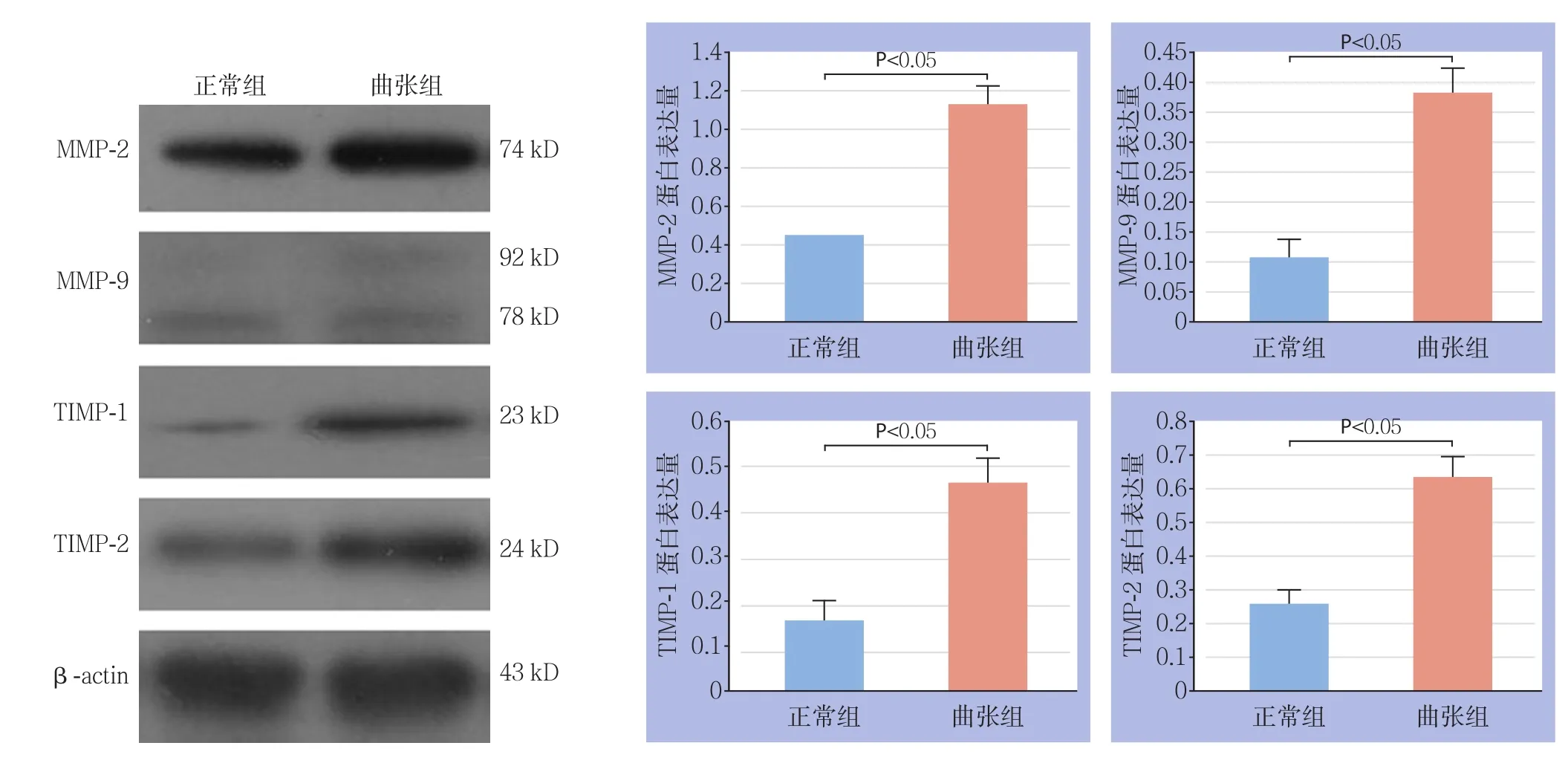
图10 两组基质金属蛋白酶及抑制物蛋白的表达Figure 10 The protein expressions of the extracellular matrix metabolism associated factors in the two groups of VSMCs
3 讨 论
静脉曲张时,VSMCs呈束状排列,因胶原纤维含量增多,部分VSMCs束出现断裂,肥大段管壁VSMCs的增殖和迁移增加[6]。透视电镜显示,VSMCs体积增大,伸长形态消失,即收缩型变为分泌型[7]。肌动蛋白的微丝是VSMCs中最主要的细胞骨架。细胞骨架与细胞表型及细胞增殖之间存在内在联系,并影响细胞重塑。细胞分化型转化为去分化型并获得增殖能力,称细胞表型转化[8]。细胞表型转化是细胞重塑的基础。钙调蛋白(calponin)可与肌动蛋白纤维结合后改变肌动蛋白纤维的结构。平滑肌22α蛋白(smooth muscle 22 alpha)可与肌动蛋白纤维束和应力纤维共定位,并参与肌动蛋白纤维聚合和解聚过程[9]。本研究显示,曲张静脉VSMCs的增殖、黏附、迁移、衰老能力明显增加,F-actin染色显示微丝结构增多。这一VSMCs表型与功能变化的结果与Xiao等[10]报道结果一致。结果表明,细胞表型转化可提高VSMCs的增殖能力,肌动蛋白细胞骨架成分F-actin的变化则反映细胞的迁移能力。文献[11-12]报道,缺氧和静脉高压可诱发VSMCs表型转化和功能异常。此外,IncRNA-GA5和Desmuslin基因表达失调也会影响VSMCs的表型[13-14]。因此,研究VSMCs表型转化和功能异常,可揭示静脉曲张发生与发展的分子和基因靶标。
曲张静脉VSMCs凋亡与静脉疾病的不同阶段VSMCs肥大和萎缩有关,因此,存在VSMCs凋亡上调或下调的分歧[15-16]。VSMCs凋亡增加可能与高流体静力压和年龄因素有关,这些因素可改变VSMCs的表型,加速VSMCs的更新代谢[16-17]。此外,TIMP-2的一种特殊表型也可促进VSMCs 凋亡[18]。SMCs凋亡抑制可能与缺氧和管壁膨胀、增厚及VSMCs表型变异因素有关。缺氧可促进抑凋亡蛋白Bcl-2的表达和VSMCs的转型及功能失调,抑制细胞的程序死亡[7,19]。本研究发现,曲张静脉VSMCs促凋亡因子Bax和caspase-3 mRNA表达和蛋白含量明显减少,而抑凋亡因子Bcl-2 mRNA表达和蛋白含量则明显增加,提示VSMCs凋亡经线粒体通路处于抑制水平。本研究结果与笔者前期的研究和相关文献[20-23]一致。笔者认为,曲张静脉VSMCs凋亡的抑制有利于VSMCs的增殖和迁移,符合笔者前期研究[24]的组织学和细胞学改变(平滑肌束增多、紊乱,向内膜迁移致内膜增厚;VSMCs细胞器成分增多,转为分泌型)。细胞凋亡可维持细胞的数量和组织动态平衡。本研究在分子和基因水平证实曲张静脉VSMCs凋亡下调,可能与细胞的更新代谢减少有关。本研究与文献报道细胞凋亡增加不一致,分析可能与获取标本的部位和静脉膨胀程度存在差异性有关。
分化或成熟的VSMCs含有独特的收缩蛋白,通过钙离子通道传递分子信号功能。曲张静脉管壁增厚时,VSMCs合成ECM失调。ECM为一种网状结构的蛋白,具有维持血管壁功能的作用。研究[25]表明,曲张静脉管壁重塑与VSMCs受损和ECM过剩有关。ECM主要成分是胶原纤维。静脉曲张时,III型胶原蛋白减少,I型胶原蛋白增多,这样可导致VSMCs分泌大量MMPs和TIMPs,以降解沉积的ECM[26]。简而言之,MMPs和TIMPs可调控和维持ECM的代谢水平[27]。本研究发现,曲张静脉VSMCs中MMPs和TIMPs mRNA表达和蛋白含量明显增多,提示MMPs和TIMPs mRNA表达和蛋白含量处在上游和上调水平,但MMPs/TIMPs比值没有失调,推测可能与TIMPs处于代偿期有关。本研究结果与Lim等[28]和Pfisterer等[29]报道一致。MMPs和TIMPs蛋白增多可间接反映变性胶原蛋白的消化,以减少ECM的沉积,延缓静脉曲张的发展[30-31]。研究[32]表明,转化生长因子β是一种SMCs的分子信号调节器,能调节VSMCs对MMPs和TIMPs的合成。笔者认为,VSMCs分泌的MMPs和TIMPs表达异常可能与不同静脉段(肥大和萎缩)有关,这可能是MMPs和TIMPs表达存在差异性的问题所在。
总之,VSMCs表型转化是血管重塑的细胞学基础。VSMCs表型转化除了与其基因表达谱改变有关外,还受细胞骨架结构与功能的影响。本文通过建立人正常VSMCs和静脉曲张VSMCs单层培养系统,从VSMCs增殖、迁移、黏附、衰老、骨架、MMPs和TIMPs分泌及细胞凋亡方面研究曲张大隐静脉来源VSMCs的生物学变化特征,初步证实曲张大隐静脉VSMCs从收缩型向合成型转化并获得增生、迁移和分泌大量细胞外基质的能力。
志谢:本课题得到潍坊医学院中心实验室成敏教授、李宏和崔晓东副教授的大力帮助,谨表感谢。
[1]Jiang H, Lun Y, Wu X, et al. Association between the hypomethylation of osteopontin and integrin β3 promoters and vascular smooth muscle cell phenotype switching in great saphenous varicose veins[J]. Int J Mol Sci, 2014, 15(10):18747–18761. doi: 10.3390/ijms151018747.
[2]Jacobs BN, Andraska EA, Obi AT, et al. Pathophysiology of varicose veins[J]. J Vasc Surg Venous Lymphat Disord, 2017,5(3):460–467. doi: 10.1016/j.jvsv.2016.12.014.
[3]Ebrahimi H, Amanpour F, Bolbol Haghighi N. Prevalence and risk factors of varicose veins among female hairdressers: a cross sectional study in north-east of Iran[J]. J Res Health Sci, 2015,15(2):119–123.
[4]Segiet OA, Brzozowa-Zasada M, Piecuch A, et al. Biomolecular mechanisms in varicose veins development[J]. Ann Vasc Surg,2015, 29(2):377–384. doi: 10.1016/j.avsg.2014.10.009.
[5]Chen S, Qin S, Wang M, et al. Expression and significance of NELIN and SM22α in varicose vein tissue[J]. Exp Ther Med, 2015,9(3):845–849.
[6]Pocock ES, Alsaigh T, Mazor R, et al. Cellular and molecular basis of venous insufficiency[J]. Vasc Cell, 2014, 6(1):24. doi: 10.1186/s13221–014–0024–5.
[7]Naoum JJ, Hunter GC, Woodside KJ, et al. Current advances in the pathogenesis of varicose veins[J]. J Surg Res, 2007, 141(2):311–316.
[8]Tian L, Chen K, Cao J, et al. Galectin-3 induces the phenotype transformation of human vascular smooth muscle cells via the canonical Wnt signaling[J]. Mol Med Rep, 2017, 15(6):3840–3846.doi: 10.3892/mmr.2017.6429.
[9]Prandi F, Piola M, Soncini M, et al. Adventitial vessel growth and progenitor cells activation in an ex vivo culture system mimicking human saphenous vein wall strain after coronary artery bypass grafting[J]. PLoS One, 2015, 10(2):e0117409. doi: 10.1371/journal.pone.0117409.
[10]Xiao Y, Huang Z, Yin H, et al. In vitro differences between smooth muscle cells derived from varicose veins and normal veins[J]. J Vasc Surg, 2009, 50(5):1149–1154. doi: 10.1016/j.jvs.2009.06.048.[11]Li J, Wang HM. Effects of cobalt chloride on phenotypes of normal human saphenous vein smooth muscle cells[J]. Int J Clin Exp Med,2014, 7(12):4933–4941.
[12]Klein B, Destephens A, Dumeny L, et al. Hemodynamic influence on smooth muscle cell kinetics and phenotype during early vein graft adaptation[J]. Ann Biomed Eng, 2017, 45(3):644–655. doi:10.1007/s10439–016–1725–0.
[13]Li L, Li X, The E, et al. Low expression of lncRNA-GAS5 is implicated in human primary varicose great saphenous veins[J].PLoS One, 2015, 10(3):e0120550. doi: 10.1371/journal.pone.0120550.
[14]Xiao Y, Huang Z, Yin H, et al. Desmuslin gene knockdown causes altered expression of phenotype markers and differentiation of saphenous vein smooth muscle cells[J]. J Vasc Surg, 2010,52(3):684–690. doi: 10.1016/j.jvs.2010.03.069.
[15]Bastos AN, Alves MM, Monte-Alto-Costa A, et al. α-smooth muscle actin, fibrillin-1, apoptosis and proliferation detection in primary varicose lower limb veins of women[J]. Int Angiol, 2011,30(3):262–271.
[16]Filis K, Kavantzas N, Dalainas I, et al. Evaluation of apoptosis in varicose vein disease complicated by superficial vein thrombosis[J].Vasa, 2014, 43(4):252–259. doi: 10.1024/0301–1526/a000360.
[17]Simovart HE, Aunapuu M, Lieberg J, et al. Age-related changes in apoptosis and expressions of intercellular adhesion molecule-1 and vascular endothelial growth factor receptor type 2 in the wall of varicose veins[J]. Int Angiol, 2010, 29(6):507–513.
[18]Aravind B, Saunders B, Navin T, et al. Inhibitory effect of TIMP influences the morphology of varicose veins[J]. Eur J Vasc Endovasc Surg, 2010, 40(6):754–765. doi: 10.1016/j.ejvs.2010.04.028.
[19]Lee JD, Lai CH, Yang WK, et al. Increased expression of hypoxiainducible factor-1α and metallothionein in varicocele and varicose veins[J]. Phlebology, 2012, 27(8):409–415. doi: 10.1258/phleb.2011.011051.
[20]Kun L, Ying L, Lei W, et al. Dysregulated apoptosis of the venous wall in chronic venous disease and portal hypertension[J]. Phlebology, 2016, 31(10):729–736. doi:10.1177/0268355515610237.
[21]Yongbo X, Wei H, Lei W, et al. Changes in levels of apoptosis in the walls of different segments of great saphenous varicose veins[J]. Phlebology, 2016, 31(9):632–639. doi:10.1177/0268355515605670.
[22]Ducasse E, Giannakakis K, Speziale F, et al. Association of primary varicose veins with dysregulated vein wall apoptosis[J]. Eur J Vasc Endovasc Surg, 2008, 35(2):224–229.
[23]Urbanek T, Skop B, Wiaderkiewicz R, et al. Smooth muscle cell apoptosis in primary varicose veins[J]. Eur J Vasc Endovasc Surg,2004, 28(6):600–611.
[24]Xu Y, Bian X, Chu H, et al. Effects of high hemodynamics upon the morphology of the walls of the great saphenous vein and splenic vein[J]. Int Angiol, 2014, 33(3):292–298.
[25]Pascual G, Mendieta C, Mecham RP, et al. Down-regulation of lysyl oxydase-like in aging and venous insufficiency[J]. Histol Histopathol, 2008, 23(2):179–186. doi: 10.14670/HH–23.179.
[26]Sansilvestri-Morel P, Rupin A, Jullien ND, et al. Decreased production of collagen Type III in cultured smooth muscle cells from varicose vein patients is due to a degradation by MMPs:possible implication of MMP-3[J]. J Vasc Res, 2005, 42(5):388–398.
[27]Kowalewski R, Sobolewski K, Wolanska M, et al. Matrix metalloproteinases in the vein wall[J]. Int Angiol, 2004, 23(2):164–169.
[28]Lim CS, Kiriakidis S, Sandison A, et al. Hypoxia-inducible factor pathway and diseases of the vascular wall[J]. J Vasc Surg, 2013,58(1):219–230. doi: 10.1016/j.jvs.2013.02.240.
[29]Pfisterer L, König G, Hecker M, et al. Pathogenesis of varicose veins - lessons from biomechanics[J]. Vasa, 2014, 43(2):88–99. doi:10.1024/0301–1526/a000335.
[30]Lyon CA, Koutsouki E, Aguilera CM, et al. Inhibition of N-cadherin retards smooth muscle cell migration and intimal thickening via induction of apoptosis[J]. J Vasc Surg, 2010, 52(5):1301–1309. doi:10.1016/j.jvs.2010.05.096.
[31]Kucukguven A, Khalil RA. Matrix metalloproteinases as potential targets in the venous dilation associated with varicose veins[J]. Curr Drug Targets, 2013, 14(3):287–324.
[32]Kowalewski R, Malkowski A, Sobolewski K, et al. Evaluation of transforming growth factor-beta signaling pathway in the wall of normal and varicose veins[J]. Pathobiology, 2010, 77(1):1–6. doi:10.1159/000272948.
