改良式羊水细胞培养及收获在产前诊断染色体检查中的应用
2017-03-29韦小妮唐宁王文丹
韦小妮 唐宁 王文丹
目前,经细胞培养行G显带染色体核型分析依旧是产前诊断染色体检查的重要手段[1-2]。该技术由于培养条件、羊水质量、个体差异,操作者技术水平等诸多因素的影响,目前仍存在操作繁琐耗时、易污染、分裂相少等问题[3-4]。此外,随着染色体芯片技术在超声异常但核型正常胎儿的检测应用逐步显现[5],因此,对现有传统细胞培养及核型分析技术进行改良优化,提高产前诊断效率,并为染色体芯片检测提供优质实验材料就显得极为必要。为此,本研究在传统的羊水细胞培养及收获方法的基础上进行不断改良优化,取得了较为满意的结果,现报告如下。
对象与方法
1.对象:收集2016年3—4月在本院接受产前诊断羊水穿刺、细胞培养及染色体核型分析的孕妇780例,孕周16~22+6周。产前诊断的指征包括产前筛查高风险、高龄孕妇、不良生育史、B超发现异常或夫妇之一为染色体平衡易位携带者等。
2.羊水标本的采集:根据知情同意的原则,孕妇排空膀胱,轻轻晃动腹部后,在B超介导下用一次性羊水穿刺针经腹穿刺抽取羊水16 ml,分装于两支14 ml无菌离心管(BD352001管)中,8 ml/支。
3.羊水细胞接种培养:将送检的羊水细胞离心6 min(1800 rpm/min),弃去上清液,每管留1.5 ml羊水及其沉淀细胞,使用无菌吸管轻轻混匀,接种,传统方法接种为将所有的悬液均接种于盛有3.5 ml羊水培养基(广州白云山拜迪生物医药有限公司)的培养瓶(BD公司的3531008培养瓶)中,丢弃羊水管,混匀,置37.0 ℃ 5.0% CO2培养箱中半开放式培养,而改良式方法较传统方法不同之处在于仅取1 ml悬液进行接种,置37.0 ℃ 5.0% CO2培养箱中半开放式培养,盛有剩余的0.5 ml羊水沉淀细胞的无菌离心管留存于冷藏冰箱中待备用。
4.细胞培养、换液:培养至第6天时,在倒置显微镜下观察细胞生长情况,有贴壁细胞生长时则进行换液,利用手腕力轻轻摇动培养瓶,弃去上清液,加入新鲜的羊水培养基3.5 ml,继续培养,若未见贴壁细胞生长,寻找未生长的原因,若为污染所致则直接丢弃,并与临床联系,未发现具体原因的则继续原瓶培养,培养至14天后仍未见细胞生长则及时与临床联系,视为培养失败。
5.羊水细胞的收获、制备
(1)传统方法:于换液后的第2天取出,观察细胞生长的情况,当细胞克隆≥3个大克隆(4倍镜下>2/3视野)或不少于6个中克隆(4倍镜下介于2/3视野和1/3视野),且较多(总共≥30个)圆形透亮的有丝分裂细胞时,加入秋水仙碱(20 μg/ml,50 μl)继续培养4 h后,即可收获。在室温条件下,将培养液转移至离心管中,生理盐水洗涤一次后,使用刮子轻轻刮取贴壁细胞使其脱落,转移至离心管中离心6 min(1800 rpm/min),弃去上清液,加 4 ml 0.075M氯化钾溶液,使用吸管吹打混匀,37 ℃水浴箱中低渗30 min,加入新鲜配制的固定液(甲醇:冰醋酸=3:1)0.5 ml,吸管吹打混匀,离心6 min(1800 rpm/min),弃去上清液,加入5 ml固定液固定,离心,重复一次,调制悬液,干片法制片,烤片,胰酶法G显带。按照人类细胞遗传学国际命名体制(ISCN 1995)标准及行业标准进行核型分析。
(2)改良方法:区别于传统方法,①倒弃上清液,无须留存上清液,无须生理盐水洗涤,无需使用刮子进行刮取,直接加入0.25% EDTA-胰酶(上海源培)溶液进行细胞消化;②消化完成后直接转移至离心管中,无须离心取沉淀,而是直接加入4 ml 0.075M氯化钾溶液终止,轻轻水平混匀,37 ℃温箱中进行低渗,低渗时间较传统方法不同,为12 min;③使用漩涡混匀器震荡混匀取代吸管吹打混匀。
6.观察指标:随机抽取留存在冷藏冰箱7~15 d后的羊水悬液110例(7天后的为15例,8天后的20例,9天后的为20例,13天后的为20例,14天后的为15例,15天后的为20例),进行细胞培养,观察其在培养后第6天的细胞克隆数。
结果
传统及改良方法的细胞培养成率均达99.9%,两种方法细胞培养失败的标本为同一患者的标本,所得核型见图1、图2。在第7、8、9天,两种方法可收获数比较,差异无统计学意义;收获到≥20个可供分析的分裂相数,两种方法差异有统计学意义;在同批次收获10个标本耗时中,改良法较传统法平均省时30 min;见表1。
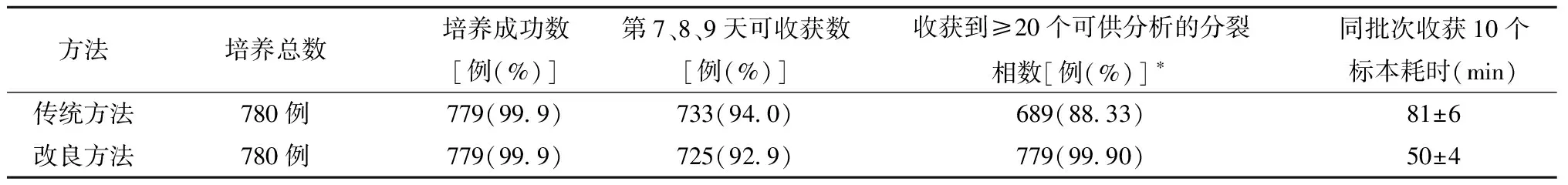
表1 两种方法情况
注:两种方法比较,*c2=90.52,P<0.05

图1 改良式法所得核型

图2 传统法所得核型
第14天未能收获的1例标本(在第18天才能收获),为同一患者的标本;采用留存的羊水悬液进行细胞培养,其在培养后第6天的细胞克隆数均不少于4个,多的甚至可达到12个。
讨论
羊水细胞培养及核型分析是产前诊断的重要技术手段,是一项综合性很强的技术。高质量的羊水细胞培养、收获是进行羊水染色体核型分析诊断的关键。传统的羊水细胞培养是将羊水离心后将所有的沉淀细胞均接种于培养瓶中,加秋水仙素培养后将贴壁细胞从培养瓶中用刮子将其慢慢刮落下来,然后用吸管转移至离心管里进行离心、低渗、预固定和固定等,细胞培养周期长,容易发生污,一旦在生长过程中发生污染,则很难进行补救。此外,整个实验过程极其繁琐,每一个大环节中包括较多的小细节,例如收获则包括加入秋水仙碱,脱落贴壁细胞,转移脱落细胞至离心管中等,一旦在一个实验环节中出现操作不佳或错误均可导致收获不成功,或不准确,无法给患者提供一个可靠的结果。为此,国内有人提出倒出一半培养液,并加入新鲜培养液的等方法来提高成功率[6],也有产前诊断实验室提出利用旧培养基4 ℃冰箱保存2~12 d后分离其内细胞传代培养等优化技术来提高细胞培养的成功率[7],该法实施的前提是在培养的过程中有细胞克隆生长,但是该法中实验室利用无菌耗材对旧培养基进行保存,增加了实验室的支出,因方法的局限性,它无法为细胞在培养过程中受到污染导致培养失败的标本提供补救措施,故一旦出现此情况只能重新取材进行实验,但是产前诊断的标本来之不易,其取材需要耗费人力、物力,尤为重要的是还存在流产等风险[8-9]。因此,应该最大程度避免对孕妇进行再重新取材检查,基于以上原因,本研究在传统方法的基础上,对接种和收获过程进行改良。
改良法相对于传统方法的优点如下。(1)留存有原始标本。改良式方法在保障细胞培养成功率(成功率为99.9%)、不延迟收获周期和不额外浪费试剂、耗材、人力的前提下,保存了部分原始标本,这些标本可用于:重新进行细胞培养,本研究可得知羊水细胞置于冷藏冰箱中保存7~15 d,其细胞活性未见明显降低,取出,复温,也能成功培养出不少量的细胞;有利于真假嵌合体的分析,当两线结果出现偏差时有利于溯源;当有需要进行染色体微阵列分析( chromosomal microarray analysis,CMA)等进一步检查时提供原始材料,无需重新再取材,避免浪费,规避了风险。(2)优化了脱落贴壁细胞的过程。传统方法中,人为使用刮子将贴壁的羊水细胞刮落,耗时长,且要求力度适中,慢慢地刮取,若力度不合适则不易将细胞脱落下来或脱落下来的细胞不易分散,最终导致收获到的适用分裂相少,而改良法中,采用0.25% EDTA-胰酶溶液脱落细胞,无需人为用力,无需特定的技巧,只需在温箱中温育6 min,贴壁细胞即可完全自瓶中脱落下来。(3)收获染色体的过程中,传统方法使用吸管吹打,吸管错位吹打,则易发生交叉污染,影响结果的准确性,而在改良法中采用漩涡混匀器进行混匀,无需使用吸管,其混匀所需时间较使用吸管时减少,节约了时间,过程中大大地减少了交叉污染的可能。(4)改良方法的操作步骤较传统方法少,如脱落后的细胞可直接进行低渗,中途减少了一次离心的过程,又缩短了工作时间,故批次10个标本的实验时间平均缩短了30 min,同时提高了收获效率,如图1和图2所示,改良方法其所得到的核型较之传统法的多、好,能够用于发放报告的成功率达到100%。
此外,本研究对于培养失败的标本和未能在14 d收获的标本进行了原因分析及追踪。(1)培养失败的标本:该标本的羊水性状未见明显异常,羊水沉淀量不少,过程中培养基未见明显浑浊迹象,培养至第14天,未见贴壁细胞生长,取1 ml培养瓶中的液体进行细菌、真菌培养,未见异常,怀疑可能为该孕妇本身的特异性引起的不明原因培养失败,该孕妇重新取脐带血进行培养行核型分析,核型未见明显异常。(2)未能在14天收获的标本:该羊水性状异常,为褐色,离心后可见灰白色沉淀,故导致其羊水细胞生长缓慢,至第14天未能收获,但是经过原瓶再分布及加液处理,在第18天可收获,核型结果显示未见明显异常。由此得出,该标本是由于孕妇本身羊水异常导致其生长缓慢,收获的时间拖后,但是只要实验人员进行有目的的处理,其亦可得到足够多的核型进行分析。
综上所述,改良式羊水细胞培养及收获的方法在产前诊断染色体检查中的应用可在最大程度上避免孕妇再次羊膜腔穿刺及风险较高的脐带血穿刺,进一步确保了一次性穿刺可达到产前诊断染色体检查成功的效果,而且操作简单,耗时少,具有广泛的推广应用前景。
1 朱湘玉,胡娅莉.胎儿染色体异常诊断方法的研究进展.中华围产医学杂志,2009,12:105-108.
2 赖怡,刘之英,秦利.25510份孕中期羊水细胞的染色体分析.中华医学遗传学杂志,2015,32:117-119.
3 齐漫龙,赵彦艳,郑高艳.羊水染色体制备技术的改进.中国医科大学学报,2013,42:274-276.
4 韩美艳,俞冬熠,姜楠.影响羊水细胞培养成功率因素的分析.中国产前诊断杂志(电子版),2014,6:42-45.
5 染色体微阵列分析技术在产前诊断中的应用协作组.染色体微阵列分析技术在产前诊断中的应用专家共识.中华妇产科杂志,2014,8:570-572.
6 张志强,林少宾,谢英俊.改良孕中晚期羊水细胞培养方法的实验研究.中华医学遗传学杂志,2014,31:109-110.
7 谢金芳,蔡富强,纪霞.同步化羊水细胞传代培养在产前诊断中的应用.中华医学遗传学杂志,2014,10:666-668.
8 高劲松,刘俊涛.介入性产前诊断适应证和禁忌证及应用.中国实用妇科与产科杂志,2015,31:825-828.
9 吕时铭.高龄孕妇的产前诊断.中华检验医学杂志,2016,39:401-403.
