孕期尼古丁暴露所致成年子代雌鼠代谢综合征易感的宫内起源机制
2017-03-29刘永斌夏利平裴林国袁超汪晖
刘永斌 夏利平 裴林国 袁超 汪晖
生命早期的发育状况对于机体代谢的终身影响乃至对成年期发生某些慢性疾病的重要意义,日益受到重视。早在1989年,英国流行病学学家Barker教授[1]就提出了“成人疾病的胎儿起源(fetal origins of adult disease)”假说。流行病学研究显示,出生体重的差异来源于62%的宫内环境因素、20%的母体基因因素和18%的胎儿基因因素。学者利用人群流行病学研究和动物实验的方法对Barker假说进行了验证,并提出不单是胎儿期营养状况会对健康产生长久影响,婴幼儿期、儿童少年期甚至青壮年期的营养均会对其后期的健康产生一定程度的影响[2-3]。研究表明,85%~90%的宫内生长迟缓(intrauterine growth retardation, IUGR)胎儿在出生后2年发生追赶式生长,且有追赶式生长者更易于发生胰岛素抵抗(insulin resistance, IR)[4]。大量流行病学研究表明,IUGR、追赶式生长及伴随而来的肥胖与后期代谢综合征(metabolic syndrome, MS)、心血管疾病、2型糖尿病和非酒精性肝病发生密切相关[5-8]。
研究发现,孕期尼古丁、咖啡因和乙醇暴露皆可引起胎儿母源性糖皮质激素(glucocorticoid, GC)过暴露和下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal, HPA)轴功能低下,IUGR子代出生后HPA轴呈低基础活性和高应激敏感性改变,并伴有GC依赖的糖脂代谢改变,提出了外源物的“宫内神经内分泌代谢编程”机制[9-11]。研究表明,母体GC通过胎盘屏障进入雌性胎儿的量比进入雄性胎儿的量更大,提示了母体应激对雌性后代HPA轴的影响比雄性后代更大[12]。本研究通过观察高脂饮食(模拟高营养状态)、慢性应激(模拟高社会压力)及孕期尼古丁暴露(prenatal nicotine exposure, PNE)对子代雌鼠成年后的影响,从而进一步探讨IUGR子代MS易感的宫内起源机制,为特殊群体的优生优育和生后的合理干预提供更多的理论依据。
对象与方法
一、对象
1. 实验动物:未孕SPF级Wistar大鼠,雌性体重200~240 g,雄性体重260~300 g,购于湖北省疾病预防中心(合格证号:SCXK(鄂) 2007—2009,中国湖北)。
2.主要试剂:尼古丁(CAS. NO.54-11-5)购于中国潍坊三强集团公司;大鼠肾上腺激素释放激素(adrenocorticotropin-releasing hormone, ACTH)试剂盒购于北京北方生物研究所;大鼠皮质酮(corticosterone, CORT)试剂盒购于美国R&D公司;胰岛素ELISA试剂盒购于瑞典Mercodia公司;葡萄糖氧化酶法试剂盒购于上海名典生物工程有限公司;1型11β-羟类固醇脱氢酶(11β-hydroxysteroid dehydrogenase 1, 11β-HSD1)、糖皮质激素受体(glucocorticoid receptor, GR)、盐皮质激素受体(mineralocorticoid receptor, MR)及内对照磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase, GAPDH)引物、甘油三酯(triglyceride, TG)和总胆固醇(total cholesterol, TCH)试剂盒均购于上海生工生物工程技术有限公司;高密度脂蛋白-胆固醇(high-density lipoprotein-cholesterol, HDL-C)和低密度脂蛋白-胆固醇(low-density lipoprotein-cholesterol, LDL-C)试剂盒购于浙江创业生物有限公司。逆转录 PCR试剂购于大连TaKaRa公司;Applied Biosystems Step One实时定量PCR仪和PCR试剂盒购于美国Applied Biosystems公司。
二、方法
1.处理方法:大鼠适应性喂养1周后,于每晚6点按照雌鼠:雄鼠=2:1合笼,次晨阴道分泌物涂片镜检见精子者记为孕0天(gestational day 0, GD0)。将孕鼠随机分为对照组和PNE组,每组8只。自GD11开始,PNE组给予尼古丁2 mg/(kg·d)(皮下注射,分2次给予)至分娩;对照组给予等体积蒸馏水。分娩0天,每窝仔鼠数量调整为8只(雌雄数量均等),以保证哺乳期均等的营养。仔鼠于产后(postnatal week)1周PW1起每周称体重,并计算PW1—36的体重增长率,体重增长率(%)=(PWX体重-PW1体重)×100/PW1体重。PW4断奶后,各组每窝仔鼠随机选1只雌鼠,给予高脂饮食[13],PW24转为标准饮食饲养至PW40。两组子代鼠于PW38—40给予不可预见性慢性应激(unpredictable chronic stress, UCS),末次应激3天后,处死大鼠取血和海马组织。从妊娠0天到出生后40周动物实验流程图见图1。
图1 从妊娠0天至生后40周动物实验流程图
2.不可预见性慢性应激实验(UCS):根据文献[14],包括7种应激因子,如摄食限制24 h、水限制24 h、尾部夹痛5 min、45 ℃烘箱烤5 min、4~8 ℃冷水游泳4 min、颠倒昼夜循环及社会隔离(每个笼子1只大鼠)24 h,共持续14 d。
3.血代谢表型测定:根据试剂盒的说明,检测血ACTH、CORT、血糖、胰岛素、TG、TCH、LDL-C和HDL-C的水平,并计算胰岛素抵抗指数(insulin resistance index, IRI)和TG、TCH、LDL-C与HDL-C的比值。
IRI=空腹血糖(FBG)×空腹胰岛素(FINS)/22.5
4.海马相关基因的表达:取海马组织30 mg,按RNA-Solv Reagent 说明书提取总RNA。测A260和A280,并计算总RNA的浓度及纯度,调整总RNA浓度至1 g/L。cDNA合成和PCR扩增均按试剂盒方法说明进行。检测海马组织11β-HSD1、GR和MR的mRNA表达。各引物见表1。扩增产物回收按试剂盒说明进行。将回收产物以10倍梯度稀释成一系列浓度,根据预实验结果选取6个梯度浓度为标准品,与样品一起采用实时定量PCR仪扩增;以标准品的相对浓度为横坐标,测得各自的Ct值为纵坐标得到标准曲线。采用2-ΔΔCt计算mRNA表达的相对水平。

表1 引物序列
5.统计学处理:采用SPSS 13.0统计学软件进行数据处理。计量资料以(均数±标准误)表示,采用双尾t检验。P<0.05为差异有统计学意义。
结 果
一、出生后体重及其增长率的变化
观察和记录PNE子代出生后1周体重及其变化情况,见图2。PW1时,PNE组雌鼠体重为(10.3±0.5)g明显低于对照组[(13.9±0.3)g],直至PW40,PNE组雌鼠体重[(242.2±1.8)g]始终未超过对照组[(252.7±2.2)g],差异均有统计学意义。进一步分析可见,在PW16前,PNE组雌鼠体重增长率(1540.62±65.58)超过对照组(1634.71±119.51),之后持续高水平,出现统计学差异。提示低出生体重的PNE组雌鼠在“高营养”状态下体重呈现“追赶式生长”。

图2 孕期尼古丁暴露对子代雌鼠体重和体重增长率的影响 A.生后1周和36周体重; B.每月体重; C.体重增长率。与对照组比较,*P<0.05, **P<0.01;与生后一周比较,##P<0.01
二、HPA轴活性
通过检测成年雌鼠血ACTH和CORT水平,海马相关基因的表达,进一步了解成年雌鼠HPA轴的活性,见图3。PNE组大鼠血ACTH水平[(16.36±2.58)pg/ml]与对照组相当[(18.21±3.87)pg/ml],血CORT水平[1061.76±92.58]较对照组[(361.06±97.47)pg/ml]明显升高,差异有统计学意义(图3A、B);海马11β-HSD1[0.12±0.03]明显较对照组[0.05±0.01]升高,差异有统计学意义,而GR、MR表达及MR/GR[(6.85±1.01)、(0.16±0.05)、(0.03±0.01)]比与对照组相当[(5.88±0.58)、(0.20±0.04)、(0.03±0.01)](图3C—E),差异无统计学意义。提示PNE组雌鼠经历体重追赶式生长和晚期慢性应激后,海马HPA轴负反馈调节功能明显减弱,HPA轴功能持续亢进。

图3 孕期尼古丁暴露对子代成年雌鼠血促肾上腺皮质激素和皮质酮水平及海马相关基因表达的影响 A.血ACTH;B.血CORT;C.海马11β-HSD1 mRNA;D.海马GR mRNA;E.海马MR mRNA;F.海马 MR/GR。与对照组比较,*P<0.05, **P<0.01
三、糖脂代谢功能
为观察经历早期高营养和后期慢性应激下PNE成年雌鼠糖脂代谢的改变,检测和分析糖脂代谢血表型变化,见图4。PNE组成年雌鼠的血糖和胰岛素水平[(5.82±0.31)mmol/l、(103.39±9.11)μIU/ml]较对照组[(4.16±0.32)mmol/l、(45.14±1.39)μIU/ml]明显升高,致使IRI[(27.86±5.15)]随之较对照组[(8.11±1.29)]升高,差异有统计学意义(图4A—C);PNE组成年雌鼠TG、TCH和LDL-C水平[(3.71±0.30)mmol/l、(1.35±0.14)mmol/l、(1.11±0.01)mmol/l]较对照组[(3.30±0.25)mmol/l、(1.23±0.10)mmol/l、(0.38±0.04)mmol/l]呈不同程度升高,尤以血LDL-C水平升高明显,差异有统计学意义(图4D);进一步分析血脂比值改变发现,LDL-C/HDL-C比值(1.58±0.21)明显高于对照组(0.66±0.07),差异有统计学意义(图4E)。提示PNE成年雌鼠10月龄时出现高血糖、高胰岛素血症、IR及以LDL-C升高为主的高血脂。
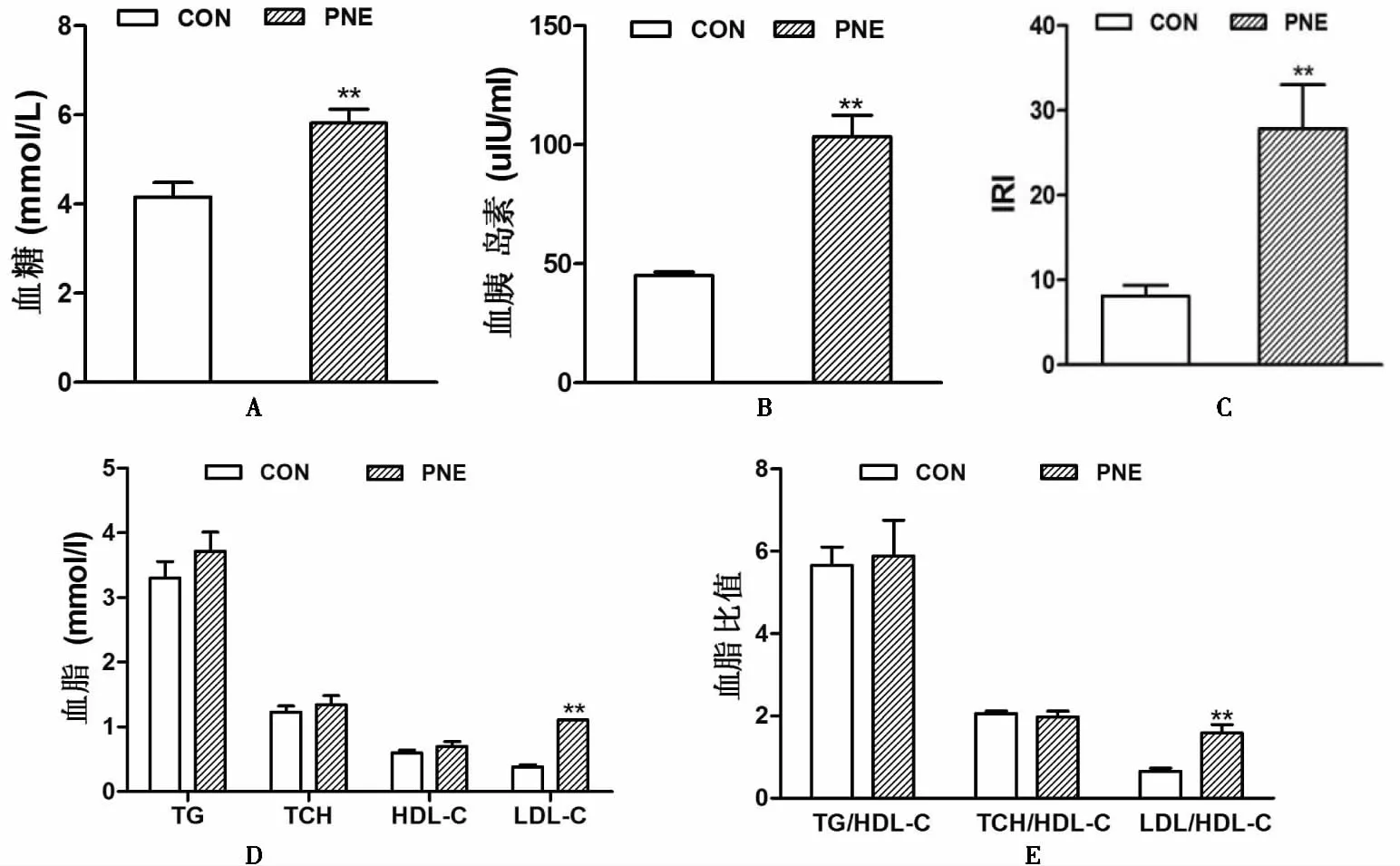
图4 孕期尼古丁暴露对子代成年雌鼠糖脂代谢的影响 A.血糖;B.血胰岛素;C.胰岛素抵抗指数 (IRI);D.血脂;E.血脂比值。与对照组比较,*P<0.05, **P<0.01
讨 论
中国成人MS患病率达14%~16%[15]。MS是高血压、高血糖、血脂紊乱和肥胖等多种疾病在人体内集结的一种状态,可直接引起脂肪肝、糖尿病和心脑血管疾病等。IR是共同的病理生理基础。越来越多的证据表明,胎儿发育对宫内环境的改变非常敏感,胎儿针对不良宫内环境做出的适应性反应将对胎儿出生后的健康和生存产生长期的影响。流行病学调查表明,IUGR胎儿发生成年MS的概率是2.3%,是正常体重胎儿的5.75倍,提示MS存在宫内起源[16]。追赶式生长可发生在包括婴幼儿、青少年期和成年期在内的生命任何阶段,其目的是为了减轻或消除发育不良带来的不利影响。然而,越来越多的研究显示,这一代偿机制会对机体造成后续危害,导致中心性肥胖、2型糖尿病和心血管疾病。本研究发现,在经历了出生后早期高营养状态和成年期慢性应激的10月龄PNE雌鼠出现高血皮质酮、高血糖、高血胰岛素、血脂紊乱,提示PNE可导致子代追赶式生长、IR及MS易感,患心脑血管疾病的风险增加。
越来越多的研究提示,宫内HPA轴的编程改变是成年后MS发生的最可能机制[17],HPA轴的调控异常及GC的外周代谢参与了IR的发生、发展[18-20]。研究发现,海马组织中11β-HSD1和GR共存于同一个神经元内[21],11β-HSD1、GR与MR共同参与对HPA轴的负反馈调节活动。相关研究结果显示,成年期4月龄IUGR仔鼠慢性应激后海马11β-HSD1、GR、MR等表达显著升高,提示慢性应激后IUGR仔鼠试图通过产生更多的11β-HSD1和GR来负反馈抑制HPA轴活性,使亢进的HPA轴逐渐回到基础状态[9-10]。然而,本研究发现,在经历了生后早期高营养状态和成年期慢性应激的10月龄PNE组雌鼠的海马11β-HSD1表达仍明显高于对照组,但是GR的表达不再明显增加、MR表达则呈降低趋势,提示PNE组成年雌鼠海马对HPA轴的负反馈抑制作用减弱,导致HPA轴功能呈持续亢进状态。过量的皮质酮是可引起海马神经元凋亡,导致海马损伤进一步加剧,最终海马HPA轴的负反馈机制逐渐减弱乃至消失,HPA轴功能出现紊乱。高水平的GC既是应激性海马损伤的结果,又是海马进一步损伤的原因。此外,本研究发现,反映HPA轴活性的指标——血ACTH和皮质酮水平变化不一致,皮质酮升高而ACTH不变,提示PNE成年雌鼠HPA轴的功能确实是紊乱的。
Reynolds[22]认为,宫内循环中高GC与宫内糖脂代谢的编程关系密切。前期研究也证实[9,23],PNE的IUGR子代出现神经内分泌代谢编程改变与宫内母源性GC过暴露有关,发现出生后4月龄子代仔鼠血糖不变但血脂升高,然而慢性应激可增加血糖而降低血脂,即重现宫内高GC下的糖脂代谢表型变化。随后的系列研究进一步证实,IUGR仔鼠在成年期呈现更为明显的糖代谢功能减弱和血脂异常[24]。为了进一步了解IUGR子代生活后期的糖脂代谢功能变化,本研究继续观察了经历出生后早期高营养状态和成年期慢性应激的10月龄仔鼠的糖脂代谢血表型变化。本研究发现,PNE组HPA轴功能持续亢进的同时,呈现显性高血糖、高胰岛素血症,并出现IR。同时血脂也是异常的,主要表现为高LDL-C血症、LDL-C/HDL-C比值增加。PNE成年雌鼠的这种高血糖、高胰岛素血症和血脂紊乱的出现,高度提示MS易感。其发生可能与“HPA轴相关的宫内神经内分泌代谢编程”出现紊乱有关。糖脂代谢紊乱是心血管疾病的重要危险因素。高LDL-C和低HDL-C是缺血发作患者主要的危险因子[25]。大量研究表明,血脂比值对冠状动脉粥样硬化性心脏病的早期预防和诊断有较大的临床价值,采用TCH/HDL-C、LDL-C/HDL-C比值能反映冠状动脉病变的范围和程度,且对冠状动脉粥样硬化程度的预测价值要优于Lpa和apoB/apoA[26-28]。本研究分析了各血脂比值的改变,发现PNE组成年雌鼠具有更高的LDL-C/HDL-C比值,提示PNE组成年雌鼠心脑血管疾病的患病风险明显增加。
综上所述,经历出生后早期高营养状态和成年期慢性应激生活事件的PNE10月龄仔鼠呈现高血糖、高胰岛素血症,出现IR;血脂紊乱,血脂比值升高,MS易感,患心脑血管疾病风险明显增加,其发生机制与HPA轴的宫内神经内分泌代谢编程出现紊乱相关,HPA轴的发育异常加快了MS及代谢性疾病的进程。本研究进一步解析了IUGR个体MS易感的宫内起源机制,为这一特殊群体的宫内预防和生后终生合理干预提供更多的理论及实验依据,对倡导优生优育和提高IUGR特殊群体的生存质量具有重要现实意义。
1 Barker DJ,Osmond C,Law CM.The intrauterine and early postnatal origins of cardiovascular disease and chronic bronchitis.J Epidemiol Community Health,1989,43:237-240.
2 van Dijk SJ,Tellam RL,Morrison JL,et al.Recent developments on the role of epigenetics in obesity and metabolic disease.Clin Epigenetics,2015,7:66.
3 Bouret S,Levin BE,Ozanne SE.Gene-environment interactions controlling energy and glucose homeostasis and the developmental origins of obesity.Physiol Rev,2015,95:47-82.
4 Fabricius-Bjerre S,Jensen RB,Larsen T,et al.Impact of birth weight and early infant weight gain on insulin resistance and associated cardiovascular risk factors in adolescence.PLoS One,2011,6:e20595.
5 Morrison JL,Duffield JA,Muhlhausler BS,et al.Fetal growth restriction,catch -up growth and the early origins of insulin resistance and visceral obesity.Pediatr Nephrol,2010,25:669-677.
6 Thorn SR,Rozance PJ,Brown LD,et al.The intrauterine growth restriction phenotype:Fetal adaptations and potential implications for later life insulin resistance and diabetes.Semin Reprod Med,2011,29:225-236.
7 Takaya J,Kaneko K.Small for gestational age and magnesium in cord blood platelets:Intrauterine magnesium deficiency may induce metabolic syndrome in later life.J Pregnancy,2011,2011:270474.
8 Leach L,Mann GE.Consequences of fetal programming for cardiovascular disease in adulthood.Microcirculation,2011,18:253-255.
9 Liu L,Liu F,Kou H,et al.Prenatal nicotine exposure induced a hypothalamic-pituitary-adrenal axis-associated neuroendocrine metabolic programmed alteration in IUGR offspring rats.Toxicol Lett,2012,214:307-313.
10 Xu D,Wu Y,Liu F,et al.A hypothalamic-pituitary-adrenal axis-associated neuroendocrine metabolic programmed alteration in offspring rats of IUGR induced by prenatal caffeine ingestion.Toxicol Appl Pharmacol,2012,264:395-403.
11 Xia LP,Shen L,Kou H,et al.Prenatal ethanol exposure enhance the susceptibility to metabolic syndrome in offspring rats by HPA axis-associated neuroendocrine metabolic programming.Toxicol Lett,2014,226:98-105.
12 Montano MM,Wang MH,Vomsaal FS.Sex differences in plasma corticosterone in mouse fetuses are mediated by differential placental transport from the mother and eliminated by maternal adrenalectomy or stress.Journal of Reproduction Fertile,1993,99:283-290.
13 Zhang L,Xu D,Zhang B,et al.Prenatal food restriction induces a hypothalamic-pituitary-adrenocortical axis-associated neuroendocrine metabolic programmed alteration in adult offspring rats.Arch Med Res,2013,44:335-345.
14 Willner P.Chronic mild stress (CMS) revisited:consistency and behavioural neurobiological concordance in the effects of CMS.Neuropsychobiol,2005,52:90-110.
15 Gu D,Reynolds K,Wu X,Chen J,et al.Prevalence of the metabolic syndrome and overweight among adults in China.Lancet,2005,365:1398-1405.
16 Alisi A,Panera N,Agostoni C,et al.Intrauterine growth retardation and nonalcoholic Fatty liver disease in children.Int.J.Endocrinol,2011,269853.
17 万顺伦,廖茂瑶,郝如松,等.大鼠海马神经元内11β-HSD1和GR的共存及其意义.生理学报,2002,54:473-478.
18 Gragnoli C.Hypothesis of the neuroendocrine cortisol pathway gene role in the comorbidity of depression,type 2 diabetes,and metabolic syndrome.Appl Clin Genet,2014,7:43-53.
19 Aschbacher K,Rodriguez-Fernandez M,van Wietmarschen H,et al.The hypothalamic-pituitary -adrenal-leptin axis and metabolic health:a systems approach to resilience,robustness and control.Interface Focus,2014,4:1-9.
20 Auvinen HE,Romijn JA,Biermasz NR,et al.The effects of high fat diet on the basal activity of the hypothalamus-pituitary-adrenal axis inmice.J Endocrinol,2012,214:191-197.
21 Meaney MJ,Szyf M,Seckl JR.Epigenetic mechanisms of perinatal programming of hypothalamic-pituitary-adrenal function and health.Trends Mol Med,2007,13:269-277.
22 Reynolds RM.Corticosteroid-mediated programming and the pathogenesis of obesity and diabetes.J Steroid Biochem Mol Biol,2010,122:3-9.
23 Xu D,Liang G,Yan YE,et al.Nicotine-induced over-exposure to maternal glucocorticoid and activated glucocorticoid metabolism causes hypothalamic-pituitary-adrenal axis-associated neuroendocrine metabolic alterations in fetal rats.Toxicol Lett,2012,209:282-290.
24 Xu D,Xia LP,Zhang BJ,et al.Prenatal nicotine exposure induces a HPA axis-associated neuroendocrine metabolic programmed alteration in adult offspring rats fed by high-fat diet.Acta Pharmacol Sin,2013,34:1526-1534.
25 Tziomalos K,Athyros VG,Karagiannis A,et al.Dyslipidemia as a risk factor for ischemic stroke.Curr Top Med Chem,2009,9:1291-1297.
26 Amarenco P,Goldstein LB,Callahan III A,et al.Baseline blood pressure,low- and high-density lipoproteins,and triglycerides and the risk of vascular events in the Stroke Prevention by Aggressive Reduction in Cholesterol Levels (SPARCL) trial.Atherosclerosis,2009,204:515-520.
27 Kanaoka T,Takahashi J,Wakamatsu Y,et al.Lowered postoperative ldl-c/hdl-c ratio reduces later cardiovascular events after abdominal aortic aneurysm surgery.Ann Vasc Dis,2012,5:36-44.
28 Kimura T,Itoh T,Fusazaki T,et al.Low-density lipoprotein-cholesterol/high-density lipoprotein- cholesterol ratio predicts lipid-rich coronary plaque in patients with coronary artery disease-integrated-backscatter intravascular ultrasound study.Circ J,2010,74:1392-1398.
