三甲医院PCR实验室环境下的无创产前检测
2017-03-29许泽辉崖娇练罗世强李哲涛黄际卫唐宁
许泽辉 崖娇练 罗世强 李哲涛 黄际卫 唐宁
无创产前检测(non-invasive prenatal testing, NIPT)技术是一项胎儿染色体非整倍体如21三体(Trisomy 21, T21)、18三体(Trisomy, T18)、13三体(Trisomy, T13)的产前筛查新技术,准确率达到99%以上,在产前筛查中有着良好应用前景。2014年,国家卫计委批准第一批NIPT试点,标志着NIPT将逐步进入临床应用。同时多家公司的NIPT配套试剂和仪器通过CFDA批准,迅速进入各NIPT试点。为了保证检测质量,卫生部临检中心随之出台了全国外周血胎儿染色体非整倍体(T21、T18和T13)高通量测序检测室间质量评价,并于2015年正式开展。此前,NIPT样本一直在第三方检测机构检测,如今整个NIPT流程将在医院实验室完成。本地化过程中是否能保持高度一致的检测水平,能否高标准通过室间质量评价,成为各试点迫切关心的一个问题。本实验室前期进行的一批367例NIPT筛查实验,在随后的跟踪随访中证实了NIPT结果的准确性,与国际上大多数研究结果比较一致。随后,本实验室引进基于NextSeq CN500基因测序仪的NIPT检测平台。针对NIPT在医院PCR实验室资质和产前诊断母婴保健技术准入实验室环境下的检测能力报道不多见,主要集中在如何改善NIPT检测的准确性。国外研究也较少,原因包括伦理及宗教信仰等因素,即使发现阳性结果,可能并不能终止妊娠。为了进一步了解NIPT结果的重复性,本实验室对已知结果的样本进行重复实验,探究NIPT检测在重复性方面的表现。
对象与方法
一、对象
实验材料为2014年7月份由柳州市妇幼保健院妇产围生科采集冻存的孕妇外周血浆样本。采集规则:根据国内外的NIPT临床指导意见,从标本采集开始排除不适用NIPT的样本。
二、方法
1.试剂与器材:血浆游离DNA提取试剂盒,Cat:R0011;高通量测序文库构建DNA纯化试剂盒(磁珠法),Cat:R0022;NestSeq CN500 Buffer Cartridge, REF:15054656;High Output Reagent Cartridge,REF:15053214;High Output Flow Cell Cartridge,REF:15043755,杭州贝瑞和康基因诊断技术有限公司生产。SYBR Green PCR Master Mix,Cat:10687-581,ABI公司。DNA定量分析仪(Qubit©2.0 Fluorometer),Cat:4376600, Life technology公司生产。CFX96©Real Time PCR system,Bio-Rad T100 PCR仪,伯乐公司。NextSeq CN500高通量测序仪及贝比安©数据分析系统,杭州贝瑞和康基因诊断技术有限公司生产。
2.实验方法:将367例NIPT前瞻性样本按Z值归类,抽取70例21、18、13号染色体阴性样本,21、18、13号染色体阳性样本各2例,由培训合格的NIPT实验技术员(操作者均培训并取得获得PCR上岗证书和产前诊断母婴保健技术培训合格证书)在医院实验室重做NIPT,获得Z值并与第一次给予比较分析。
3.提纯DNA:从-20 ℃冰箱取出血浆样本解冻,离心。在干净的BD管中加入磁珠等相关试剂备用。离心完将上清转移到BD管中,在垂直混匀仪混匀。在磁力架沉淀BD管中的磁珠。将磁珠转移到磁力架上的中转管中,用wash buffer漂洗磁珠,吸干残液。加入EB buffer 洗脱。瞬时离心收集,将DNA溶液转移到新EP管中,-20 ℃冻存。
4.高通量测序文库构建:取出DNA样本解冻,瞬时离心收集。冰上操作,配制反应Mix1,分装到PCR管。再加入DNA,迅速混匀,在PCR仪中反应。反应完后,样本取出放在冰上。配制Mix2,分装到PCR管。再加入Adaptor T混匀,在PCR仪中反应。在中转EP管分装平衡好的磁珠。再加入样本并混匀。室温放置片刻。瞬时离心收集,置于磁力架上吸附磁珠。吸弃上清,用wash buffer洗涤磁珠。瞬时离心收集,吸取残液。室温晾干,加入洗脱液重悬。瞬时离心收集,置于磁力架上吸附磁珠。吸取洗脱文库到新EP管中,-20 ℃冻存。
5.qPCR定量:-20 ℃取出上述文库样本、浓度标准品、DNA standards解冻。将18 μl的稀释液分装到0.5 ml EP管中。每个样本取2 μl加入,漩涡震荡混匀。另将198 μl的稀释液分装到0.5 ml EP管中。加入2 μl 浓度标准品,漩涡震荡混匀。浓度标准品做3重复,标准曲线做5个点,一个阴性对照(NTC,稀释液)。依据说明书配制反应Mix,分装到qPCR版中。加入稀释好的样本、浓度标准品及DNA standards、NTC。封口离心。qPCR仪检测,根据qPCR结果判断文库构建情况并换算文库浓度。
6.混合文库:制定混合文库方案,筛选出所要混合文库样本,根据文库浓度,给出合适的参考混合量及混合后的理论浓度。打印混合文库方案。对照方案找出所要混合文库的文库样本,并将文库样本混合。混合好后,进行qPCR定量,方法如上。
7.高通量测序平台高通量测序:准备新的Reagent Cartridge:解冻,检查。NextSep CN500运行清洗程序一次。计算所需混合文库、NaOH体积。将混合文库和NaOH依次加入EP管中,振荡混匀。室温静置变性。将NaOCl、变性后的文库加入Reagent Cartridge。运行测序程序,根据提示装载Flow Cell,Buffer Cartridge,Reagent Cartridge,输入运行参数并核对。检查Pre-Run结果。无异常即选择Start Run,监控Run运行。Run完成后清洗仪器。Run数据输送到分析平台进行分析。
8.数据分析:添加上述样本的信息到贝比安TM数据分析系统。上机完成后提交分析。分析完成后,查看分析报告。21、18、13号染色体Z值在(-3.0,3.0)判断为阴性,≥3.0为阳性。Z值代表计算每条染色体所占比例的评分结果,计算公式为:Z值=(染色体唯一比对序列数目占常染色体的百分比-参照样品组染色体比例平均值)/参照样品组染色体比例标准偏差
9.统计学处理:两次NIPT实验Z值采用SPSS 13.0进行Pearson相关系数分析。变量的相关强度判断,相关系数0.8~1.0极强相关;0.6~0.8强相关;0.4~0.6中等程度相关;0.2~0.4 弱相关;0.0~0.2极弱相关或无相关。
结 果
NIPT实验后,分析结果提示阳性对照为Chr21/Chr18/Chr13高风险,即结果为阳性,判定整张芯片的分析结果有效。76例样本顺利完成实验,上机数据分析正常。分别对70例21、18、13号染色体阴性样本两次Z值作为竖轴,样本序号作为横轴作散点连线图(图1、图2、图3);对6例T13、T18及T21样本两次Z值,以Z值为纵轴,样本种类为横轴作柱形图(图4)。
图1中将70例13号染色体阴性样本的第一次检测的Z值从小到大排列,并做线性回归分析,提示Z值为线性递增,y=0.0594x-2.5129,R2=0.9778;与之对应的第二次结果提示非线性y=0.029x-1.0716,R2= 0.331。两次Z值的Pearson相关系数为r=0.594,显示两组数据中等相关,总体来看多数样本的两次Z值有浮动。第二次结果均在(-3.0,3.0)区间内,与第一次结果一致。
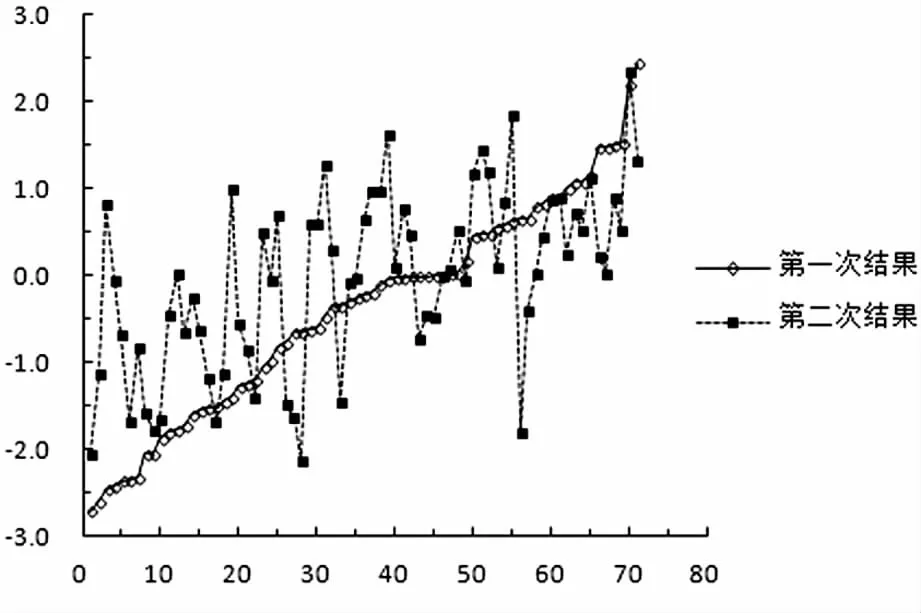
图1 70例13号染色体阴性样本的两次Z值对比
图2两次18号染色体Z值结果一致,且同样有浮动。第一次结果从低到高线性递增,y=0.0623x-2.2208,R2=0.9689;对应的,第二次结果则非线性,y=0.0172x-0.4768,R2=0.133。两次Z值的Pearson相关系数为r=0.356,两次结果弱相关。
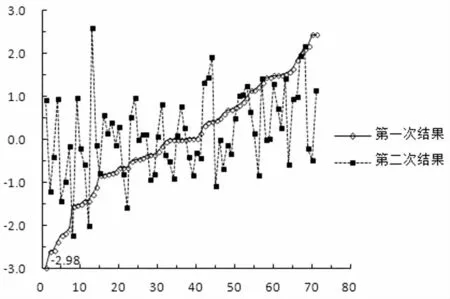
图2 70例18号染色体阴性样本的两次Z值对比
图3两次21号染色体Z值结果一致,同样有浮动,浮动幅度最大达到4.00。第一次结果从低到高线性递增,y=0.0559x-2.3188,R2=0.9621 ;与之对应的第二次则并无线性关系,y=0.0154x-0.6026,R2=0.0697。两次Z值的Pearson相关系数为r=0.224,两次结果为弱相关。

图3 70例21号染色体阴性样本的两次Z值对比
图4中6例阳性样本的两次结果一致。两次Z值之间有一定的浮动,且均在(3.0,+∞)区间内所有样本两次检测结果的Z值之间有一定的浮动,阴性样本检测结果的Z值均在(-3.0,3.0),阳性样本两次检测结果的Z值均高于3.0,第一次与第二次检查结果的Z值比较,差异无统计学意义,见表1。

图4 6例T13、T18或T21样本NIPI两次Z值对比
讨 论
NIPT技术基于母血游离的胎儿DNA含量与孕周变化关系[1-2]及整倍体与非整倍体之间的胎儿游离DNA含量差异关系[3]。精确地检测出胎儿游离DNA含量也就成为了NIPT准确性的关键。一是排除母源性、胎源性的干扰因素;二是控制实验流程带来的误差。目前,国际上在排除母源性、胎源性[4]的干扰均取得了突破。而后者由于NIPT检测程序复杂,如标本保存、试剂耗材的运输与质保、检测系统的运行状态和实验操作人员的素质等,稍有不当都会导致胎儿游离DNA含量改变,从而影响检测结果的准确性。《高通量基因测序产前筛查与诊断技术规范(试行)》规定的产前诊断机构剩余的血浆样本应保存至产后2年以上备用,因此,开展NIPT的实验室应进行后续标本库的建设。医院实验室是个多种实验并行开展的大环境,本实验室目前多为多种实验并行开展,在实验条件控制方面不可能完全达到理想要求。本实验旨在医院实验室条件下,进行一次NIPT检测,评估该实验的可行性。本课题组将后续开展不同时间段样本的复检以及评价实验。

表1 两次检测结果的Z值比较
NIPT技术是通过生物信息学手段及数学方法分析胎儿染色体非整倍体(T21、T18和T13)情况的,其获得的Z值[5-6]代表计算每条染色体所占比例的评分结果,是通过GC校正后的染色体比值,使所有染色体处于同一水平上比对。实验将通过比较两次Z值变化,判断NIPT定性结果的重复性。本实验结果显示两次NIPT实验的定性结果是一致的,尽管各染色体的Z值有较小的浮动,但Z值虽是数值,却是定性结果。阴性样本的Z值在(-3.0,3.0)范围内判定变化差异无意义,相对的阳性样本的Z值在[3.0,+∞)范围内变化差异也无意义。而导致这些浮动可能因素可能有以下几点。首先实验材料为同一个样本分离出平行三管的血浆,但本次所用血浆经历了长时间冻存,两次冻融,致使所用样本中胎儿的DNA含量出现一定波动,但结果上没有变化。因此,标本分离多管(至少三管)是极为必要的,可以备失控时实验重复及长期冻存样本;其次,实验环境不同,试剂批次不同,测序仪控制软件版本升级,由不同实验员操作等多种实验条件的改变,可能出现的误差。特别应注意的是,NIPT大部分的实验属于手工操作,经过严格定期培训的人员和符合要求条件的实验室硬件是保证质量的必备条件,但要心存隐患意识,及时排除差错隐患。本实验室开展NIPT实验均严格双人双录核对,及时排除了差错隐患。鉴于阴性、阳性样本的定性结果与第一次保持一致,当前实验条件导致的差异并不影响定性结果。这说明该NIPT检测平台的稳定性很好,在一定程度上适应医院实验室中的各种实验环境变化,满足政策的要求。
经过多次预实验及改善磨合,通过卫生部的室间质评,在三甲医院PCR实验室开展NIPT是可行的。NIPT各环节诸多技术限制因素依旧存在,仍需不断对NIPT技术进行优化改进。
1 Liu F,Wang X,Feng X,et al.Feasibility study of using fetal DNA in maternal plasma for non‐invasive prenatal diagnosis.Acta Obstetricia Et Gynecologica Scandinavica,2007,86:535-541.
2 Wang E,Batey A,Struble C,et al.Gestational age and maternal weight effects on fetal cell‐free DNA in maternal plasma.Prenat Diagn,2013,33:662-666.
3 Zimmermann B,Hill M,Gemelos G,et al.Noninvasive prenatal aneuploidy testing of chromosomes 13,18,21,X,and Y,using targeted sequencing of polymorphic loci.Prenat Diagn,2012,32:1233-1241.
4 Canick JA,Palomaki GE,Kloza EM,et al.The impact ofmaternal plasma DNA fetal fraction on next generationsequencing tests for common fetal aneuploidies.Prenat Diagn,2013,3:667-674.
5 Chiu R,Chan K,Gao Y,et al.Noninvasive prenatal diagnosis of fetal chromosomal aneuploidy by massively parallel genomic sequencing of DNA in maternal plasma.Proc Natl Acad Sci U S A,2008,105:20458-20463.
6 Srinivasan A,Bianchi DW,Huang H,et al.Noninvasive detection of fetal subchromosome abnormalities via deep sequencing of maternal plasma.Am J Hum Genet,2013,92:167-176.
