成纤维细胞激活蛋白α在神经胶质瘤中的表达及临床意义
2017-03-29陈渊苏志鹏金涌郑伟明
陈渊,苏志鹏,金涌,郑伟明
(1.台州市立医院 神经外科,浙江 台州 318000;2.温州医科大学附属第一医院 神经外科,浙江温州 325015)
成纤维细胞激活蛋白α在神经胶质瘤中的表达及临床意义
陈渊1,苏志鹏2,金涌1,郑伟明2
(1.台州市立医院 神经外科,浙江 台州 318000;2.温州医科大学附属第一医院 神经外科,浙江温州 325015)
目的:探讨成纤维细胞激活蛋白α(FAP-α)在神经胶质瘤组织中的表达及其与临床病理特征和预后的关系。方法:应用免疫组织化学法检测33例神经胶质瘤和7例正常对照脑组织中FAP-α蛋白的表达,并结合临床病理资料进行分析。同时对所有病例进行随访,分析FAP-α表达与患者预后的关系。进一步检索脑肿瘤分子数据库(Rembrandt)探讨FAP mRNA表达与预后的关系。结果:低级别胶质瘤和高级别胶质瘤之间FAP-α蛋白的积分光密度值(IOD)差异有统计学意义(P<0.01),且与胶质瘤病理分级存在正相关(r=0.673,P<0.01)。7例正常脑组织FAP-α蛋白不表达或表达弱阳性,与低级别胶质瘤(P<0.05)和高级别胶质瘤(P<0.01)比较差异有统计学意义。FAP-α蛋白的表达强度与患者性别、肿瘤大小、年龄以及手术切除程度无明显相关性(P>0.05)。生存分析显示FAP-α低表达组和高表达组生存率差异有统计学意义(P<0.01),FAP-α的表达是影响胶质瘤患者预后的独立因素(P<0.05)。检索脑肿瘤分子数据库,发现FAP mRNA低表达预后明显好于高表达(P<0.01)。结论:FAP-α在神经胶质瘤中存在表达,且与神经胶质瘤的病理分级正相关,其高表达可能提示不良预后。
成纤维细胞激活蛋白α;神经胶质瘤;免疫组织化学;预后
神经胶质瘤是颅内发病率较高的恶性肿瘤之一,尽管随着显微手术的进步,肿瘤的切除率得到很大的提高,化疗、放疗的应用以及手术、化疗、放疗的综合治疗,使得患者的预后得到一定的改善,仍存在肿瘤易复发,患者病死率高,生存时间短的难题。研究发现成纤维细胞激活蛋白α(fibroblast ac-tivation protein α,FAP-α)在肿瘤的发生、浸润和转移等一系列过程中发挥重要作用[1-3]。国内目前关于FAP-α表达与胶质瘤关系的报道较少。本研究通过探讨FAP-α在神经胶质瘤中的表达,分析其与临床病理特征和预后的关系,从而揭示FAP-α在神经胶质瘤中表达的临床意义,以期为进一步研究FAP-α在胶质瘤发生发展中的作用提供理论依据,为胶质瘤的诊断及预后判断提供新的评价指标。
1 对象和方法
1.1 研究对象 33例胶质瘤蜡块取自温州医科大学附属第一医院病理科保存的2007年至2011年间手术标本,其中男17例,女16例;年龄9~74岁,平均年龄45.2岁。所有标本均经HE染色明确为胶质瘤,参照2007年WHO神经系统肿瘤分类标准确定病理诊断和分级。其中I级5例,I I级9例,I I I级10例,IV级9例。所有患者术前均未接受过放疗、化疗,术后接受正规治疗。正常对照脑组织7例均取自因颅脑损伤行颅内减压术的患者,常规福尔马林固定,石蜡包埋。所有标本切片避开坏死、囊性变、钙化部分。
1.2 主要试剂 兔抗人多克隆FAP-α(ab-53066-100)抗体购自美国Abcam公司,兔二步法检测试剂盒(PV-9001)和DAB显色试剂盒(ZLI-9017)购自北京中杉金桥有限公司。
1.3 免疫组织化学法检测 组织切片采用免疫组织化学超敏二步法,按照PV-9001免疫组织化学试剂盒说明书进行操作。每例标本同时用PBS代替一抗染色作为阴性对照。采用双盲法阅片,胞膜或胞质内呈棕黄色颗粒的细胞为阳性细胞,即FAP-α(+)。在光学显微镜下每张切片随机选取10个高倍镜视野(×400)采集图像,应用美国Media Cybernetics Image公司设计的Image-Pro Plus6.0软件选取并分析阳性区域,计算积分光密度(IOD)值(IOD=阳性区面积×平均光密度),来反映阳性蛋白的强度或浓度。将所有IOD值按百分位值分成4个等级: 0~25%,阴性表达;25%~50%,弱阳性表达;50%~75%,中度表达;75%~100%,高度表达。同时按IOD值的中位数值分成低表达组和高表达组,0~50%为低表达组,50%~100%为高表达组。
1.4 随访 对33例胶质瘤患者进行随访,通过患者病历资料采集临床基本信息,并制定随访表,主要以电话随访和门诊随访2种方式。总生存期是指入院日期到患者因胶质瘤或相关并发症而死亡为止,所有患者临床资料及随访资料完整。
1.5 统计学处理方法 所有数据均采用SPSS19.0软件进行分析。计量资料用±s表示,若数据呈正态分布且方差齐,多组间均数比较用单因素方差分析,组间两两均数比较用LSD-t检验。数据非正态分布或方差不齐,用多个样本比较的Kruskal-Wallis H秩和检验,两两比较采用Mann-Whitney U秩和检验。相关性分析采用sperman秩相关性分析。采用Kaplan Meier法进行生存分析,并进行Log-Rank检验;预后分析采用Cox比例风险模型。计数资料采用卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 FAP-α在神经胶质瘤组织中的表达 在胶质瘤组织中,FAP-α的免疫组织化学阳性反应产物呈棕黄色或棕褐色,分布于肿瘤细胞的胞膜和(或)胞浆,在正常脑组织中不表达或弱表达,见图1。正常脑组织FAP-α蛋白的表达与胶质瘤(低级别和高级别)相比差异有统计学意义(P<0.05)。对比低级别胶质瘤和高级别胶质瘤之间FAP-α蛋白的IOD值差异有统计学意义(P<0.01),见表1。
2.2 FAP-α阳性表达与胶质瘤临床病理特征的关系
FAP-α表达与患者的性别、年龄、肿瘤大小及手术切除程度无明显相关(P>0.05),而与肿瘤的病理分级呈正相关(r=0.673,P<0.01),其表达随肿瘤病理级别的增高而增强,见表2。
2.3 FAP-α表达强度与患者预后的关系 依据随访条件,本组共随访33例,其中15例死亡,18例存活。根据FAP-α免疫组织化学染色IOD值的中位值,把随访患者分成低表达组和高表达组。生存分析显示低表达组和高表达组两者生存率差异有统计学意义(P<0.01),见图2,FAP-α的表达是影响胶质瘤患者预后的独立因素(P<0.05),进一步检索Rembrandt数据库,探讨FAP mRNA与胶质瘤患者预后的关系(低表达组n=59,高表达组n=88),发现差异有统计学意义(P<0.01),见图3。
3 讨论
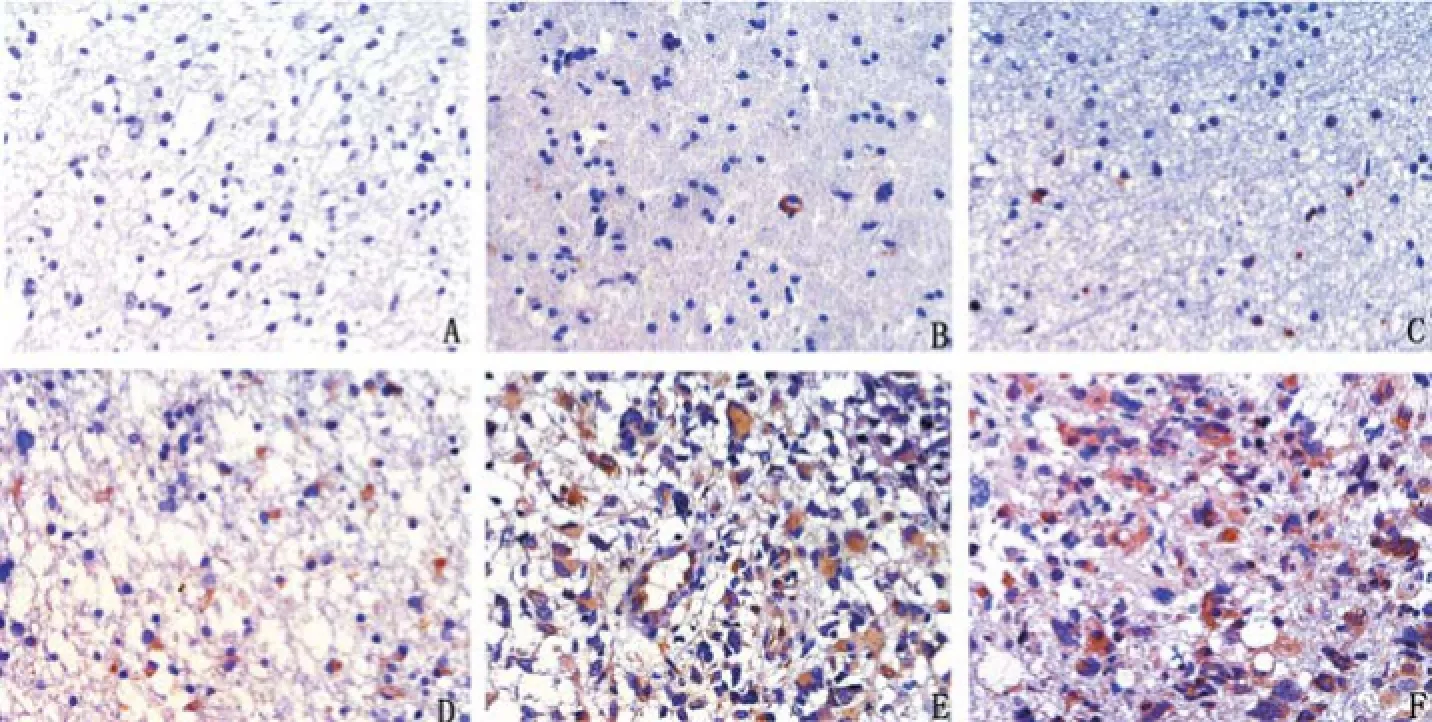
图1 FAP-α蛋白在正常脑组织和胶质瘤中的表达(×400)
表1 FAP-α蛋白在不同级别胶质瘤中的表达(±s)

表1 FAP-α蛋白在不同级别胶质瘤中的表达(±s)
组别nIOD值正常组 7644.1±269.0低级别组(I~I I级)141 690.0±1 471.4a高级别组(I I I~IV级)1916 528.0±14 474.2ab与正常组比:aP<0.05;与低级别组比:bP<0.01表2 胶质瘤中FAP-α表达与临床病理特点的关系临床病理特征n低表达(例)高表达(例)P性别0.556男17710女16610年龄(岁)0.371<50231013≥50103 7肿瘤大小(cm)0.377≤4113 8 4~6 93 6≥6137 6病理分级(WHO)0.002 I+I I级1410 4 II+IV级19316手术切除程度全切135 80.610次全切20812 I
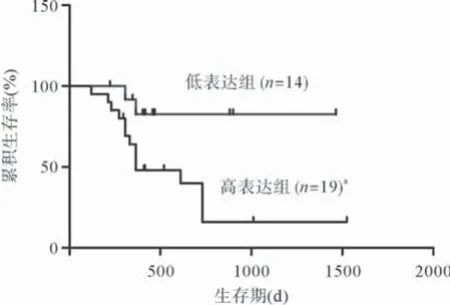
图2 FAP-α蛋白表达与生存期的Kaplan Meier曲线

图3 FAP mRNA表达与生存期的Kaplan Meier曲线
FAP-α选择性表达于90%以上恶性上皮性肿瘤(如乳腺癌、卵巢癌、结肠癌、胰腺癌、肺癌、皮肤黑色素瘤等)基质中的肿瘤相关成纤维细胞中,定位于胞膜和胞浆[4-8],却几乎不表达于正常组织及良性上皮肿瘤间质中静息成纤维细胞,且罕见于肿瘤细胞中。
FAP-α在神经胶质瘤中的研究较少。前期我们利用免疫细胞化学染色、Western blot法及RT-PCR法发现FAP-α在胶质瘤细胞株U87中存在表达[9],这和以往FAP-α只表达于肿瘤间质有所不同。本研究进一步在临床病理标本中印证FAP-α分布于肿瘤细胞的胞浆和(或)胞膜,这与MENTLEIN等[10]的研究结果相似。STREMENOVA等[11]通过RT-PCR法检测FAP-α在31例胶质瘤和11例正常组织中的表达发现,两者都存在一定程度的表达,且与病理级别相关。本研究采用免疫组织化学法检测33例胶质瘤及7例正常脑组织得出了相似的结论,胶质瘤组织和正常组织两者的表达差异有统计学意义。不同病理级别胶质瘤表达的IOD值之间差异也有统计学意义,级别越高其表达越强,存在正相关。另外我们前期的研究结果显示抑制FAP-α表达,胶质瘤细胞U87的增殖能力下降[9]。这些均提示FAP-α可能参与了肿瘤的恶性进展,因此其表达强度对判断胶质瘤的恶性程度具有一定的指导意义。
国内外有不少文献报道了FAP-α表达和不同肿瘤患者的临床病理和预后之间的关系。王秋艳等[12]发现在54例宫颈癌中FAP-α阳性率为88.89%,且FAP-α表达与宫颈癌的临床分期有关,提示FAP-α的表达与宫颈癌演进有关。HENRY等[13]将138例人结肠癌标本进行免疫组织化学染色以评估FAP-α表达的临床意义,结果发现间质中高表达FAP-α的结肠癌患者更易于发生侵袭性进展、潜在的转移或复发。FAP-α在胰腺癌中高表达,肿瘤发生时达到高值,且越高的FAP-α表达量预示着越差的预后[14]。苏静等[15]研究了FAP-α在50例宫颈癌间质中的表达,发现随着宫颈癌组织中FAP-α表达的增强,肿瘤组织中的微血管密度也明显增加。赵志娟等[16]在乳腺癌的研究中也得到了类似的结果。这些研究显示FAP-α的表达促进肿瘤的生长并对肿瘤的侵袭、转移起到了一定作用。提示FAP-α可能是肿瘤生长和转移的一个重要调节因子。通过对胶质瘤患者临床病理参数的分析,我们发现,FAP-α的表达强度与胶质瘤患者的性别、年龄和肿瘤大小以及手术切除程度无明显关系(P均>0.05)。生存分析发现低FAP-α组和高FAP-α组两者生存率差异有统计学意义(P<0.01),FAP-α的表达是影响胶质瘤患者预后的独立因素,同时利用分子肿瘤数据库,发现FAP mRNA低表达组预后明显好于高表达组,与本研究结果一致,说明其在一定程度上可以判断患者预后,是一个有价值的生物学标志物。但需要注意的是,本研究的样本量较小,随访时间短,未来需要纳入更大的样本量进行长期随访分析。
总之,本研究发现,FAP-α在胶质瘤组织中存在表达,且与病理级别正相关,并可能影响胶质瘤患者的预后,提示其可能与胶质瘤的发生发展有关,可能成为判断胶质瘤恶性程度和预后的指标之一。
[1] 崔博, 王绮雯, 方瑞, 等. 结直肠癌组织中成纤维细胞激活蛋白的表达及临床意义[J]. 中华胃肠外科杂志, 2012, 15 (4): 392-395.
[2] 武金波, 靳占峰. 成纤维细胞激活蛋白的表达与胃癌恶性生物学行为的关系[J]. 黑龙江医学, 2008, 32(1): 21-23.
[3] KENNEDY A, DONG H, CHEN D, et al. Elevation of seprase expression and promotion of an invasive phenotype by collagenous matrices in ovarian tumor cells[J]. Int J Cancer, 2009, 124(1): 27-35.
[4] WASTER P, ROSDAHL I, GILMORE B F, et al. Ultraviolet exposure of melanoma cells induces fibroblast activation protein-alpha in f broblasts: Implications for melanoma invasion[J]. Int J Oncol, 2011, 39(1): 193-202.
[5] ACHARYA P S, ZUKAS A, CHANDAN V, et al. Fibroblast activation protein: a serine protease expressed at the remodeling interface in idiopathic pulmonary fibrosis[J]. Hum Pathol, 2006, 37(3): 352-360.
[6] 张浩亮, 赵松. FAP和TGF-β1在肺腺癌中的表达及临床意义[J]. 中国老年学杂志, 2010, 30(3): 318-320.
[7] SHI M, YU D H, CHEN Y, et al. Expression of f broblast activation protein in human pancreatic adenocarcinoma and its clinicopathological significance[J]. World J Gastroenterol, 2012, 18(8): 840-846.
[8] HUA X, YU L, HUANG X, et al. Expression and role of f -broblast activation protein-alpha in microinvasive breast carcinoma[J]. Diagn Pathol, 2011, 6(1): 111-117.
[9] 陈渊, 王伟, 涂明, 等. siRNA靶向沉默成纤维细胞激活蛋白α对胶质瘤细胞U87增殖的影响[J]. 温州医科大学学报, 2014, 44(4): 241-244.
[10] MENTLEIN R, HATTERMANN K, HEMION C, et al. Expression and role of the cell surface protease seprase/fibroblast activation protein-α (FAP-α) in astroglial tumors[J]. Biol Chem, 2011, 392(3): 199-207.
[11] STREMENOVA J, KREPELA E, MARES V, et al. Expression and enzymatic activity of dipeptidyl peptidase-IV in human astrocytic tumours are associated with tumour grade[J]. Int J Oncol, 2007, 31(4): 785-792.
[12] 王秋艳, 邵洪江, 靳占峰. FAP和TGFβ1在宫颈癌中的表达及其意义[J]. 肿瘤学杂志, 2009, 15(3): 179-181.
[13] HENRY L R, LEE H O, LEE J S, et al. Clinical implications of f broblast activation protein in patients with colon cancer [J]. Clin Cancer Res, 2007, 13(6): 1736-1741.
[14] COHEN S J, ALPAUGH R K, PALAZZO I, et al. Fibroblast activation protein and its relationship to clinical outcome in pancreatic adenocarcinoma[J]. Pancreas, 2008, 37(2): 154-158.
[15] 苏静, 邵洪江, 靳占峰. 在宫颈癌间质中表达的FAP与MVD的相关性[J]. 国际遗传学杂志, 2010, 33(4): 211-214, 220.
[16] 赵志娟, 米小轶, 刘树立, 等. FAP在乳腺癌间质中的表达及其与微血管密度的关系[J]. 中国组织化学与细胞化学杂志, 2007, 16(5): 559-563.
(本文编辑:赵翠翠)
Expression of f broblast activation alpha protein in glioma and its signif cance
CHEN Yuan1, SU Zhipeng2,
JIN Yong1, ZHENG Weiming2. 1.Department of Neurosurgery, Taizhou Municipal Hospital, Taizhou, 318000; 2.Department of Neurosurgery, the First Aff liated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective:To explore the expression of FAP-α in human gliomas, and its relationship between clinical characteristics and prognosis.Methods:Expression level of FAP-α protein was detected with immunohistochemistry in 33 cases of human gliomas and 7 cases of normal brain tissue, followed by subsequent clinicopathological correlative studies. Meanwhile, all patients were followed up, the relationship between the expression level of FAP-α and the glioma prognosis were studied. Furthermore, brain tumor molecular database (Rembrandt) was searched to investigate the relationship between the FAPmRNA expression and prognosis.Results:Comparing the expression intensities (IOD) of FAP-α protein in low-grade gliomas with those in high-grade gliomas, it was signif -cantly different (P<0.01); the expressions of FAP-α and the pathological grades of glioma were positively correlated (r=0.673, P<0.01). There was low or no expression in 7 cases of normal brain tissue; Comparing with low grade glioma (P<0.05) and high grade glioma (P<0.01), there was signif cantly difference. The FAP-α expression was not signif cantly correlated with gender or tumor size or surgical degree and age (P>0.05). By survival analysis, overall survival time was signif cantly difference between the Low FAP-α and High FAP-α (P<0.01), and the expression of FAP-α was a independent prognostic factor in human gliomas (P<0.05). According to the results obtained from Rembrandt, patients with high FAP mRNA-expressing glioma showed statistically poorer prognoses compared with patients with low FAP mRNA-expressing glioma.Conclusion:FAP-α is expressed in human gliomas, which is positively correlated with the pathological grade of gliomas, and its high expression may suggest a poor prognosis.
f broblast activation protein α; glioma; immunohistochemistry; prognosis
R739.41
A
10.3969/j.issn.2095-9400.2017.02.007
2016-05-17
浙江省外科学重中之重学科开放基金资助项目(kfjj 2011006)。
陈渊(1988-),男,浙江台州人,住院医师,硕士。
郑伟明,主任医师,硕士生导师,Email:zhwm61@ 126.com。
