应用MRI动态增强双输入血流动力学模型评价中晚期肝细胞癌微血管特征
2017-03-29赵志刚赵振华杨建峰章俞赵丽杨立铭王挺卢增新
赵志刚,赵振华,杨建峰,章俞,赵丽,杨立铭,王挺,卢增新
(绍兴市人民医院 浙江大学绍兴医院 放射科,浙江 绍兴 312000)
应用MRI动态增强双输入血流动力学模型评价中晚期肝细胞癌微血管特征
赵志刚,赵振华,杨建峰,章俞,赵丽,杨立铭,王挺,卢增新
(绍兴市人民医院 浙江大学绍兴医院 放射科,浙江 绍兴 312000)
目的:调查MRI动态增强双输入双室血液动力学模型评价中晚期肝细胞癌肿瘤微血管特征的可行性。方法:自2014年1月至2015年4月间对28例肝细胞癌(HCC)患者的血流动力学参数(Ktrans、Fp、PS、Kep、Ve、Vp、HPI)使用双输入双室血流动力学模型(双输入extended Tofts和双输入双室exchange模型)进行测量和分析。使用配对Student’s t检验和非参数配对Wilcoxon秩和检验比较2种模型测量的相同的几个血流动力学参数;使用pearson相关性分析观察这些相同的参数有无相关性。使用pearson分析肿瘤大小和血流动力学的参数,而HCC分期、大小和血流动力学参数的相关性使用spearman相关性分析。结果:在双输入双室exchange模型(2CXM),Fp值明显大于PS值[Fp=1.07 mL/(mL・min),PS=0.19 mL/(mL・min)]。HPI在双输入extended Tofts模型和双输入2CXM分别为0.66和0.63。在2种模型中,Kep、Vp和HPI差异无统计学意义(P=0.524,P=0.569,P=0.622)。除了Ve,2种模型中所有的血流动力学参数都具有相关性。双输入2CXM模型中的Fp和PS与双输入extended Tofts模型的Ktrans相关(r=0.566,P=0.002;r=0.570,P=0.002),Kep、Vp和HPI在2种模型中显正相关(r=0.594,P=0.001;r=0.686,P=0.0001;r=0.391,P=0.004)。双输入extended Tofts模型的Ve显著小于双输入2CXM模型中的Ve值(P=0.004)且两者无相关性(r=0.276,P= 0.156)。无论是肿瘤大小和分期都未与血流动力学参数相关(P>0.05)。结论:双输入双室血流动力学模型可以评价中晚期HCC的微血管病理生理特征。双输入extended Tofts模型对于测量Ve更稳定,然而双输入2CXM对测量微血管渗透性可能更详细和准确。
肝肿瘤;动态增强;磁共振成像;药代动力学
目前,中晚期肝细胞癌(hepatocellular carcinoma,HCC)患者通常采用分子靶向药物治疗、插管栓塞化疗(transcatheter arterial chemoembolization,TACE)和射频治疗等非外科手术治疗方法[1],这些治疗方法的疗效评价与肿瘤的微血管状态改变密切相关[2]。T1加权MRI动态增强(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)血流动力学模型在评价微血管灌注和渗透性等血流动力学参数评估肿瘤微血管状态和特征中具有重要价值[3]。研究[2,4-7]显示,使用单输入单室或双室血流动力学模型来评价肿瘤血流动力学参数,评估肿瘤微血管状态可以监测HCC转移瘤介入治疗或抗血管生成药物的疗效。
根据对比剂在肿瘤内的动态分布,对比剂在一定空间内充分混合被定义为“室”,在“室”内对比剂浓度大体上均匀一致[8-9]。对比剂“室”模型分为单室模型如Tofts模型,该模型假定对比剂局限于单独一个室(如血管内),以及双室模型如extended Tofts模型和双室exchange模型(2CXM),该模型模拟对比剂从血管腔内转移到血管外细胞外间隙(extravascular extracellular space,EES)[8]。组织器官潜在微血管生理以及扫描MRI的时间分辨率和空间分辨率是选择血流动力学模型的重要因素,绝大多数肿瘤实质有肿瘤血管腔内容积和EES 2个“室”组成(对比剂不进入细胞内),因此,双室血流动力学模型可能更好地反映肿瘤的微循环状态[10]。此外,HCC在不同分期,往往由不同比例的肝动脉和门静脉供血[11],因此笔者假设双输入双室血流动力学模型可能更准确地评价中晚期HCC微血管状态特征。
到目前为止,利用细胞外对比剂的双输入双室血流动力学模型评价中晚期HCC微血管特征的研究尚未在临床实践中广泛开展。因此,本研究的目的是应用双输入extended Tofts模型和双输入2CXM模型分析中晚期HCC的血管灌注和渗透性参数,前瞻性地探索双输入双室血流动力学模型是否可用于评价HCC的肿瘤微血管特征。
1 资料和方法
1.1 一般资料 本研究经医院伦理委员会批准并获得患者知情同意。2014年1月到2015年4月期间,对42例未经任何抗肿瘤治疗的HCC患者行DCE-MRI检查,入选标准为经手术或穿刺活检病理确诊和依据欧洲肝脏研究协会推荐的多排CT多期扫描诊断标准诊断的年龄≥18岁的HCC患者,检查前均未进行抗肿瘤治疗,病灶最大直径≥2 cm;排除标准:有MRI检查禁忌证者;明显肾功能不全者;图像运动伪影严重者;肝静脉或下腔静脉及门静脉栓子者。本研究按2012年欧洲肝脏研究协会标准对所有HCC患者行巴塞罗那肝癌分期[12]。由于肿瘤微血管生理参数是功能性指标未能在体外测量,本研究把HCC的病理学特征共识作为参考标准,即大部分HCC为富血供,由肝动脉和门静脉按不同比例供血。
1.2 MRI检查 使用3.0T MR扫描机(Magnetom,Verio Siemens,Erlangen,德国)和12通道体部线圈,扫描方案包括:横断位T2加权扰相自旋回波(TR/TE 1 370/81,层厚6 mm,层间距1.2 mm,矩阵207×320,带宽220 kHz),弥散加权成像(TR/TE 7 400/73,层厚6 mm,层间距1.2 mm,b值0 s/mm2,600 s/mm2,矩阵99×146,带宽180 kHz),多翻转角T1成像和稳态自由呼吸,T1加权三维容积内插激励脂肪抑制序列(TR/TE为3.5/1.17 ms,层厚5 mm,间距1 mm,矩阵288×164,视野350 mm×284 mm,扫描30层,翻转角平扫T1为5°、10°和15°,增强T1为10°,时间分辨率6 s)。注射对比剂后5 s开始DCE-MRI数据采集。对比剂以3.5 mL/s的速率注入肘部正中静脉,随后以2 mL/s的速度用20 mL 0.9%氯化钠溶液冲洗。DCE-MRI共35扫描相,持续227.5 s。
1.3 模型设计 本研究采用双输入双室血流动力学模型分析HCC的肿瘤血流灌注和血管通透性,该模型设计模拟肝动脉和门静脉供血,假设对比剂在双“室”(肿瘤血管内容积和EES),本研究应用肝动脉指数(hepatic perfusion index,HPI)来观察肝动脉供血肿瘤成份比例,通过测量肝动脉和门静脉的血管输入函数(vascular input function,VIF)来测定肿瘤组织内血管的对比剂供应量,所有符号的定义见表1。

表1 双输入extended Tofts模型和双输入exchange模型参数定义和单位
血管内对比剂可以通过毛细血管渗透到EES,Ktrans描述了对比剂的转移常数,它包括Fp和PS,Kep是对比剂从EES到血浆的转移常数率,Vp和Ve分别是血管内容积和EES的容积分数[13]。
双输入extended Tofts模型评价Ktrans、Ve、Vp和Kep,该血流动力学模型忽略血浆的平均转移时间,导致在血浆室的对比剂浓度等同于供血动脉的对比剂浓度[14],因此组织内对比剂浓度Ctiss(t)公式(1A)为:
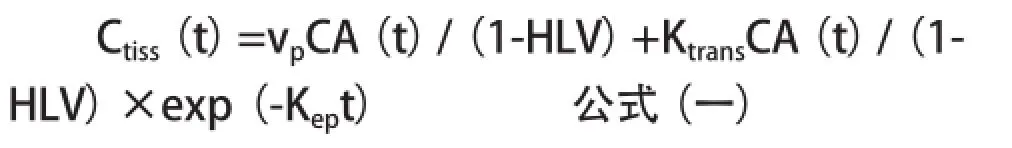
等式(1A)为单输入extended Tofts模型公式,随后插入双输入公式(2)[即CA(t)→faCA(t)+(1-fa)Cv(t)]产生双输入extended Tofts模型(1B)为:

2CXM是最常用的exchange模型,能够分别测量Fp和PS,同时还可测量Ve、Vp和Kep[9,13],单输入2CXM对比剂在组织内的浓度公式(3A)为:

代入双输入公式(2)获得最终的双输入2CXM公式(3B)为:
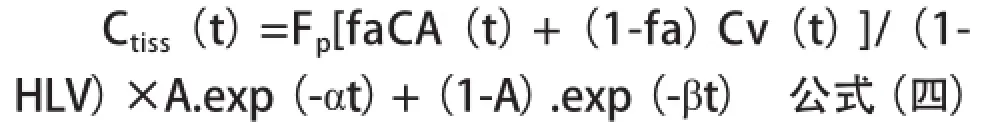
A、α和β根据血流动力学模型参数Vp、Ve和PS取得:A=PS/Vp;α=PS/ve;β=Fp/Vp。
1.4 数据处理和分析 由于数例患者肝内有多个HCC病灶,本研究选择测量直径最大的病灶作为研究病灶。为保证每次操作处理的一致性,所有数据由同一位放射学医师(具有17年腹部放射诊断经验)测量。所有的分析数据采用Omni Kinetics软件(GE Healthcare)进行分析。数据导入后,采用3D非刚性配准对图像数据进行校正以减小呼吸和心脏搏动引起的运动伪影,随后把肿瘤病灶的信号-时间曲线转换成对比剂浓度-时间曲线(见图1-2)。把对比增强前的图像像素内信号强度进行设置,血液和肌肉T1值分别设定为1 600 ms和1 580 ms,同时设定血浆在全血的比例为0.42。在测量血流动力学参数前,分别在门静脉和腹主动脉近肝动脉入口处画感兴趣区(ROI)以拟合VIF(见图3)。同一患者2个模型的ROI大小,部位基本一致。选择显示最大病灶层面的增强T1WI图像,手工勾画病灶的ROI,避免坏死、出血、脂肪变性,随后使用双输入extended Tofs模型和双输入2CXM模型拟合数据计算肿瘤的灌注和渗透性参数:双输入extended Tofs模型的Ktrans,双输入2CXM模型的Fp和PS及2个模型的Ve、Vp和Kep及HPI参数。所有数据测量3次取平均值。
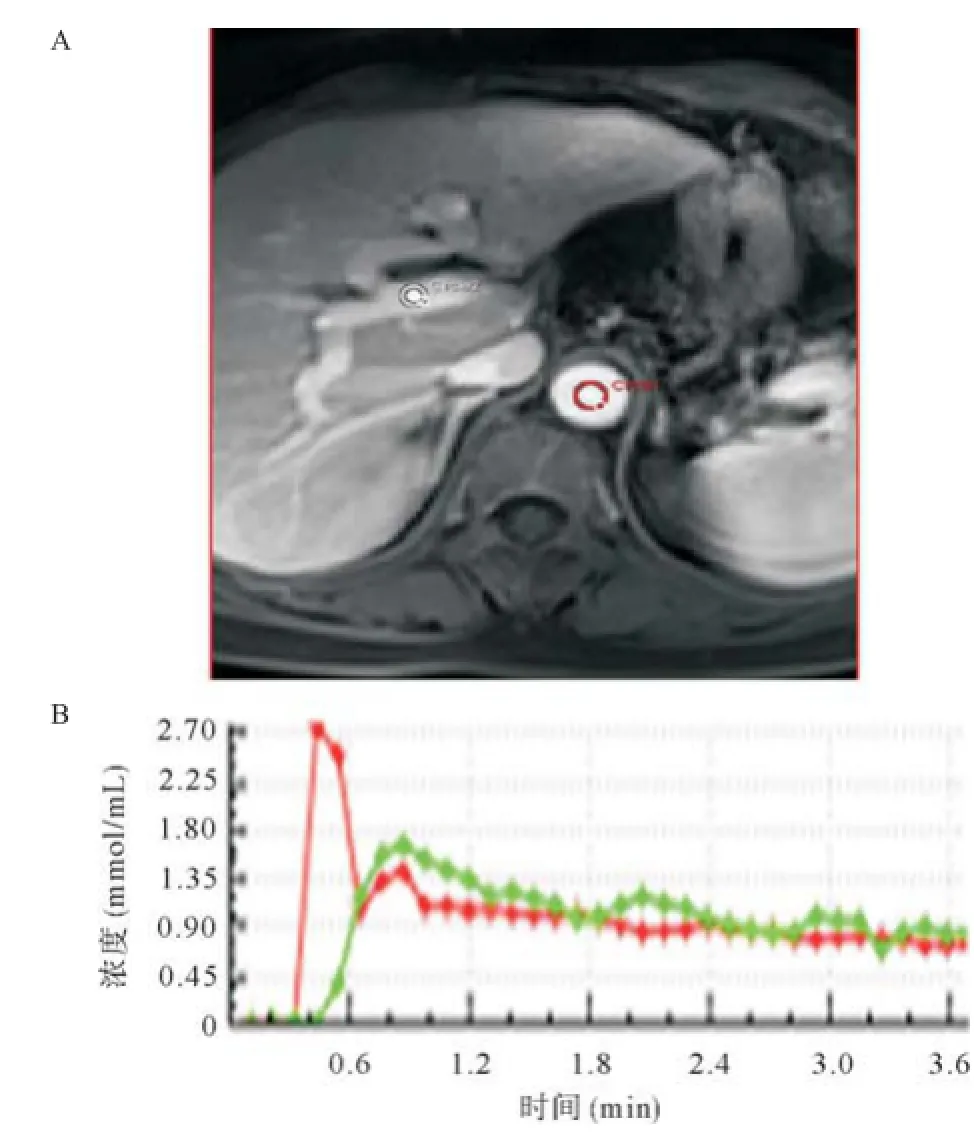
图1 未行3D非刚性配准图像

图2 3D非刚性配准图像
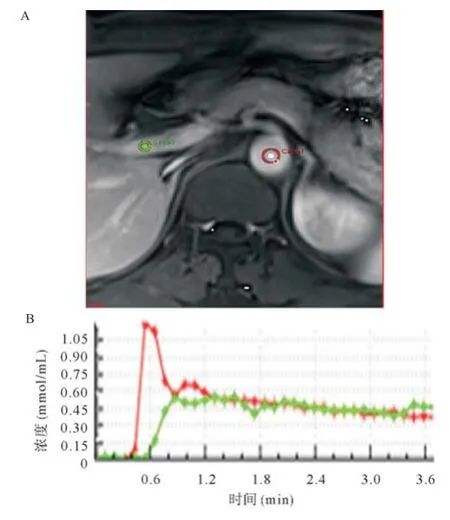
图3 双输入模型血管输入函数测量示意图
1.5 统计学处理方法 采用SPSS19.0统计学软件进行数据分析。采用pearson相关性分析肿瘤大小和血流动力学参数相关性;采用spearman检验分析HCC分期、大小与血流动力学参数的相关性。双输入extended Tofts模型和双输入2CXM模型间的血流动力学参数比较采用配对Student’s t检验或非参数配对Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
在本研究中,共有42例经病理证实和临床诊断的HCC患者行T1WI DCE-MRI检查,14例患者被排除出研究(包括门静脉或肝静脉/下腔静脉栓塞6例,严重运动伪影4例,因幽闭恐惧症而检查失败1例,对比剂注射速率不同3例),最终共28例中晚期HCC患者纳入研究。肿瘤大小与分期具有相关性(r=0.463,P=0.013),而肿瘤大小、肿瘤分期与2个模型的血流动力参数无相关性。
DCE-MRI双输入双室动力学模型的微血管病理生理参数见表1,双输入extended Tofts模型和双输入2CXM的Kep、Vp、HPI差异无统计学意义(P= 0.524,P=0.569,P=0.622),除了Ve,2个模型的其他所测血流动力学参数具有相关性:双输入2CXM的Fp、PS与双输入extended Tofts模型的Ktrans呈正相关(r=0.566,P=0.002;r=0.570,P=0.002),Kep、Vp和HPI呈正相关(r=0.594,P=0.001;r=0.686,P<0.0001;r=0.391,P=0.040),见图4-7;双输入extended Tofts模型的Ve值显著小于双输入2CXM中的Ve值(P=0.004),且在2个模型中无相关性(r=0.276,P=0.156),见表2和图8;双输入2CXM的Fp值大于PS值[Fp=1.07 mL/(mL・min),PS=0.19 mL/(mL・min)],双输入extended Tofts模型的Ktrans值为0.29 min-1。双输入extended Tofts模型和双输入2CXM模型的HPI值分别为0.66和0.63。
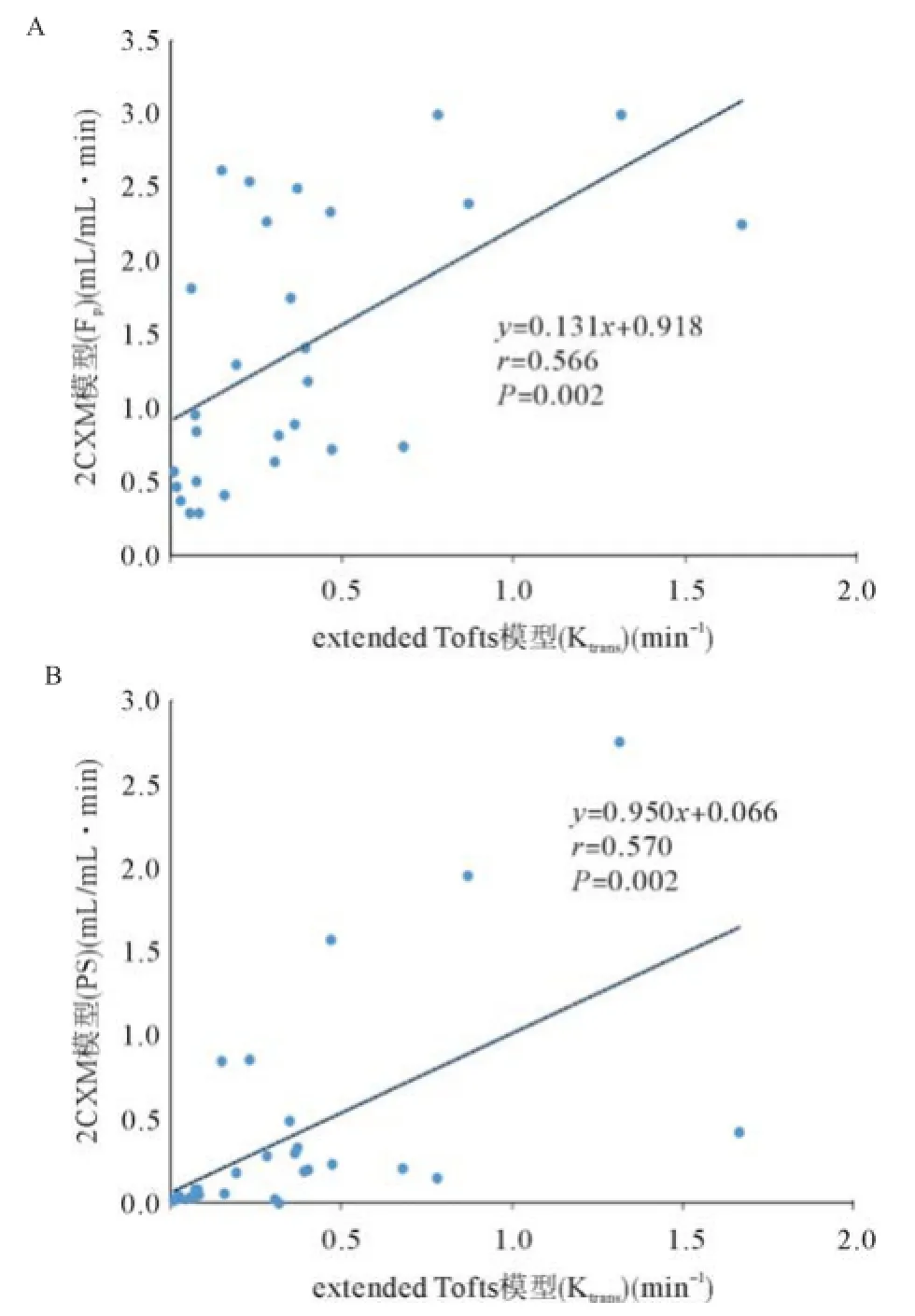
图4 双输入extended Tofts模型的血流动力学参数Ktrans与双输入2CXM模型的Fp(A)和PS(B)呈正相关(n=28)
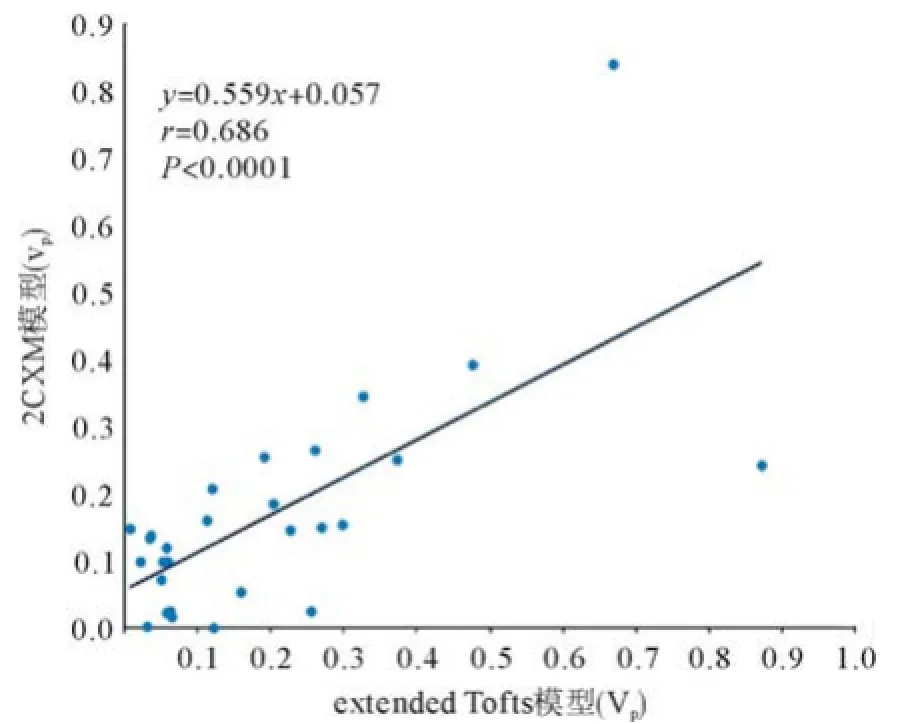
图5 双输入extended Tofts模型和双输入2CXM模型的微血管参数Kep呈正相关(n=28)
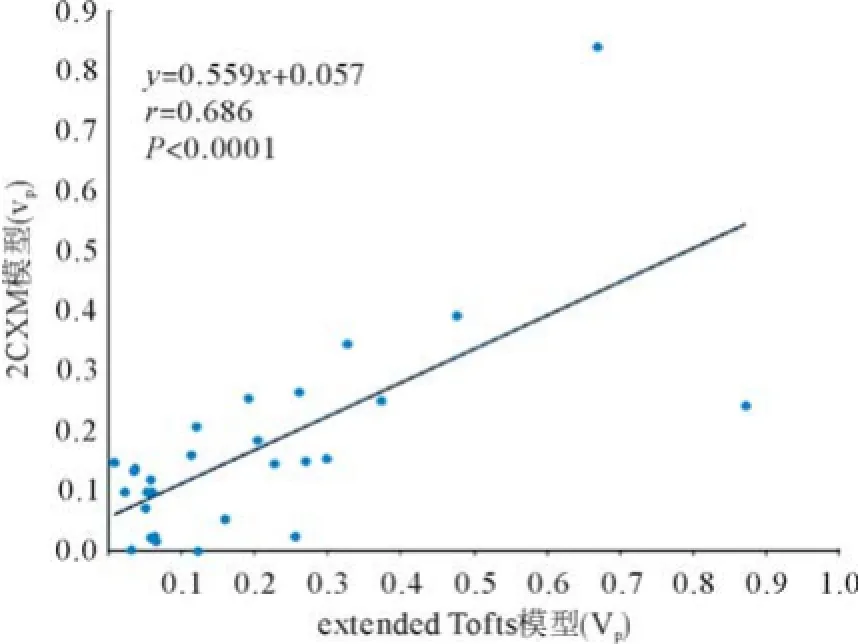
图6 双输入extended Tofts模型和双输入2CXM模型的微血管参数Ve值具有相关性(n=28)
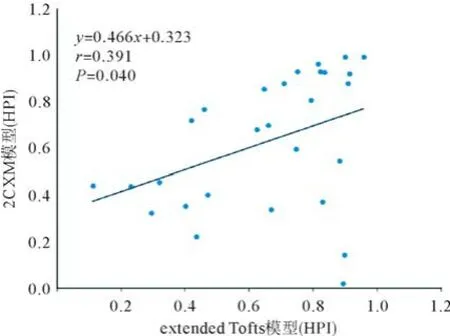
图7 双输入extended Tofts模型和双输入2CXM模型的微血管参数HPI具有相关性(n=28)
3 讨论
近年来,中晚期HCC经抗血管生成靶向药物、射频治疗及插管化疗栓塞治疗后采用修改的RECIST标准(mRECIST)评价治疗效果,而mRECIST标准是通过评价肿瘤动脉期增强来判断肿瘤的活性成分[15-16],提示肿瘤血管的评价对治疗效果的评估具有重要意义。近年来,有研究[6]提示DCE-MRI可以定量检测有关灌注和渗透性的血流动力学和微血管参数,可以对肿瘤病理生理特征提供全面的评价。然而,在MR扫描机具有足够时间分辨率及空间分辨率的条件下,找到一种符合HCC实际病理生理的血流动力学模型变得更加重要和迫切。
已有数个研究使用单输入单室或者单输入双室血流动力学模型评价HCC的微血管特征,监测介入治疗或抗血管生成药物治疗的治疗反应[6-7,17]。然而,根据THNG等[10]和VAN等[11]的研究,除了肿瘤细胞内空间外,HCC的实质由血管内容积和EES组成,同时由肝动脉和门静脉以不同比例供血。因此笔者假设,在使用高场强MR扫描器的条件下,双输入双室血流动力学模型更适合于评价中晚期HCC的微血管特征。本研究的目的是调查双输入extended Tofts模型和双输入2CXM模型评价中晚期HCC的微血管特征的可行性。
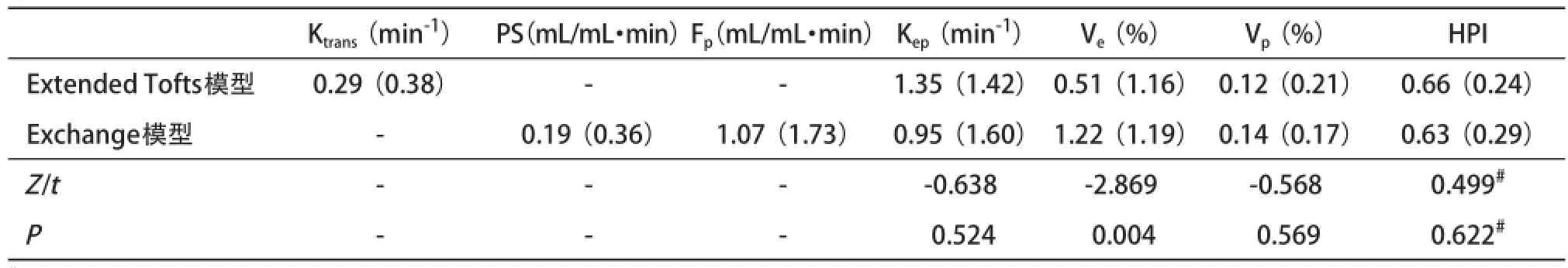
表2 28例中晚期HCC患者双输入双室动力学模型的微血管参数比较[Median(IQR)]
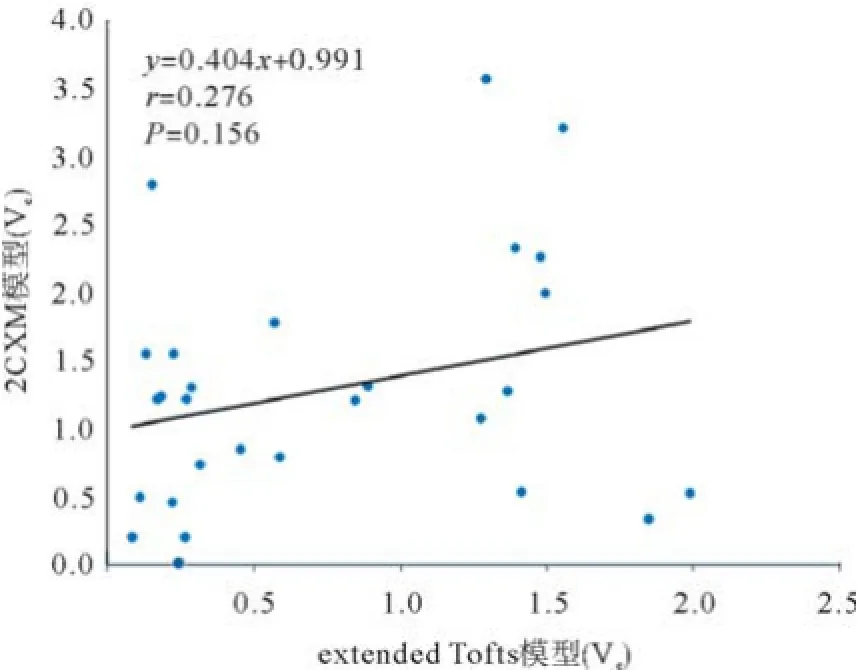
图8 双输入extended Tofts模型和双输入2CXM模型的微血管参数Ve值无相关性(n=28)
肝脏是一个富血供的器官,主要由门静脉供血(占75%),少部分由肝动脉供血(占25%)[18]。然而,早期HCC的肿瘤新生血管绝大部分由肝动脉供血,随着病灶的进展,门静脉也逐渐参与供血[19]。HPI描绘了全肝血流灌注中肝动脉与门静脉血流所占的比例,是肝脏血流灌注的半定量指标[10]。在本研究中,我们应用该灌注参数来观察肝动脉血流供应中晚期HCC的比例,验证双输入是一种符合中晚期HCC血流动力学参数的模型。本研究显示,双输入extended Tofts模型和双输入2CXM的HPI分别为0.66和0.63,这个结果与大部分中晚期HCC供血模式为双血供的共识基本一致,证明肝动脉血流在中晚期HCC占大部分而非占绝大部分。
Ktrans是评价血管渗透性和非手术治疗疗效评价的一个重要指标。有研究[6-7]提示,经过舒尼替尼和氟尿苷治疗后,Ktrans值可以显著下降并与临床症状改善的疗效相关。依据PS和Fp的动态平衡状态,Ktrans有3种生理学解释:在高PS状态下(PS明显大于Fp),Ktrans值与Fp值基本相等,相反,在高Fp状态(Fp明显大于PS),Ktrans值近似等于PS值,在血流和渗透性混合条件下,Ktrans是Fp和初始渗透分数(E)的一个加权值[20]。TOFTS等[20]和BERGAMINO等[21]提出,双输入extended Tofts模型在高灌注含较高Fp的组织可以提供准确的渗透性值。本研究结果显示,在双输入2CXM模型,Fp值大于PS值,同时,双输入extended Tofts模型的Ktrans值接近于PS,而且Fp和PS值都与Ktrans值相关。这些结果与Ktrans、Fp和PS的上述第2种关系解释相一致,同时证明,双输入双室血流动力学模型符合中晚期HCC的生理学特征(高灌注、相关高血流量)可以应用于评价治疗前HCC的灌注和渗透性。
DCE-MRI除了帮助诊断HCC外,最重要的作用是对进展期HCC行非手术治疗后的疗效进行评估。由于Fp和PS改变的方向相反或者两者改变的比例不同,导致这些治疗可能不一定导致Ktrans值的变化。在这样的情况下,了解治疗后微血管参数的具体改变部分显得尤为重要。双输入2CXM模型可以分别评价PS和Fp,而双输入extended Tofts模型仅仅评价反映这2个参数指标的加权值—Ktrans,因此双输入2CXM模型较双输入extended Tofts模型更加有优势。
Kep是EES和血浆之间转移常数的回流率。本研究中2个双输入双室模型的Kep值无显著差异且具有相关性,均大于Ktrans或PS值。HCC作为富血供肿瘤,肿瘤内对比剂渗漏到EES增加,由于血流动力学进程,对比剂不仅渗漏到EES,而且随血浆流失,导致相对增大的Kep值。与Ktrans一样,Kep同样也是一个重要的预测标记,研究显示Kep降低与抗血管生成药物治疗的良好疗效相关[7]。
理论上,富血供肿瘤通常由较大血管空间(Vp)组成,表现为快速动脉期强化,随后流出,而乏血供肿瘤通常由较大间质空间(Ve)组成,显示为渐进性强化[9]。然而,本研究显示在双输入extended Tofts模型和双输入2CXM模型中Ve显著大于Vp。这个结果看似矛盾,原因可能是肿瘤血管内高血流量导致流体静水压力增高,对比剂进入EES导致细胞外间隙增加;HCC是恶性肿瘤,通常含相对大的EES;技术方面的原因同样可能产生影响。动物实验DCEMRI研究评估老鼠HCC显示在双输入extended Tofts模型中Ve显著大于Vp,笔者认为,Kep和Vp与Ve总量基本不变,Vp低估导致Ve高估,这种现象在Tofts模型更加明显,因为Vp没有被计算在内[22]。然而还需要更多研究阐明Ve和Vp间的确切关系。
本研究中,双输入2CXM模型中的Ve值显著大于双输入extended Tofts模型的Ve值且无相关性。笔者认为,引起这样的结果是由于应用于双输入2CXM模型的时间分辨率相对较低。双输入2CXM模型是比较复杂的模型,相对于双输入extended Tofts模型需要更高的时间分辨率[21]。本研究中,无论是双输入2CXM模型还是双输入extended Tofts模型,其时间分辨率都是6 s,这就可能导致Ve值在双输入2CXM模型被高估。
HCC肿瘤大小、分期与肿瘤微血管灌注和渗透性参数无显著相关性。笔者认为,其主要原因是在检测HCC微血管特性时,有意识地避开肿瘤的坏死,出血及脂肪变性区域,而这些病理改变通常与肿瘤的大小及分期有联系。
本研究存在一些缺陷:首先,测量观察的微血管参数无金标准对照。微血管灌注和渗透性参数是功能性指标,这些参数无法在体外组织标本中测量。本研究利用中晚期HCC血流方面的共识,即肿瘤由肝动脉和门静脉供血且相对高灌注作为参考标准。同时有18例肝癌患者依靠EASL标准诊断而未获得组织病理学确认,未对肿瘤进行分级以及未了解肿瘤周围肝硬化的程度。HCC肿瘤级别不同可能对肿瘤灌注和渗透性参数产生影响。到目前为止,大部分HCC微血管研究均未提及肿瘤分级与微血管特征的关系,笔者认为这方面领域非常值得研究。其次,本研究样本数相对较少,Ve和Vp的关系有待进一步研究来明确,需要大样本前瞻性研究证实、阐明。再次,本研究图像采集时间分辨率为6 s,这种分辨率可能对检测双输入2CXM模型的肿瘤间质参数Ve相对较低。最后,在图像采集期间采用自由呼吸模式,这种操作方法和患者心脏跳动导致运动伪影,但本研究利用3D非刚性校正已尽可能地减小运动伪影引起的图像质量影响。
本研究结果提示,双输入双室血流动力学模型可以反映中晚期HCC微血管特性;双输入extended Tofts模型在测量Ve时相对较稳定;考虑到中晚期HCC使用抗血管生成药物,TACE和射频治疗后的疗效评价,双输入2CXM模型可能比双血供extended Tofts模型更详细和准确,因为,双输入2CXM模型可以单独地评价Fp和PS指标。如果治疗后Fp和PS改变反向发展,单独测量Fp和PS显得尤为重要,因为extended Tofts模型只能测量Ktrans而非Fp和PS。然而,这种假设需要进一步比较中晚期HCC抗血管靶向药物或TACE治疗前后的血流动力学微血管参数才能被充分证明,这也是本课题组的相关研究目标。参考文献:
[1] CORONA-VILLALOBOS C P, HALAPPA V G, GESCHWIND J F, et al. Volumetric assessment of tumour response using functional MR imaging in patients with hepatocellular carcinoma treated with a combination of doxorubicin-eluting beads and sorafenib[J]. Eur Radiol, 2015, 25(2): 380-390.
[2] O’CONNOR J P, ROSE C J, JACKSON A, et al. DCE-MRI biomarkers of tumour heterogeneity predict CRC liver metastasis shrinkage following bevacizumab and FOLFOX-6[J]. Br J Cancer, 2011, 105(1): 139-145.
[3] TEO Q Q, THNG C H, KOH T S, et al. Dynamic contrast-enhanced magnetic resonance imaging: applications in oncology[J]. Clin Oncol, 2014, 26(10): e9-20.
[4] HIRASHIMA Y, YAMADA Y, TATEISHI U, et al. Pharmacokinetic parameters from 3-Tesla DCE-MRI as surrogate biomarkers of antitumor effects of bevacizumab plus FOLFIRI in colorectal cancer with liver metastasis[J]. Int J Cancer, 2012, 130(10): 2359-2365.
[5] DE BRUYNE S, VAN DAMME N, SMEETS P, et al. Value of DCE-MRI and FDG-PET/CT in the prediction of response to preoperative chemotherapy with bevacizumab for colorectal liver metastases[J]. Br J Cancer, 2012, 106(12): 1926-1933.
[6] JARNAGIN W R, SCHWARTZ L H, GULTEKIN D H, et al. Regional chemotherapy for unresectable primary liver cancer: results of a phase II clinical trial and assessment of DCEMRI as a biomarker of survival[J]. Ann Oncol, 2009, 20(9): 1589-1595.
[7] SAHANI D V, JIANG T, HAYANO K, et al. Magnetic resonance imaging biomarkers in hepatocellular carcinoma: association with response and circulating biomarkers after sunitinib therapy[J]. J Hematol Oncol, 2013, 6: 51.
[8] KHALIFA F, SOLIMAN A, EL-BAZ A, et al. Models and methods for analyzing DCE-MRI: A review[J]. Med Phys, 2014, 41(12): 124301.
[9] SOURBRON S P, BUCKLEY D L. Tracer kinetic modelling in MRI: estimating perfusion and capillary permeability[J]. Phys Med Biol, 2012, 57(2): R1-R33.
[10] THNG C H, KOH T S, COLLINS D J, et al. Perfusion magnetic resonance imaging of the liver[J]. World J Gastroenterol, 2010, 16(13): 1598-609.
[11] VAN BEERS B E, DAIRE J L, GARTEISER P. New imaging techniques for liver diseases[J]. J Hepatol, 2015, 62(3): 690-700.
[12] European Association For The Study Of The Liver, European Organisation For Research And Treatment Of Cancer. EASLEORTC clinical practice guidelines: management of hepatocellular carcinoma[J]. J Hepatol, 2012, 56(4): 908-943.
[13] DONALDSON S B, WEST C M, DAVIDSON S E, et al. A comparison of tracer kinetic models for T1-weighted dynamic contrast-enhanced MRI: application in carcinoma of the cervix[J]. Magn Reson Med, 2010, 63(3): 691-700.
[14] TOFTS P S. Modeling tracer kinetics in dynamic Gd-DTPA MR imaging[J]. J Magn Reson Imaging, 1997, 7(1): 91-101.
[15] BRUIX J, SHERMAN M, LLOVET J M, et al. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference[J]. J Hepatol, 2001, 35(3): 421-430.
[16] LLOVET J M, DI BISCEGLIE A M, BRUIX J, et al. Design and endpoints of clinical trials in hepatocellular carcinoma[J]. J Natl Cancer Inst, 2008, 100(10): 698-711.
[17] LEE S H, HAYANO K, ZHU A X, et al. Dynamic contrastenhanced MRI kinetic parameters as prognostic biomarkers for prediction of survival of patient with advanced hepatocellular carcinoma: A pilot comparative study[J]. Acad Radiol, 2015, 22(11): 1344-1360.
[18] CHIANDUSSI L, GRECO F, SARDI G, et al. Estimation of hepatic arterial and portal venous blood f ow by direct catheterization of the vena porta through the umbilical cord in man. Preliminary results[J]. Acta Hepatosplenol, 1968, 15 (3): 166-171.
[19] HAYASHI M, MATSUI O, UEDA K, et al. Progression to hypervascular hepatocellular carcinoma: correlation with intranodular blood supply evaluated with CT during intraarterial injection of contrast material[J]. Radiology, 2002, 225 (1): 143-149.
[20] TOFTS P S, BRIX G, BUCKLEY D L, et al. Estimating kinetic parameters from dynamic contrast-enhanced T(1)-weighted MRI of a diffusable tracer: standardized quantities and symbols[J]. J Magn Reson Imaging, 1999, 10(3): 223-232.
[21] BERGAMINO M, BONZANO L, LEVRERO F, et al. A review of technical aspects of T1-weighted dynamic contrastenhanced magnetic resonance imaging (DCE-MRI) in human brain tumors[J]. Phys Med, 2014, 30(6): 635-643.
[22] MICHOUX N, HUWART L, ABARCA-QUINONES J, et al. Transvascular and interstitial transport in rat hepatocellular carcinomas: dynamic contrast-enhanced MRI assessment with low- and high-molecular weight agents[J]. J Magn Reson Imaging, 2008, 28(4): 906-914.
(本文编辑:吴昔昔)
Applications of a dual-input pharmacokinetic model of dynamic contrast-enhanced MRI for evaluating tu-
morous microvascular properties in advanced hepatocellular carcinoma
ZHAO Zhigang, ZHAO Zhenhua,
YANG Jianfeng, ZHANG Yu, ZHAO Li, YANG Liming, WANG Ting, LU Zengxin. Department of Radiology, Shaoxing People’s Hospital, Shaoxing Hospital of Zhejiang University, Shaoxing, 312000
Objective:To investigate the feasibility of a dual-input two-compartment tracer kinetic model for evaluating tumorous microvascular properties in advanced hepatocellular carcinoma (HCC).Methods:From January 2014 to April 2015, pharmacokinetic parameters included transfer constant (Ktrans), plasma f ow (Fp), permeability surface area product (PS), eff ux rate constant (Kep), extravascular extracellular space volume ratio (ve), blood plasma volume ratio (vp), and hepatic perfusion index (HPI) were prospectively measured and analyzed using dual-input two-compartment tracer kinetic models included a dual-input extended Tofts model and a dualinput 2-compartment exchange model (2CXM) in 28 consecutive HCC patients. A paired Student’s t-test and a nonparametric paired Wilcoxon rank sum test were used to compare the equivalent pharmacokinetic parameters derived from the two models, and pearson correlation analysis was applied to observe the correlations among all equivalent parameters. The tumor size and pharmacokinetic parameters were tested by pearson correlation analysis, while correlations among stage, tumor size and all pharmacokinetic parameters were assessed by spearman correlation analysis.Results:The Fpvalue was greater than the PS value (Fp=1.07 mL/(mL•min), PS= 0.19 mL/(mL•min) in the dual-input 2CXM. HPI was 0.66 and 0.63 in the dual-input extended Tofts model and the dualinput 2CXM, respectively. There were no signif cant differences in the Kep, Vp, and HPI between the dual-input extended Tofts model and the dual-input 2CXM (P=0.524, P=0.569, P=0.622, respectively). Except for Ve, other equivalent pharmacokinetic parameters were correlated in the two dual-input two-compartment pharmacokinetic models; both Fpand PS in the dual-input 2CXM were correlated with Ktransderived from the dual-input extended Tofts model (r=0.566, P=0.002; r=0.570, P=0.002); Kep, Vp, and HPI between the two kinetic models were positive correlated (r=0.594, P=0.001; r=0.686, P=0.0001; r=0.391, P=0.004, respectively). In the dual input extended Tofts model, Vewas signif cantly less than in the dual input 2CXM (P=0.004), and no signif cant correlation was seen between the two tracer kinetic models (r=0.276, P=0.156). Neither tumor size nor tumor stage was signif cantly correlated with any of the pharmacokinetic parameters obtained from the two models (P>0.05).Conclusion:A dual-input two-compartment pharmacokinetic model can be used in assessing the microvascular physiopathological properties in the pretreatment of advanced HCC. The dual-input extended Tofts model may be more stable in measuring the Ve. However, the dual-input 2CXM may be more detailed and accurate in measuring microvascular permeability.
liver neoplasms; dynamic contrast-enhanced; magnetic resonance imaging; hemodynamics
R816.5
A
10.3969/j.issn.2095-9400.2017.02.004
2016-03-29
绍兴市科技局公益性技术应用项目(2015B70065);浙江省自然科学基金资助项目(LY16H180006);浙江省公益性计划项目(2014C33151);浙江省卫生厅平台骨干项目(2015RCA024);浙江省医药卫生一般研究计划项目(2014KYA215,2015KYB398,2015KYB403)。
赵志刚(1973-),男,浙江绍兴人,主治医师。
杨建峰,副主任医师,Email:yjfnjy2002@126.com。
