GSP分析仪筛查新生儿疾病的性能验证和应用*
2017-03-29王燕敏田国力周卓郭静许洪平姚静
王燕敏,田国力,周卓,郭静,许洪平,姚静
(上海市儿童医院新生儿筛查中心,上海 200040)
·产品应用研究·
GSP分析仪筛查新生儿疾病的性能验证和应用*
王燕敏,田国力,周卓,郭静,许洪平,姚静
(上海市儿童医院新生儿筛查中心,上海 200040)
目的 用全自动荧光免疫分析仪(Genetic Screening Processor,GSP)检测新生儿先天性甲状腺功能减低症(congenital hypothyroidism,CH)和先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)筛查的指标——促甲状腺激素(thyroid-stimulating hormone ,TSH)和17羟基孕酮(17-OH-progesterone ,17-OHP),评估GSP应用于临床的可行性。方法 检测美国疾病预防与控制中心(Centers for Disease Control and Prevention,CDC)的滤纸干血片标本和GSP配套试剂盒内质控品,计算GSP的正确度、精密度和线性;检测临床明确诊断的标本,TSH 1 012例(阳性60例,阴性952例)和17-OHP 991例(阳性34例,阴性957例),ROC曲线统计确定初始cut-off值,比对与临床诊断的一致性。结果 TSH和17OHP的批内不精密度分别为6.69%~12.6%和7.52%~9.29%,批间不精密度分别为6.91%~10.96%和6.86%~12.36%;偏移分别为-14.28%~-0.74%和-0.45%~12.54%;检测结果线性良好;初始cut-off值为23.43 U/mL(TSH)和21.42 ng/mL(17-OHP),敏感性为100%,特异性依次为98.11%和99.58%,与临床诊断结果一致性好。结论 GSP作为新生儿疾病筛查领域的首台全自动荧光免疫分析仪,满足实验室要求,可作为常规技术应用于CH和CAH的筛查。
GSP;新生儿疾病筛查;滤纸干血片;全自动检测
我国每年新生儿疾病筛查数量逐年增加,可筛查项目和病种不断更新,实验室集中化检测筛查亟需引进自动化设备以提高工作效率,确保筛查质量。新生儿疾病筛查全自动荧光免疫分析仪(Genetic Screening Processor,GSP)具有高通量的特性,实验过程可实现信息化和可追溯性。本研究用国内首台GSP检测我国当前仍采用传统手工操作的促甲状腺激素(thyroid-stimulating hormone,TSH)和17羟基孕酮(17-OH-progesterone,17-OHP),并与临床确诊新生儿先天性甲状腺功能减低症(congenital hypothyroidism,CH)和先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH)病例比对。
1 材料与方法
1.1 材料 滤纸干血片标本,分别来源于美国疾病预防与控制中心(Centers for Disease Control and Prevention,CDC)、GSP配套试剂盒质控品和临床明确诊断标本。每份标本取3 mm直径血斑。
1.2 仪器与试剂 2021型GSP,TSH测定试剂盒及17-OHP测定试剂盒(美国PerkinElmer公司)。
1.3 方法 为固相、双抗体免疫夹心荧光分析法。将铕示踪剂和抗血清贮存液等放入GSP试剂模块;用3 mm专用打孔钳将校准品、质控品和待测标本打入96孔微孔板中,微孔板上印有相应检测项目的条形码,读取条形码并将样本和质控品信息输入 GSP 工作站软件;将待测微孔板装载入GSP的进板模块,微孔板条形码朝外,上机自动检测;4 h后获得TSH和17-OHP检测结果。
1.4 方法学评价[1]
1.4.1 精密度 取CDC提供的高、中、低已知浓度标本,每份各测定20次,连续测定20 d,计算批内和批间变异系数(CV),1/3总误差(total error,TEa)为判定标准,TEa取美国CDC的室间质量评价(external quality assessment,EQA)最大允许误差。
1.4.2 正确度 取CDC提供的已知浓度标本,每份检测2次,重复测定15 d,计算平均值与靶值的偏移,以1/2TEa为判定标准。
1.4.3 线性测定 取试剂盒内高浓度质控品,用打孔钳取直径3 mm的血斑,分别取2、1、1/2、1/4、1/8个血斑制成系列浓度(理论值)标本,分析天平校正血斑质量,每个标本重复检测2次。以理论值为X,实测值均值为Y,计算回归方程和相关系数(r)。
1.5 临床应用 检测临床已明确诊断的标本,其中TSH 1 012例(阳性60例,阴性952例)和17-OHP 991例(阳性34例,阴性957例),计算诊断敏感性和特异性。
1.6 统计学分析 用Excel 2010以及SPSS 19.0软件进行数据处理及统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 精密度结果 TSH批内不精密度6.69%~12.6%,批间不精密度6.91%~10.96%;17-OHP批内不精密度7.52%~9.29%,批间不精密度6.86%~12.36%。两项检测指标的批内和批间精密度均小于1/3TEa。见表1。
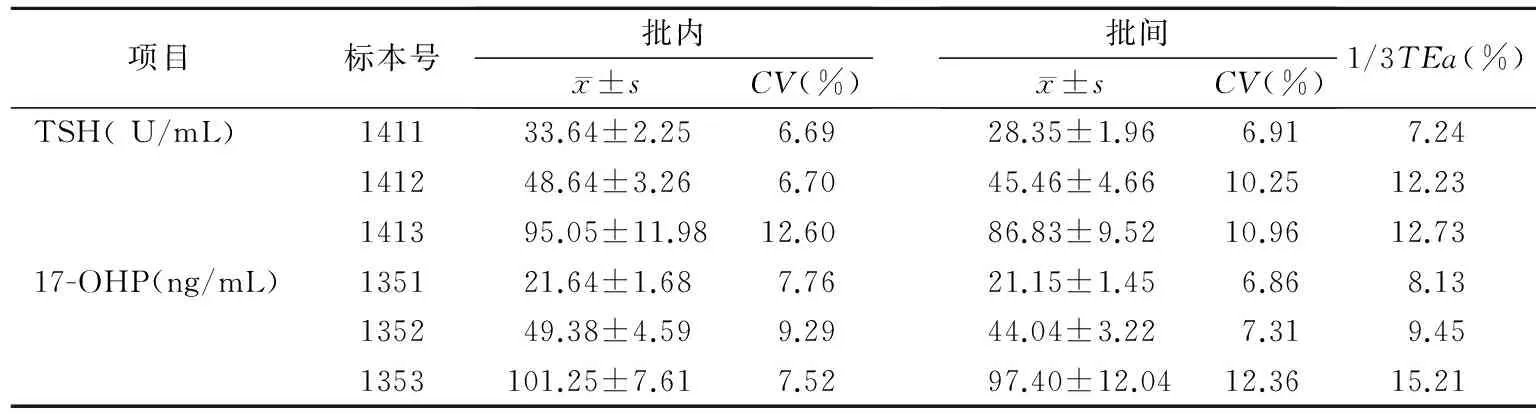
表1 TSH和17-OHP不精密度结果
2.2 正确度结果 检测结果与CDC提供的目标浓度比较,TSH偏移-14.28%~-0.74%;17-OHP偏移-0.45%~12.54%。两项指标的偏移均小于1/2TEa,见表2。
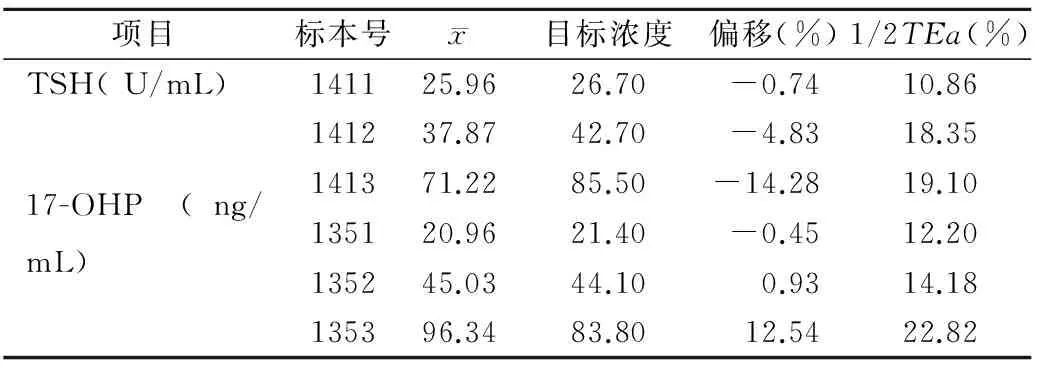
表2 TSH和17-OHP正确度结果
2.3 线性结果 以实测均值为Y,系列理论值为X,在TSH浓度范围(6.5~101 U/mL)内进行线性回归分析,TSH回归方程为Y= 0.834 9X+0.510 7,r=0.999 5;在17-OHP浓度范围(17.6~204 ng/mL)内进行线性回归,17-OHP回归方程为Y= 1.021 2X- 0.199 1,r=0.998;P均<0.01。实测均值与理论值高度相关,线性良好。
2.4 临床应用 检测临床已明确诊断标本,分别进行ROC曲线分析,获得初始cut-off值,TSH为23.43 U/mL,17-OHP为21.42 ng/mL。进一步临床判断,GSP检出78例TSH阳性结果,包括60例真阳性和18例假阳性,TSH筛查CH的敏感性为100%(60/60),特异性为98.11%(934/952);GSP检出38例17-OHP阳性结果,包括34例真阳性和4例假阳性,17-OHP筛查CAH的敏感性为100%(34/34),特异性为99.58%(953/957);与手工操作实验结果一致性检验的统计量Kappa值分别为0.86和0.94(P<0.001)。GSP分析结果与临床诊断一致性较好。
3 讨论
国内外新生儿疾病筛查一般采用集中检测模式。2015年,我国222家筛查实验室筛查全国1 500多万新生儿,筛查率超过90%[2]。大规模标本集中化检测需要建立自动化高通量检测技术,而目前大部分筛查中心多以手工法为主,实验操作步骤多,时间长,易影响筛查质量。GSP是新生儿疾病筛查领域的首台真正的全自动荧光免疫分析仪,标本打孔至96孔微孔板后,从微孔板装载至检测完成的所有步骤,包括加样、振荡孵育、移液、检测、数据收集等均实现全自动化。虽然不同检测项目一个实验周期需要1~4 h,但该仪器在运行状态下可随时加载微孔板,连续进样[3]。若以国内新生儿筛查最多见的4项疾病检测的4个指标(TSH、17-OHP、苯丙氨酸、葡萄糖6磷酸脱氢酶)检测为例,每个指标检测4块96孔板,单人操作16块板运行时间仅需6.5 h,相较于现行手工法,减少了实验人员和操作步骤,节省了12 h,提高了筛查效率,特别适合新生儿筛查实验室大通量检测。
CH和CAH是小儿内分泌常见疾病。据统计,全国范围内CH发病率为1/2 468[4],CAH发病率为1/10 000~1/20 000[5]。我国30个省市均不同程度地开展了新生儿CH和CAH筛查,大多采用时间分辨荧光免疫法检测疾病指标TSH和17-OHP[6]。该法用具有独特荧光特性的镧系螯合标记物铕,其荧光有很长的衰退时间和特别大的斯托斯位移(Stock′s)2个重要特性,可在本底荧光已完全衰退的延迟时间后被测定,克服了一般荧光免疫法背景太强的缺点,提高检测敏感性。GSP也是采用该原理检测临床已明确诊断标本,可检出所有阳性标本,敏感性为100%,特异性分别为98.11%和99.58%,表明采用GSP检测相关指标可避免漏诊患儿,假阳性低。Kappa检验提示GSP的分析结果与常规的手工法检测结果具有良好的一致性,ROC曲线统计得到的cut-off值TSH 23.43 U/mL,17-OHP 21.42 ng/mL与全国筛查实验室应用的cut-off值相似[7-8]。
由于滤纸干血片血液含量少,基质成分复杂,影响检测的敏感性和特异性[9],据美国CDC 2015年统计[10],近500家筛查实验室的TSH干血片检测不精密度3.41%~45.55%,偏移2.80%~36.4%;17-OHP干血片检测不精密度8.43%~39.4%,偏移3.2%~27.4%。本研究中GSP检测TSH和17-OHP,批内不精密度分别为6.69%~12.6%和7.52%~9.29%,批间不精密度分别为6.91%~10.96%和6.86%~12.36%,两项检测指标的批内和批间精密度均小于1/3TEa。TSH偏移-14.28%~-0.74%间,17-OHP偏移-0.45%~12.54%,两项指标的偏移均小于1/2TEa。但无论是精密度和偏移,两个项目高值均超过10%,而低值(cut-off值附近)不精密度小于7%,偏移小于1%,提示GSP在低浓度的检测结果更好,这符合CH和CAH筛查阳性判断标准,即对高于cut-off值的小儿均需召回,重新采集血清标本检测以明确诊断,而不能以筛查实验的检测结果作为最终诊断依据。
[1]康凤凤,王治国. ISO 15189:2012与临床检验定量检测方法确认和性能验证[J].临床检验杂志,2013,31(12):881-884.
[2]国家卫生计生委妇幼健康服务司.全国妇幼卫生信息分析报告[R].2016,130-142.
[3]Fingerhut R,Torresani T.Evaluation of the genetic screening processor(GSPTM)for newborn screening[J].Anal Methods,2013,18(5):4769-4776.
[4]中华预防医学会出生缺陷预防与控制专业委员会新生儿筛查学组,中国医师协会青春期医学专业委员会临床遗传学组,中华医学会儿科学分会内分泌遗传代谢学组.先天性肾上腺皮质增生症新生儿筛查共识[J].中华儿科杂志,2016,54(6):404-409.
[5]Gidlof S,WedelI A,Guthenberg C,etal.Nationwide neonatal screening for congenital adrenal hyperplasia in sweden a 26-year longitudinal prospective population--based study[J].JAMA Pediatr,2014,168(6): 567-574.
[6]田国力,朱伟明,王燕敏,等.新生儿先天性肾上腺皮质增生症筛查的初步报告[J].检验医学,2010,25(2):86-88.
[7]钟堃,王治国,王薇,等.全国2009年新生儿遗传代谢病筛查项目切值分析[J]. 中国儿童保健杂志,2010,18(12):982-984.
[8]Sharma R,Seth A.Congenital adrenal hyperplasia:issues in diagnosis and treatment in children[J].Indian J Pediatr,2014,81(2):178-185.
[9]段义飞,崔亚利,江咏梅.干血斑用于新生儿遗传代谢病筛查的方法学进展[J].中华检验医学杂志,2015,38(4):220-222.
[10]Centers for Disease Control and Prevention. Newborn screening quality assurance program,2015 annual summary report[R].Atlanta: 2016.
(本文编辑:王海燕)
Objective To evaluate the feasibility of PerkinElmer Genetic Screening Processor(GSP) in the application of newborn screening for congenital hypothyroidism(CH) and congenital adrenal hyperplasia(CAH) by detecting thyroid-stimulating hormone(TSH) and 17-OH-progesterone(17-OHP). Methods The dried-blood spots specimens from Centers for Disease Control and Prevention(CDC) and the quality control in the reagent kit were detected and the accuracy, precision and linearity were calculated. A total of 1 012 samples of TSH(60 of positive and 952 negative samples) and 991 samples of 17-OHP(34 positive and 957 negative samples) were detected. The initial cut-off value was determined by ROC curve determined. The consistency between the results from GSP and clinical diagnosis was analyzed. Results The average of within-run coefficient of variation(CV) of TSH and 17-OHP were 6.69% to 12.6% and 7.52% to 9.29%, and the average of between-runCVwere 6.91% to 10.96% and 6.86% to 12.36%, respectively. The average of bias of TSH and 17OHP were -14.28% to -0.74% and -0.45% to 12.54%. The linearity of GSP detection was fine. The initial cut-off values were 23.43 U/mL(TSH) and 21.42 ng/mL(17-OHP). The sensitivity of GSP detection was 100% and the specificity of TSH and 17-OHP were 98.11% and 99.58% respectively. The results of GSP detection showed good consistency with clinical diagnosis. Conclusion As the first real automatic fluorescence immunoassay analyzer, GSP could be used in routine clinical diagnosis for CH and CAH.
genetic screening processor(GSP); neonatal screening; dried-blood spot; full automated detection
10.13602/j.cnki.jcls.2017.02.20
上海市第四轮公共卫生三年行动计划重点学科建设项目(15GWZK0401);上海交通大学多学科交叉项目(YG2015QN27)。
王燕敏, 1982年生,女,技师,大学本科,主要从事新生儿遗传代谢病筛查工作。
田国力,主任技师,主要从事新生儿遗传代谢病研究和咨询工作,E-mail:shscreening@126.com。
R446;R722.11
A
2016-11-04)
Verification and application of genetic screening processor(GSP) for neonatal screening
WANGYan-min,TIANGuo-li,ZHOUZhuo,GUOJing,XUHong-ping,YAOJing(NewbornScreeningCenterofShanghaiChildren′sHospital,Shanghai200040,China)
