大豆炭疽病菌Colletotrichumchlorophyti的鉴定
2017-03-29李海云张学勤范光辉张建新许艳霞
李海云, 靳 帅, 张学勤, 范光辉, 张建新, 许艳霞
(河北出入境检验检疫局京唐港办事处, 唐山 063611)
大豆炭疽病菌Colletotrichumchlorophyti的鉴定
李海云*, 靳 帅, 张学勤, 范光辉, 张建新, 许艳霞
(河北出入境检验检疫局京唐港办事处, 唐山 063611)
从进口的乌拉圭大豆的残留茎秆上分离到一种新的大豆炭疽病菌,根据菌落形态、分生孢子形态、ITS序列及ACT序列特征以及对大豆的致病性,将其鉴定为Colletotrichumchlorophyti,这是我国口岸首次截获该菌。
大豆; 炭疽病菌; 分离; 鉴定
炭疽菌ColletotrichumCorda是重要的世界性植物病原真菌。由该属一些种引起的大豆炭疽病在巴西、印度、南美及中国台湾及内地普遍发生,导致大豆减产16%~100%[1-3]。该病从苗期至收获期均可发病,苗期引起大豆死苗,成株期可危害茎秆、豆荚,导致大豆品质变劣,产量下降。据报道,能够引起大豆炭疽病的病原菌有平头炭疽菌C.truncatum、毁灭炭疽菌C.destructivum、毛核炭疽菌C.coccodes、胶孢炭疽菌C.gloeosporioides及禾谷炭疽菌C.graminicola[4-6]。美国科学家于2009年从阿拉巴马州、伊利诺伊州及密西西比州大豆叶柄中首次分离得到C.chlorophyti,2012年报道该菌侵染大豆,引起大豆炭疽病,随后2013年发现该菌可以侵染大豆种子[7-8]。但目前国内尚未有该菌分布的报道,口岸亦没有相关截获报道。
2015年9月,我们在对进境乌拉圭大豆进行检疫时,发现类似炭疽病症状的豆秆,经实验室分离培养、形态和分子特征鉴定及致病性测定,确认该菌为Colletotrichumchlorophyti,这是我国首次截获并报道该病菌。
1 材料与方法
1.1 病原菌的分离
从乌拉圭进境大豆中,选取有病斑或表面带小黑点等可疑症状的茎秆及豆荚,1.25%次氯酸钠表面消毒10 min,无菌水洗3 次,置于PDA 平板上,25℃、12 h光暗交替培养,3 d后观察豆荚、茎秆周围是否有菌落产生,并将菌丝移入新的PDA培养基上进行纯化培养。
1.2 分离物鉴定
1.2.1 形态鉴定
将病菌分离物置于PDA培养基上,25℃培养3 d后观察菌落形状及色泽,取菌丝制片观察和成像。显微镜下观察记录厚垣孢子和分生孢子形态特征。
1.2.2 分子鉴定
将病菌分离物菌丝块移至PDA上,25℃培养7 d后收集菌丝,液氮冷冻后研磨。取0.1 g菌丝粉用植物基因组提取试剂盒(Tiangen BioTech)提取DNA。用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)/ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ACT512F(5′-ATGTGCAAGGCCGGTTTCGC-3′)/ACT783R(5′-TA-CGAGTCCTTCTGGCCCAT-3′)[9]分别扩增 ITS和ACT基因序列。PCR反应总体积为50 μL:25 μLTaqPCR Mastermix(Tiangen BioTech),1 μL上游引物(10 μmol/L),1 μL下游引物(10 μmol/L),2 μL模板DNA,加水至50 μL。反应循环程序为:94℃ 4 min;94℃ 30 s,55℃ 30 s,72℃ 1 min,35个循环;最后 72℃ 10 min。取 5 μL扩增产物进行1.5%琼脂糖凝胶电泳,用凝胶成像系统分析。PCR产物送北京金唯智生物科技有限公司测序,所得序列经核实后,去除引物序列在GenBank中进行BLAST分析。将获得序列与GenBank中其他炭疽菌属相关序列,用MEGA 5.0程序进行比对,采用邻接法(neighbor-joining,NJ)构建系统进化发育树,进行1 000次重复抽样计算各节点的置信度。
1.3 致病性测定
1.3.1 茎秆伤口接种
取乌拉圭进口转基因大豆种子(GTS40-3-2品系及MON87701×89788品系)种植于营养土中,25℃光照条件下培养4周备用。在菌龄1周的培养皿中加入5 mL灭菌水,振荡,获得浓度约为107cfu/mL的分生孢子悬浮液。在大豆幼苗下胚轴划一伤口,针刺接种分生孢子悬浮液,3次重复,每次至少接种5株幼苗,从无菌水作对照接种,接种后置于密封塑料袋中25℃保湿培养1 d,1~2周内观察记录发病症状。
1.3.2 叶片伤口接种
取健康大豆种子‘中黄13’种植于营养土中,25℃光照条件下培养4周备用。在菌龄1周的培养皿中加入5 mL灭菌水,获得浓度约为107cfu/mL的分生孢子悬浮液。采用针刺法接种幼叶,重复3次,每次至少接种5株幼苗,25℃保湿培养1 d,1~2周内观察记录发病症状,对照用无菌水接种。1~2周后将接菌的茎秆和叶片经表面消毒后再分离病菌。
2 结果与分析
2.1 病原菌形态鉴定
在PDA培养基上,分离物菌落圆形,气生菌丝毡状或绒状,紧贴培养基生长,菌落边缘整齐,呈灰白色,培养3 d后菌丝开始变黑,10 d后黑色菌落满皿(图1a~b)。培养3 d后开始产生厚垣孢子,厚垣孢子单生或串生于菌丝顶端或中间,黄褐色至黑褐色,多数球形,光滑,大小(平均)7.5 μm×7.5 μm。分生孢子单胞,无色,新月形或镰刀状,一端尖锐,另一端较钝,大小(平均)19 μm×4.8 μm(图1c~d),无附着胞产生。
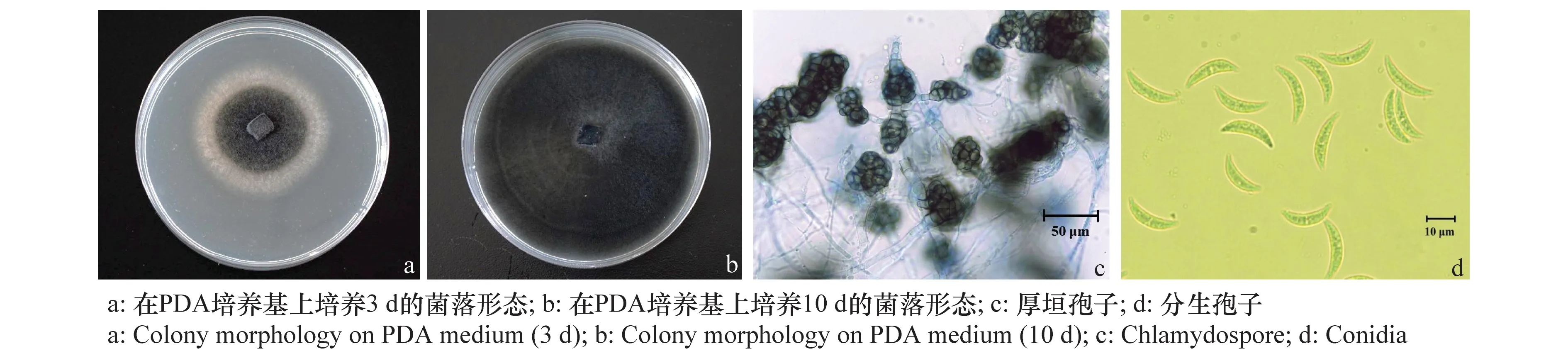
图1 Colletotrichum chlorophyti分离物形态特征Fig.1 Morphology of Colletotrichum chlorophyti
2.2 分子生物学鉴定
2.2.1 ITS序列分析
利用rDNA-ITS通用引物ITS1/ITS4对分离物基因组DNA进行PCR扩增,通过1.5%的琼脂糖凝胶电泳进行检测,PCR产物送北京金唯智生物科技有限公司测序,获得538 bp序列 (GenBank登录号:KU594267)。将序列在NCBI网站进行Blastn比对分析,发现序列与Colletotrichumchlorophyti(KT207464,KR052084,KC790962,JX126475,KC110786,NR_111460,GU227894和GU227895)的序列相似性为100%。与C.truncatum(DQ195714和DQ195715)的序列相似性为100%,与C.phaseolorum(NR_119771和GU227896)的序列相似性为99.21%,与C.metake(AB738859)的序列相似性为99.92%,说明分离物与C.chlorophyti和C.truncatum的亲缘关系较近。
2.2.2 ACT序列分析
为进一步明确分离物的种群分类地位,以actin为内参基因进行序列分析。采用引物ACT512F/ACT783R对分离物基因组DNA进行PCR扩增及测序,获得215 bp序列(GenBank登录号:KU985441),并进行BLAST分析。结果表明,分离物与GenBank中C.chlorophyti(KC110822,JX126476,GU227993和GU227992)序列相似性为99.03%~100%,与C.phaseolorum(GU227994和GU227995)的序列相似性为88.52%~89.52%,与C.truncatum(GU227960)的序列相似性为71.90%。采用MAGA 5.0软件进行系统发育关系分析,发现分离物与C.chlorophyti在一个分支,且Bootstrap支持率为100%(图2)。
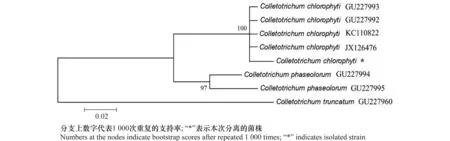
图2 基于ACT序列采用NJ法构建的系统发育树Fig.2 A phylogenetic tree resulted from analysis of the ACT sequences by using the NJ method
2.3 致病性测定
将分离物接种大豆幼苗均可使植株发病,发病率为100%。接菌幼苗茎秆2周后,接种处产生溃疡斑,对照植株除接种处变褐外,无溃疡斑(图3a)。针刺接种叶片5 d后,在接种处产生明显的坏死斑,病斑周围深褐色,中央浅褐色,对照叶片仅接种处有伤口,未变色(图3b)。根据柯赫氏法则,对发病植株和对照株进行病原菌分离,所有发病部位均分离得到与接种菌菌落形态一致的分离物,而对照植株上没分离到接种菌(图3c)。

图3 病原分离物的致病性测定Fig.3 Pathogenicity test of pathogenic isolate
通过病原菌的形态学鉴定、致病性测定和分子生物学分析结果,我们将分离物鉴定为C.chlorophyti。
3 讨论
自2012年,Yang等首次报道C.chlorophyti能够侵染大豆[7],引起大豆炭疽病以来,我国口岸尚没有该菌的截获报道。本研究对进境大豆茎秆上的病菌分离物进行鉴定,结果发现该分离物与C.chlorophyti一致。
传统的炭疽菌属分类主要依靠形态学特征,包括分生孢子和附着胞的大小和形状,刚毛和菌核的有无,菌落颜色,生长速度,培养条件等[4,10]。然而,在环境影响下,炭疽菌属真菌在形态及表型上存在差异,形态学特征并不能充分区别各菌种。随着分子生物学的发展,免疫学方法、随机扩增DNA多态性(randomly amplified polymorphic DNAs,RAPDs)、rDNA-ITS技术等已经广泛用于炭疽菌的鉴定。然而,采用真菌公认的DNA条形码基因核糖体内转录间隔区(internal transcribed spacer,ITS)不能充分地区分炭疽菌属内各物种,目前,actin(ACT)、β-tubulin(TUB2)、calmodulin(CAL)、glyceraldehyde-3-phosphate dehydrogenase(GPDH)及rDNA-ITS(ITS)5对基因已用于炭疽菌属的种群鉴定[11]。本研究中选取ITS和ACT两个基因进行分子鉴定,结果显示ITS序列不能有效区分C.chlorophyti和C.truncatum,在ACT序列的聚类图中,分离菌与C.chlorophyti在一个分支上,且自展支持率为100%。因此,综合形态及分子鉴定结果,可以确定该分离物为C.chlorophyti。
迄今,大豆炭疽病的病原菌报道最多的是C.truncatum,而多个炭疽菌种通常可以侵染同一寄主[12],因此,每种病菌的致病作用不可忽视。目前,国内外对C.chlorophyti的研究报道极少,仅有该菌侵染大豆及其qPCR分子检测方面的报道。我国是重要的大豆进口国,病害随进口传播与扩散的风险极高, 因此,下一步将对大豆炭疽病菌C.chlorophyti的生物学特性、致病性分化、快速检测及有效防治等进行详细研究,为该菌的检疫及病害防治提供理论指导。
[1] Backman P A,Williams J C,Crawford M A.Yield losses in soybeans from anthracnose caused byColletotrichumtruncatum[J].Plant Disease,1982,66:1032-1034.
[2] Manandhar J B,Hartman G L.Anthracnose [M]∥Hartman G L,Sinclair J B,Rupe J C.Compendium of soybean diseases.St.Paul,MN:APS Press,1999:13-14.
[3] Wrather J A,Koenning S R.Estimates of disease effects on soybean yields in the United States 2003 to 2005 [J].Journal of Nematology,2006,38(2):173-180.
[4] Tiffany L H, Gilman J C.Species ofColletotrichumfrom legumes [J]. Mycologia, 1954, 46(1):52-75.
[5] Roy K W. Seedling diseases caused in soybean by species ofColletotrichumandGlomerella[J]. Phytopathology, 1982, 72(8):1093-1096.
[6] Manandhar J B, Hartman G L, Sinclair B.Colletotrichumdestructivum, the anamorph ofGlomerellaglycines[J]. Phytopathology, 1986, 76(3):282-285.
[7] Yang H C, Haudenshield J S, Hartman G L. First report ofColletotrichumchlorophyticausing soybean anthracnose[J]. Plant Disease, 2012, 96(11):1699.
[8] Yang H C, Stewart J M, Hartman G L. First report ofColletotrichumchlorophytiinfecting soybean seed in Arkansas, United States [J]. Plant Disease, 2013, 97(11):1510.
[9] Carbone I, Kohn L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999, 91(3): 553-556.
[10]Sutton B C.The genusGlomerellaand its anamorphColletotrichum[M]∥Bailey J A,Jeger M J.Colletotrichum: biology,pathology and control.CABI,1992:1-26.
[11]Damm U, Liu F, Cannon P F, et al. Unraveling legume anthracnose pathogens [J]. Phytopathology, 2013, 103: 33.
[12]陈吴健. 大豆豆荚炭疽病的病原鉴定及其防治[D]. 杭州: 浙江大学, 2007.
(责任编辑:杨明丽)
Identification ofColletotrichumchlorophyticausing soybean anthracnose
Li Haiyun, Jin Shuai, Zhang Xueqin, Fan Guanghui, Zhang Jianxin, Xu Yanxia
(JingtangPortOfficeofHebeiEntry-ExitInspectionandQuarantineBureau,Tangshan063611,China)
The pathogenic fungus isolated from soybean imported from Uruguay was identified asColletotrichumchlorophytibased on the morphological characteristics of the colony and conidia of the fungus, rDNA-ITS and partial sequence of the actin gene, and its pathogenicity to soybean. It was the first report thatColletotrichumchlorophytiwas imported to China.
soybean;Colletotrichumchlorophyti; isolation; identification
2016-03-28
2016-05-13
S 41-30
A
10.3969/j.issn.0529-1542.2017.02.028
致 谢: 本研究得到上海出入境检验检疫局动植物与食品检验检疫技术中心易建平研究员的悉心指导与大力帮助,特此致谢。
* 通信作者 E-mail:yousliyun@163.com
