柑橘绿霉病菌中多聚半乳糖醛酸酶基因(PdPG2)的表达分析
2017-03-29由书妍于瑞君刘红霞李红叶
由书妍, 于瑞君, 刘红霞, 李红叶
(1. 大连市农业科学研究院, 大连 116036; 2. 浙江大学农业与生物技术学院, 杭州 310058)
柑橘绿霉病菌中多聚半乳糖醛酸酶基因(PdPG2)的表达分析
由书妍1, 于瑞君1, 刘红霞1, 李红叶2*
(1. 大连市农业科学研究院, 大连 116036; 2. 浙江大学农业与生物技术学院, 杭州 310058)
柑橘绿霉病菌Penicilliumdigitatum是储藏期柑橘腐烂病最主要的病原之一,严重影响柑橘产业的发展。已有研究表明,柑橘绿霉病菌中多聚半乳糖醛酸酶(PdPG2)对其致病性有重要作用,PdPG2基因功能缺失突变株的致病性会下降,然而有关PdPG2基因的表达研究尚不完善。本文研究了PdPG2基因在不同条件下的表达情况,结果表明PdPG2是酸性表达基因,其表达量随着pH的升高而降低,pH为3.0时其表达量为对照条件下的10倍,pH为8.0时其表达量为对照条件下的0.36倍。柑橘果胶能够诱导PdPG2的表达,其表达量为对照的3.6倍。因此,在侵染过程中PdPG2表达的升高是由于发病部位酸化以及橘皮降解物诱导共同引起的。
柑橘绿霉病菌; 多聚半乳糖醛酸酶; 基因表达
柑橘绿霉病菌引起的柑橘腐烂病是贮藏期柑橘的主要病害之一,其造成的损失通常占所有损失的90%以上,严重影响了我国柑橘的经济效益[1-2]。柑橘绿霉病菌不形成特定的侵染结构,主要通过采摘等农事操作形成的伤口侵入。在侵入寄主的过程中,细胞壁水解酶起到了重要的作用[3-4]。目前,关于细胞壁水解酶对病原菌致病性的作用在许多真菌中都有报道,在灰葡萄孢Botrytiscinerea中,内切多聚半乳糖醛酸酶基因缺失突变株对番茄的致病性降低[5],果胶甲酯酶基因缺失突变株对几种作物的致病性均有所下降[6];紫麦角菌Clavicepspurpurea中,两个多聚半乳糖醛酸酶基因缺失突变株对黑麦花组织致病性严重下降[7];在黄曲霉Aspergillusflavus中,内切多聚半乳糖醛酸酶基因缺失突变株对棉铃的致病性降低[8];在红球丛赤壳Nectriahematococca中,果胶裂解酶A及果胶裂解酶D同时缺失其致病性降低,而单一突变其中任何一个基因都对致病性没有影响[9];在胶孢炭疽菌Colletotrichumgloeosporioides中,果胶裂解酶基因缺失突变株的致病性下降[10-11],可见细胞壁水解酶对病原菌的致病性有重要意义。
研究表明柑橘绿霉病菌中多聚半乳糖醛酸酶基因(PdPG2)对其致病性有重要的作用[12],该基因编码378个氨基酸,属于内切多聚半乳糖醛酸酶(endo-PG,EC 3.2.1.15)。目前,关于PdPG2表达模式尚不清楚,本试验对柑橘绿霉病菌PdPG2基因的表达进行研究,以探究该基因在侵染过程中表达量变化的原因,增加对柑橘绿霉病菌致病性分子机制的了解。
1 材料与方法
1.1 材料
柑橘绿霉病菌菌株Pd01(CBS 130525)由本实验室从浙江衢州发生腐烂病的柑橘上分离[13],保存于本实验室;本试验使用的引物为自己设计(表1),由上海桑尼生物科技有限公司合成,其中PdPG2的扩增片段为184 bp,Actin的扩增片段为218 bp。
表1 本试验所用引物
Table 1 Primers for this study
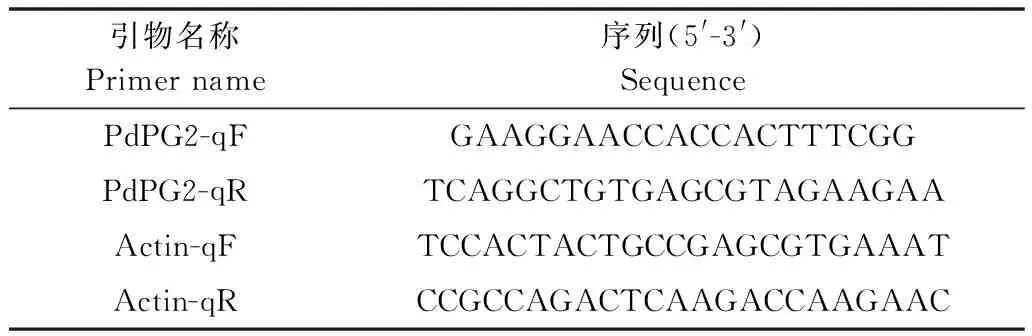
引物名称Primername序列(5'-3')SequencePdPG2-qFGAAGGAACCACCACTTTCGGPdPG2-qRTCAGGCTGTGAGCGTAGAAGAAActin-qFTCCACTACTGCCGAGCGTGAAATActin-qRCCGCCAGACTCAAGACCAAGAAC
1.2 方法
1.2.1PdPG2在侵染过程中的相对表达量分析
从市场上购买成熟蜜橘Citrusnobilis果实,在次氯酸中浸泡10 min后用无菌水冲洗并吹干备用。将PDA培养基上培养7 d的野生型菌株Pd01孢子用双蒸水洗脱,配制成1.0×106个/mL的孢子悬浮液。在蜜橘果实上用针簇(5根针围成)刺1个1~2 mm深的伤口,取3 μL孢子悬浮液接种到伤口上,于25℃保湿培养,每组试验3个重复,分别在接种后12、24、48和96 h采用AxyPrepTMmultisource total RNA miniprep kit(Xygen,杭州)提取病斑组织的总RNA,并利用RNA PCR (AMV) 3.0 kit(TaKaRa,大连)反转录成cDNA。以cDNA为模板,PdPG2-qF/PdPG2-qR为引物,采用SYBR Premix ExTaqTM(Perfect Real Time)试剂盒配制PCR 反应液,随后在7300 Real-time PCR系统(ABI,美国)上完成PCR反应。PCR反应以γ-Actin基因(GenBank, AB030227)为内参,相对表达量的计算方法参考文献[14]。
1.2.2 果胶对PdPG2相对表达量的影响
柑橘绿霉病菌的野生型菌株孢子悬浮液制作方法同1.2.1,吸取10 μL孢子悬浮液到50 mL PDB中培养3 d,过滤菌丝并用无菌水冲洗3次,将菌丝转入以果胶为单一碳源的SM培养基中继续培养60 h,按1.2.1的方法提取菌丝总RNA,测定PdPG2的相对表达量,以相同条件下,用葡萄糖为单一碳源的SM培养基培养的菌丝为对照。
1.2.3PdPG2在不同pH条件下的相对表达量
按1.2.2的方法收集在PDB中培养3 d的菌丝,将菌丝转入pH分别为3.0、4.0、5.0、6.0、7.0 和8.0的PDB中继续培养12 h,pH用磷酸柠檬酸缓冲液调节。按1.2.1的方法提取总RNA,测定PdPG2的相对表达量。
2 结果与分析
2.1PdPG2在侵染过程中的相对表达量
在柑橘发病过程中,PdPG2的表达如图1所示,在侵染发病24 h后,PdPG2的相对表达量升高,为对照条件下的10倍,在侵染发病48 h后为对照条件下的14倍,在侵染发病72 h后,PdPG2的相对表达量最高,为对照条件下的18倍,在侵染发病96 h后,PdPG2的表达降低。这些结果表明PdPG2基因在侵染发病的过程中迅速升高,对致病性起到了重要的作用。
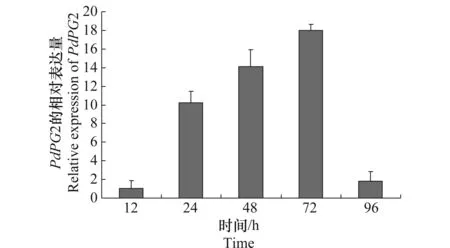
图1 在侵染柑橘过程中PdPG2基因的表达Fig.1 Expression of PdPG2 during infection
2.2 果胶对PdPG2相对表达量的影响
试验结果(图2)表明,柑橘绿霉病菌野生型菌株Pd01在含果胶的培养基中培养60 h之后,PdPG2的相对表达量明显升高,其表达量为对照条件下的3.6倍,可见果胶能够诱导PdPG2的表达。
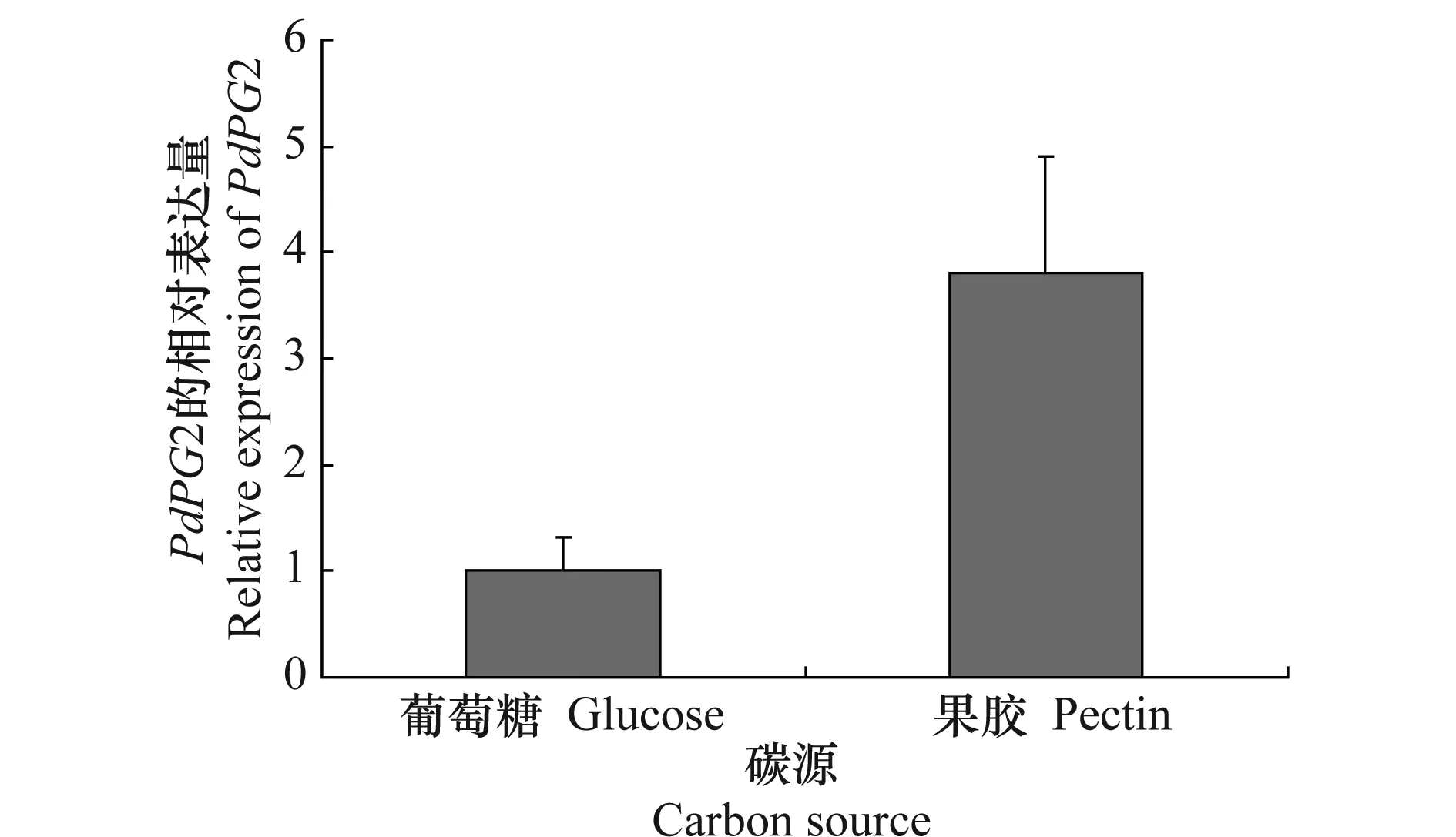
图2 不同碳源下PdPG2的表达Fig.2 Expression of PdPG2 under different carbon source
2.3 不同pH条件对PdPG2表达的影响
PdPG2的表达与环境pH相关,在酸性的条件下,PdPG2的表达明显升高,在pH为3.0时其表达量为对照条件下的10倍,而在pH为8.0时其表达量为对照条件下的0.36倍(图3),表明PdPG2的表达依赖于外界环境的酸性条件。
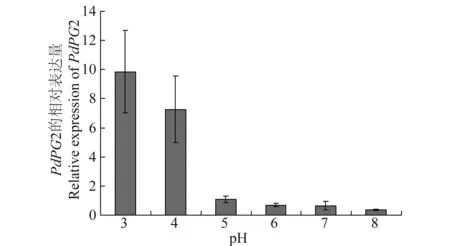
图3 PdPG2基因在不同pH条件下的表达Fig.3 Expression of PdPG2 at different pH values
3 讨论
柑橘绿霉病菌P.digitatum引起的柑橘腐烂病是贮藏期柑橘最重要的病害,给柑橘产业造成了严重的损失。研究柑橘绿霉病菌致病的分子机制,有助于增加对柑橘绿霉病菌防控的理论基础。
本研究对PdPG2的表达模式进行研究,在侵染过程中PdPG2的表达呈现出先升高后下降的趋势,表明在侵染过程中PdPG2起到了重要的作用。PdPG2的表达依赖于环境的酸性条件,在侵染的过程中,发病部位的pH会降低,特别是在接种后48 h内[12],而这段时期也正是PdPG2相对表达量升高的时期,可见在柑橘绿霉病菌侵染过程中的酸化有利于PdPG2的表达,从而提高原菌的致病性。PdPG2是一个诱导表达的基因,本试验发现果胶也能够诱导PdPG2的表达,果胶是柑橘果皮的重要组成成分[15],因此接种后PdPG2表达量的提高可能与发病部位的果皮降解物相关。在侵染过程中,PdPG2的表达呈现先升高后下降,而在接种后第48 h pH最低,此后,发病部位的pH基本不变[12],而PdPG2的表达却继续升高,因此我们推测橘皮果胶在诱导过程中也起了重要的作用。
[1] Kanetis L, Förster H, Adaskaveg J E. Comparative efficacy of the new postharvest fungicides azoxystrobin, fludioxonil, and pyrimethanil for managing citrus green mold[J]. Plant Disease, 2007, 91(11): 1502-1511.
[2] Macarisin D, Cohen L, Eick A, et al.Penicilliumdigitatumsuppresses production of hydrogen peroxide in host tissue during infection of citrus fruit [J]. Pathology, 2007, 97(11): 1491-1500.
[3] Annis S L, Goodwin P H. Recent advances in the molecular genetics of plant cell wall-degrading enzymes produced by plant pathogenic fungi[J]. European Journal of Plant Pathology, 1997, 103(1): 1-14.
[4] Collmer A, Keen N T. The role of pectic enzymes in plant pathogenesis[J]. Annual Review of Phytopathology, 1986, 24: 383-409.
[5] ten Have A, Mulder W, Visser J, et al. The endopolygalacturonase geneBcpg1 is required for full virulence ofBotrytiscinerea[J]. Molecular Plant-Microbe Interactions, 1998, 11(10): 1009-1016.
[6] Valette-Collet O, Cimerman A, Reignault P, et al. Disruption ofBotrytiscinereapectin methylesterase geneBcpme1 reduces virulence on several host plants[J]. Molecular Plant-Microbe Interactions, 2003, 16(4): 360-367.
[7] Oeser B, Heidrich P M, Müller U, et al. Polygalacturonase is a pathogenicity factor in theClavicepspurpurea/rye interaction [J]. Fungal Genetics and Biology, 2002, 36(3): 176-186.[8] Shieh M T, Brown R L, Whitehead M P, et al. Molecular genetic evidence for the involvement of a specific polygalacturonase, P2c, in the invasion and spread ofAspergillusflavusin cotton bolls[J]. Applied and Environmental Microbiology, 1997, 63(9): 3548-3552.
[9] Rogers L M, Yeon-Ki Kim Y K, Guo Wenjin, et al. Requirement for either a host-or pectin-induced pectate lyase for infection ofPisumsativumbyNectriahematococca[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(17): 9813-9818.
[10]Yakoby N, Beno-Moualem D, Keen N T, et al.ColletotrichumgloeosporioidespelBis an important virulence factor in avocado fruit-fungus interaction[J]. Molecular Plant-Microbe Interactions, 2001, 14(8): 988-995.
[11]Yakoby N, Freeman S, Dinoor A, et al. Expression of pectate lyase fromColletotrichumgloeosporioidesinC.magnapromotes pathogenicity [J]. Molecular Plant-Microbe Interactions, 2000, 13(8): 887-891.
[12]Zhang Tianyuan, Sun Xuepeng, Xu Qian, et al. The pH signaling transcription factor PacC is required for full virulence inPenicilliumdigitatum[J]. Applied Microbiology and Biotechnology, 2013, 97(20): 9087-9098.
[13]Zhu Jinwen, Xie Qingyun, Li Hongye. Occurrence of imazalil-resistant biotype ofPenicilliumdigitatumin China and the resistant molecular mechanism [J]. Journal of Zhejiang University-Science A, 2006, 7: 362-365.
[14]Pfaffl M W, Horgan G W. Dempfle L. Relative expression software tool (REST) for group-wise comparison and statistical analysis of relative expression results in real-time PCR[J]. Nucleic Acids Research, 2002, 30(9): e36.
[15]Mahmood A U, Greenman J, Scragg A H. Orange and potato peel extracts: Analysis and use asBacillussubstrates for the production of extracellular enzymes in continuous culture [J]. Enzyme and Microbial Technology, 1998, 22(1): 130-137.
(责任编辑:杨明丽)
Expression profiles of polygalacturonase (PdPG2) inPenicilliumdigitatum
You Shuyan1, Yu Ruijun1, Liu Hongxia1, Li Hongye2
(1.DalianAcademyofAgriculturalSciences,Dalian116036,China; 2.CollegeofAgricultureandBiotechnology,ZhejiangUniversity,Hangzhou310058,China)
Penicilliumdigitatumis the most important pathogen causing green mold disease of postharvest citrus. Previous studies indicated thatPdPG2 played an important role in pathogenicity, and disruption ofPdPG2 resulted in attenuated virulence ofP.digitatum. However, the expression profiles ofPdPG2 were not well characterized. In this study, we investigated the expression profiles ofPdPG2. The results indicated thatPdPG2 was up-regulated under acidic conditions. The expression level ofPdPG2 was approximately 10 fold at pH 3.0 and 0.36 fold at pH 8.0 compared with that in the control. Pectin could induce the expression ofPdPG2 and the expression level was about 3.6 fold of that in the control. These results indicated that acidic condition and pectin could inducePdPG2 expression. The decreased pH of citrus rind during infection was suitable forPdPG2 expression, and pectin might be also helpful during infection.
Penicilliumdigitatum; polygalacturonase; gene expression
2016-04-18
2016-06-07
国家自然科学基金(31371961);国家现代农业产业技术体系(CARS-27)
S 432.1
A
10.3969/j.issn.0529-1542.2017.02.023
* 通信作者 E-mail:hyli@zju.edu.cn
