交枝顶孢霉杀柑橘全爪螨活性及其生物学特性研究
2017-03-29胡军华龙艳玲彭凤格姚廷山李鸿筠
王 娟, 胡军华, 龙艳玲, 周 娜, 彭凤格, 姚廷山, 李鸿筠
(西南大学柑桔研究所/国家柑桔工程技术研究中心/西南果树科学观测实验站, 重庆 400712)
交枝顶孢霉杀柑橘全爪螨活性及其生物学特性研究
王 娟, 胡军华*, 龙艳玲, 周 娜, 彭凤格, 姚廷山, 李鸿筠
(西南大学柑桔研究所/国家柑桔工程技术研究中心/西南果树科学观测实验站, 重庆 400712)
为了明确交枝顶孢霉AcremoniumimplicatumCQBBW8的杀螨活性及其生物学特性,采用触杀毒力法检测CQBBW8菌株对柑橘全爪螨的致死率,通过单因素试验测试不同培养基、碳源、氮源、温度、pH及紫外线对CQBBW8菌株生长、产孢及其分生孢子萌发的影响。结果表明,CQBBW8菌株对柑橘全爪螨Panonychuscitri(McGregor)的校正致死率为54.42%,LC50为1.2×106个/mL,LT50值为5.175 9 d。最佳生长和产孢培养基分别为PDA和SEA;菌丝生长最适碳源和氮源为甘露醇和蛋白胨,产孢最适碳源和氮源为可溶性淀粉和氯化铵;最适生长温度为25℃,最适产孢和分生孢子萌发温度为30℃;最适生长和产孢pH为6.0,最适萌发pH为7.0;紫外线对菌丝生长影响不明显,对产孢影响较大,紫外线照射时间越长,孢子萌发率越高。综上,CQBBW8菌株对柑橘全爪螨有较强的毒力,对营养需求不高,环境适应性较强,具有开发为杀螨真菌制剂的潜力。
交枝顶孢霉; 生物学特性; 杀螨活性
顶孢霉属Acremoniumsp.是一类广谱性昆虫病原真菌,能够防治多种农林害虫,如青杨天牛SaperdapopulneaL.[1]、根结线虫Meloidogyneincognita[2-5]、杨干象Cryptorrhynchuslapathi(Linnaeus)[6]、六星黑点豹蠹蛾ZeuzeraleuconotumButler[7]、甘蓝蚜Brevicorynebrassicae、菜青虫Pierisrapae(Linnaeus)、小菜蛾Plutellaxylostella和黏虫Mythimnaseparata(Walker)[8-9]等等。并且顶孢霉也是一种抑制多种植物病原真菌生长的拮抗真菌[10-12],同时还具有医药价值[13-14],是一种具有开发应用潜力的真菌。2005年宋丽雯等[15]从菜豆蚜AphismedicaginisKoch虫尸上分离到顶孢霉AcremoniumhansfordiiAhy1菌株并且对其营养条件进行了初步研究,该菌株对二斑叶螨TetranychusurticaeKoch雌成螨有较高的侵染力,且能够延长螨卵的发育历期,降低螨卵孵化率;2012年姜立波等[16]研究发现顶孢霉Ahy1孢子与常用杀螨剂配合使用后对二斑叶螨的致死率提高了60%左右,LT50明显缩短;2013年王婧[17]研究表明顶孢霉与抑制剂对羟基苯甲酸、苯甲酸混用对顶孢霉侵染二斑叶螨有较好的协同作用。本实验室从重庆市北碚区西南大学柑桔研究所试验场采集的自然感染的柑橘全爪螨Panonychuscitri(McGregor)上分离到一株杀螨真菌CQBBW8,经形态学和分子鉴定为交枝顶孢霉Acremoniumimplicatum。在此基础之上笔者测定了CQBBW8菌株对柑橘全爪螨雌成螨的杀螨活性,系统地研究了不同培养基、碳源、氮源、温度、pH及紫外线对CQBBW8菌株生长、产孢及其分生孢子萌发的影响,明确其生长、产孢及分生孢子萌发所需要的营养条件和环境条件,以期为该菌后期的大批量培养和杀螨真菌制剂的开发与田间应用奠定基础。
1 材料和方法
1.1 材料
供试菌株:从重庆市北碚区西南大学柑桔研究所试验场采集到的自然感染的柑橘全爪螨上分离得到的CQBBW8菌株,保存于西南大学柑桔研究所综防课题组。PDA培养基25℃(L∥D=12 h∥12 h)培养7 d待用。
供试螨:柑橘全爪螨采自重庆市北碚区西南大学柑桔研究所试验场,采前未经药剂处理。
供试培养基:马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA): 去皮马铃薯200 g切块于800 mL去离子水中煮沸30 min后用4层纱布过滤所得液体,葡萄糖15 g,琼脂粉20 g,蒸馏水定容到1 L;淀粉琼脂培养基(SYA):可溶性淀粉40 g,酵母浸出粉5 g,琼脂20 g,蒸馏水定容到1 L;察氏培养基(Czapek’s):硝酸钠3 g,磷酸氢二钾1 g,硫酸镁(无水)0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,琼脂20 g,蒸馏水定容到1 L;萨氏培养基(SDAY):葡萄糖40 g,酵母浸出粉10 g,蛋白胨10 g,琼脂20 g,蒸馏水定容到1 L;萨氏蛋黄培养基(SEA):葡萄糖40 g,酵母浸出粉10 g,蛋白胨10 g,琼脂20 g,蒸馏水定容至1 L,121℃灭菌20 min,冷却至50~55℃时加入5个鸡蛋的蛋黄液,制备平板培养基,无菌试验后备用。孢子萌发液:2%葡萄糖,0.5%蛋白胨。
1.2 方法
1.2.1 CQBBW8菌株的杀螨活性测定
参照王娟[18]的方法刮取菌株CQBBW8菌丝置于盛有含0.02%吐温-80的20 mL无菌水的50 mL离心管中,于漩涡振荡器上振荡分散孢子,然后用4层无菌擦镜纸过滤收集孢子,分别配制成6个孢子悬浮液浓度梯度:1.27×103、1.27×104、1.27×105、1.27×106、1.27×107、1.27×108个/mL。采集新鲜健康的‘温州蜜柑’转绿叶片,75%乙醇消毒后无菌水清洗3遍,自然晾干,置于铺有湿海绵和滤纸的托盘内,叶缘用湿棉条围绕保湿。在每张叶片背面接50头柑橘全爪螨雌成螨,螨体稳定后喷洒孢子悬浮液,每张叶片均匀喷洒2 mL孢子悬浮液,5次重复。设置含0.02%吐温-80无菌水作对照。25℃保湿培养,连续7 d逐日调查雌成螨的感染死亡数,并采用农药室内生物测定数据处理系统(PBT)计算累积死亡率、校正死亡率、LC50值和LT50值。
1.2.2 CQBBW8菌株生长最佳培养基筛选
制备PDA培养基、SYA培养基、Czapek’s培养基、SDAY培养基、SEA培养基,用接种针挑取少量CQBBW8菌丝接到各种培养基平板上,每个处理5次重复。恒温光照培养箱中(25±1)℃恒温培养8 d后(L∥D=12 h∥12 h,RH 95%),采用十字交叉法测量菌落直径,计算平均日生长速率,并收集孢子,用血球计数板镜检菌落总产孢量,然后计算其单位面积产孢量。
1.2.3 碳源和氮源对CQBBW8菌株生长和产孢的影响
在去除碳源的察氏培养基中分别加入30 g可溶性淀粉、甘露醇、肌醇、麦芽糖、葡萄糖、乳糖、甘油、蔗糖制成不同碳源的供试培养基。每个处理5个重复,(25±1)℃恒温培养8 d(L∥D=12 h∥12 h,RH95%),菌落直径和产孢量的测定方法同1.2.2。
在去除氮源的察氏培养基中分别加入3 g硝酸钾、尿素、蛋白胨、硝酸铵、甘氨酸、赖氨酸、氯化铵制成不同氮源的供试培养基。每个处理5个重复,(25±1)℃恒温培养8 d(L∥D=12 h∥12 h,RH95%),采用十字交叉法测量菌落直径,计算其平均生长速率,并用血球计数板镜检孢子数量,折算为每平方毫米菌落产孢量。
1.2.4 温度对CQBBW8菌株生长、产孢和分生孢子萌发的影响
挑取少量CQBBW8菌株菌丝接至新的PDA培养基中央,分别置于10、15、20、25、30、35、40℃的光照培养箱(L∥D=12 h∥12 h,RH95%)中,每个处理5次重复,培养8 d时采用十字交叉法测量菌落直径,计算其平均生长速率,并用血球计数板镜检孢子数量,折算为每平方毫米菌落产孢量。
用孢子萌发液配制浓度为1×107个/mL的分生孢子悬浮液,取等量孢子悬浮液分别置于10、15、20、25、30、35、40℃的摇床中,100 r/min振荡培养,每个处理3次重复,处理20 h 后取样在显微镜下计测分生孢子的萌发状况。孢子萌发率(%)=萌发孢子数/孢子总数×100,下同。
1.2.5 pH对CQBBW8菌株生长、产孢和分生孢子萌发的影响
用 1 mol/L HCl 和 1 mol/L NaOH调节PDA培养基的pH分别为5.0、6.0、7.0、8.0、9.0、10.0、11.0,挑取菌丝接到不同pH的PDA培养基中央,每个处理5次重复,(25±1)℃恒温培养8 d (L∥D=12 h∥12 h,RH95%),采用十字交叉法测量菌落的直径,计算其平均生长速率,并用血球计数板镜检孢子数量,折算为每平方毫米菌落产孢量。
用 1 mol/L HCl 和 1 mol/L NaOH调节分生孢子悬浮液的pH分别为5.0、6.0、7.0、8.0、9.0、10.0、11.0,每个处理3次重复,(25±1)℃、100 r/min摇床中振荡培养,处理20 h 后取样在显微镜下计测分生孢子的萌发状况。
1.2.6 紫外线对CQBBW8菌株生长、产孢和分生孢子萌发的影响
用0.05%吐温-80无菌配制浓度为1×107个/mL的分生孢子悬浮液,在每个PDA平板中央接种孢子悬浮液2 μL,然后置于紫外灯(30 W,120 lx)40 cm下分别照射 5、10、20、30、40、50、60 min,每个处理5次重复,(25±1)℃恒温培养8 d(L∥D=12 h∥12 h,RH95%)。以不经紫外线照射作为对照。采用十字交叉法测量菌落直径,计算其平均生长速率,并用血球计数板镜检孢子数量,折算为每平方毫米菌落产孢量。
取等量分生孢子悬浮液置于紫外灯(30 W,120 lx)40 cm下分别照射 5、10、20、30、40、50、60 min,每个处理3次重复。(25±1)℃、100 r/min摇床中振荡培养,以不经紫外线照射作为对照,处理12 h 后取样在显微镜下计测分生孢子的萌发状况。
1.2.7 相容性杀菌剂、杀螨剂筛选
选取11种田间常用的杀菌剂作为供试杀菌剂:86.2%氧化亚铜可湿性粉剂(挪威劳道克斯公司)、40%氟硅唑乳油(美国杜邦公司)、60%唑醚·代森联水分散粒剂(巴斯夫欧洲公司)、10%苯醚甲环唑粉剂(海南博士威农用化学有限公司)、43%戊唑醇悬浮剂(拜尔作物科学(中国)有限公司)、20%甲基硫菌灵悬浮剂(深圳诺普信农化股份有限公司)、50%喹啉铜可湿性粉剂(浙江海正化工股份有限公司)、70%丙森锌可湿性粉剂(拜尔作物科学(中国)有限公司)、25%嘧菌酯悬浮剂(英国先正达有限公司)、50%多菌灵可湿性粉剂(江阴市农药二厂有限公司)、250 g/L吡唑醚菌酯乳油(巴斯夫欧洲公司),分别制成不同浓度的培养基,采用菌丝生长速率法测定杀菌剂的毒力。
选取5种田间常用的杀螨剂作为供试杀螨剂:240 g/L 螺螨酯悬浮剂(拜尔作物科学(中国)有限公司)、20%四螨嗪悬浮剂(广东中讯农科股份有限公司)、5% 唑螨酯悬浮剂(济南中科绿色生物工程有限公司)、15% 哒螨灵乳油(江苏克胜集团股份有限公司)、22.4% 螺虫乙酯悬浮剂(拜尔作物科学(中国)有限公司)。根据杀螨剂的性质,每种杀螨剂设定高、中、低3个供试浓度。
培养基配制:取1 g(1 mL)农药用无菌水配制成100 mL母液,取对应浓度所需体积的农药母液(无菌水作为对照)与100 mL PDA培养基混合均匀后平均倒入5个直径为9 cm的无菌培养皿中。挑取CQBBW8菌丝接入冷凝后的培养平板中央,28℃恒温培养7 d后用十字交叉法测量菌落直径。采用农药室内生物测定数据处理系统(PBT)对各药剂试验结果进行统计分析,获得各药剂对菌株的毒力回归方程、抑制中浓度(EC50)和相关系数(r)。
1.3 数据分析
采用SPSS 20.0软件进行试验数据的统计分析,Duncan氏新复极差法进行各处理间的差异显著性检验。
2 结果与分析
2.1 CQBBW8菌株对柑橘全爪螨雌成螨的杀螨活性
接种CQBBW8菌株孢子悬浮液后1~3 d时柑橘全爪螨行动缓慢,螨体颜色变暗,开始出现部分死亡。将死螨放在培养皿里保湿培养5 d,发现在其体表长出白色菌丝,挑取菌丝镜检和分子鉴定,确定和接种菌株是同一菌株。杀螨活性结果显示,死亡率随着孢子浓度的增大而升高。当孢子浓度为1.27×106个/mL时,第7天的累积死亡率达到55.33%,校正死亡率为54.42%,LC50为1.2×106个/mL(95%置信区间:5.67×105~2.65×106个/mL),毒力回归方程为Y=3.368 4+0.268 0X,相关系数(r)为0.929 1; LT50为5.175 9 d(95%置信区间:4.751 6~5.638 0 d),毒力回归方程为Y=3.160 7+2.254 0X,相关系数(r)为0.989 2。
2.2 CQBBW8菌株生长最佳培养基筛选
不同培养基对交枝顶孢霉的生长影响不同,在PDA培养基上CQBBW8菌株生长速率最快,为3.44 mm/d,其次是Czapek’s培养基和SYA培养基,在SEA培养基上菌丝生长最慢,为1.92 mm/d。产孢量在SEA培养基上最高,为6.43×105个/mm2,在察氏培养基上的产孢量最小,仅为0.54×105个/mm2(表 1)。
表1 CQBBW8菌株在不同培养基上的生长速率和产孢量1)
Table 1 The growth rates and spore production of CQBBW8 strain on different media
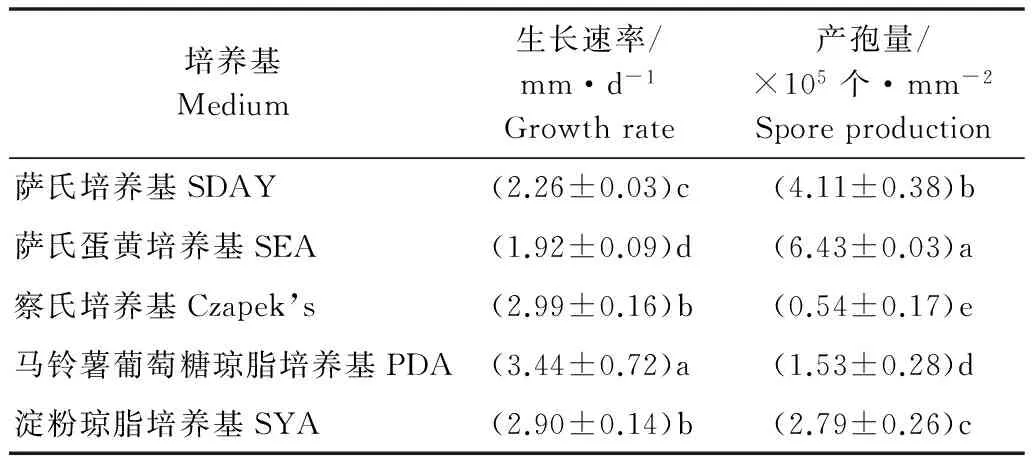
培养基Medium生长速率/mm·d-1Growthrate产孢量/×105个·mm-2Sporeproduction萨氏培养基SDAY(2.26±0.03)c(4.11±0.38)b萨氏蛋黄培养基SEA(1.92±0.09)d(6.43±0.03)a察氏培养基Czapek’s(2.99±0.16)b(0.54±0.17)e马铃薯葡萄糖琼脂培养基PDA(3.44±0.72)a(1.53±0.28)d淀粉琼脂培养基SYA(2.90±0.14)b(2.79±0.26)c
1) 数值为平均值±标准误。同列数值后不同小写英文字母表示在0.05水平差异显著(Duncan’s 多重比较法)。下同。 Data are means±SE; the different letters in the same column indicate significant difference at 0.05 level by Duncan’s multiple range test. The same below.
2.3 碳、氮源对CQBBW8菌株的影响
交枝顶孢霉在8种碳源培养基上均可生长,其中甘露醇对菌丝生长最为有利,生长速率为3.19 mm/d,其次为淀粉和蔗糖,对甘油和乳糖的利用最差,生长速率分别为2.70 mm/d和2.69 mm/d。该菌株在以淀粉为碳源的培养基上产孢量最大,为1.33×105个/mm2,以甘露醇为碳源的产孢量最低,为2.07×104个/mm2(表 2)。
表2 不同碳源对CQBBW8菌株生长和产孢量的影响
Table 2 Effects of carbon sources on mycelium growth and conidial production of CQBBW8 strain

碳源Carbonsource生长速率/mm·d-1Growthrate产孢量/×104个·mm-2Sporeproduction淀粉Solublestarch(3.00±0.10)b(13.32±0.63)a葡萄糖Glucose(2.94±0.04)bc(6.24±0.19)d甘露醇Mannite(3.19±0.11)a(2.07±0.12)h麦芽糖Maltose(2.80±0.05)cd(2.75±0.39)g肌醇Inositol(2.94±0.17)bc(6.76±0.62)c甘油Glycerol(2.70±0.10)d(3.30±0.28)f乳糖Lactose(2.69±0.13)d(10.49±0.53)b蔗糖Sucrose(2.99±0.16)b(5.37±0.17)e
不同氮源对菌丝生长和产孢的影响见表3。该菌株均能在这7种氮源的培养基上生长,经方差分析显示,蛋白胨最有利于菌丝的生长,生长速率为3.36 mm/d,赖氨酸最不利于菌丝的生长,生长速率为2.21 mm/d。产孢量在以氯化铵为氮源的培养基上最大,为1.99×105个/mm2,最差为甘氨酸,仅为1.96×104个/mm2。
表3 不同碳源对CQBBW8菌株生长和产孢量的影响
Table 3 Effects of nitrogen sources on mycelium growth and conidial production of CQBBW8 strain
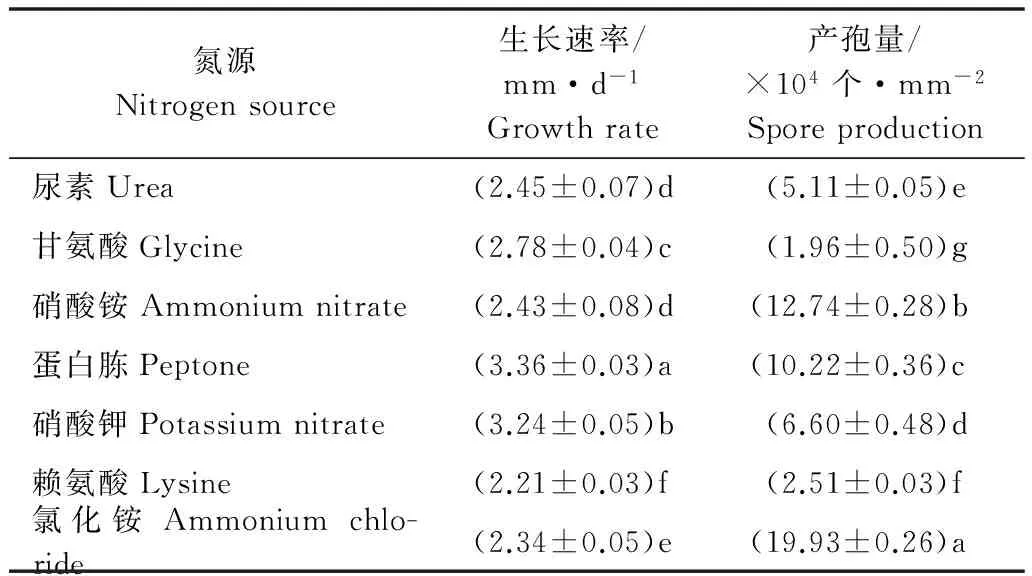
氮源Nitrogensource生长速率/mm·d-1Growthrate产孢量/×104个·mm-2Sporeproduction尿素Urea(2.45±0.07)d(5.11±0.05)e甘氨酸Glycine(2.78±0.04)c(1.96±0.50)g硝酸铵Ammoniumnitrate(2.43±0.08)d(12.74±0.28)b蛋白胨Peptone(3.36±0.03)a(10.22±0.36)c硝酸钾Potassiumnitrate(3.24±0.05)b(6.60±0.48)d赖氨酸Lysine(2.21±0.03)f(2.51±0.03)f氯化铵Ammoniumchlo-ride(2.34±0.05)e(19.93±0.26)a
2.4 不同温度对CQBBW8菌株菌丝生长、产孢和孢子萌发的影响
试验结果表明:CQBBW8菌株在10~30 ℃均能生长,最佳生长温度为25 ℃,平均生长速率为3.06 mm/d。在10 ℃生长最慢,生长速率为0.64 mm/d,在35、40 ℃不能生长(表 4)。该菌产孢的温度范围为10~30 ℃,在30 ℃时产孢量最大,为3.39×105个/mm2。分生孢子在10~35 ℃均能萌发,最适温度为25 ℃,萌发率为42.56%,在40 ℃不萌发。
表4 温度对CQBBW8菌株菌丝生长、产孢量和
分生孢子萌发的影响
Table 4 Effects of different temperatures on mycelium growth, conidial production and germination of CQBBW8 strain

温度/℃Temperature生长速率/mm·d-1Growthrate产孢量/×104个·mm-2Sporeproduction分生孢子萌发率/%Conidialgerminationrate10(0.64±0.03)d(7.34±0.08)d(3.56±0.005)f15(1.33±0.08)c(3.97±0.30)e(16.44±0.007)c20(2.36±0.05)b(12.93±0.21)c(25.11±0.008)b25(3.06±0.06)a(15.29±0.28)b(42.56±0.007)a30(2.47±0.10)b(33.87±0.43)a(14.89±0.017)d35(0.00±0.00)e(0.00±0.00)f(6.56±0.005)e40(0.00±0.00)e(0.00±0.00)f(0.00±0.000)g
2.5 不同pH对菌丝生长、产孢和孢子萌发的影响
从表5可以看出,CQBBW8在pH 为5.0~11.0条件下菌丝均能生长,在pH为6.0~8.0范围内生长速率相对较快,最适生长pH为6.0,生长速率为3.03 mm/d。产孢范围为pH 5.0~11.0,最适产孢pH为6.0,产孢量为3.16×105个孢子/mm2,在pH为11.0时产量最少,仅为1.01×105个孢子/mm2。分生孢子在pH 5.0~9.0内均能萌发,萌发率随着pH的增大呈先升高后下降的趋势,在pH为7.0时萌发率最高为13.56%,在pH 10.0和11.0不萌发。
2.6 紫外照射对CQBBW8菌株菌丝生长、产孢和孢子萌发的影响
紫外线照射不同时间对CQBBW8菌株的影响见表 6。从表中可知,紫外照射5 min显著降低了该菌株的生长速率,为3.04 mm/d,其他处理对菌丝生长速率的影响无显著差异。但是紫外照射对产孢量影响较大,紫外线照射30 min的产孢量最低,为2.38×105个孢子/mm2,紫外线照射10 min的产孢量最高,为4.43×105个孢子/mm2。随着紫外照射时间的延长,孢子萌发率逐渐增高,紫外线照射60 min时孢子萌发率达到64.33%。
表5 pH对CQBBW8菌株菌丝生长、产孢量和
分生孢子萌发的影响
Table 5 Effects of pH value on mycelium growth, conidial production and germination of CQBBW8 strain

pH生长速率/mm·d-1Growthrate产孢量/×105个·mm-2Sporeproduction分生孢子萌发率/%Conidialgerminationrate5.0(2.59±0.13)c(2.42±0.35)c(8.22±0.004)c6.0(3.03±0.11)a(3.16±0.46)a(10.78±0.004)b7.0(2.95±0.08)ab(2.45±0.69)b(13.56±0.005)a8.0(2.98±0.09)ab(2.39±0.31)d(10.67±0.007)b9.0(2.88±0.13)ab(1.56±0.34)e(4.00±0.003)d10.0(2.85±0.10)b(1.56±0.34)e(0.00±0.00)e11.0(2.59±0.11)c(1.01±0.62)f(0.00±0.00)e
表6 紫外照射对CQBBW8菌株菌丝生长、
产孢量和分生孢子萌发的影响
Table 6 Effects of UV radiation on mycelium growth, conidial production and germination of CQBBW8 strain

紫外照射时间/minUVirradiationtime生长速率/mm·d-1Growthrate产孢量/×105个·mm-2Sporeproduction分生孢子萌发率/%Conidialgerminationrate0(3.19±0.01)a(2.54±0.43)g(27.78±0.008)h5(3.04±0.02)b(2.75±0.46)c(31.67±0.009)g10(3.17±0.01)a(4.43±0.59)a(39.56±0.008)f20(3.19±0.02)a(4.26±0.35)b(42.78±0.024)e30(3.22±0.00)a(2.38±0.36)h(49.11±0.008)d40(3.22±0.01)a(2.56±0.50)f(55.89±0.008)c50(3.09±0.02)ab(2.64±0.63)e(60.22±0.010)b60(3.19±0.02)a(2.65±0.52)d(64.33±0.010)a
2.7 CQBBW8菌株与杀菌剂的相容性筛选
从表7可以看出,250 g/L吡唑醚菌酯WP与交枝顶孢霉的相容性最差,EC50值为1.502 1 mg/mL,其次为50%多菌灵WP、40%氟硅唑EC、43%戊唑醇EC等,EC50分别为2.102 6、6.260 2和10.282 8 mg/mL。氧化亚铜与交枝顶孢霉的相容性最好,EC50为6.24×1027mg/mL,其次为70%丙森锌WP和25%嘧菌酯SC。
从表8可以看出,20%四螨嗪SC与交枝顶孢霉的相容性最好,其次为240 g/L螺螨酯SC,5% 唑螨酯SC的相容性最差,需尽可能减少配合使用次数。
表7 11种杀菌剂与交枝顶孢霉的相容性1)
Table 7 Compatibility of 11 fungicides withAcremoniumimplicatumstrain
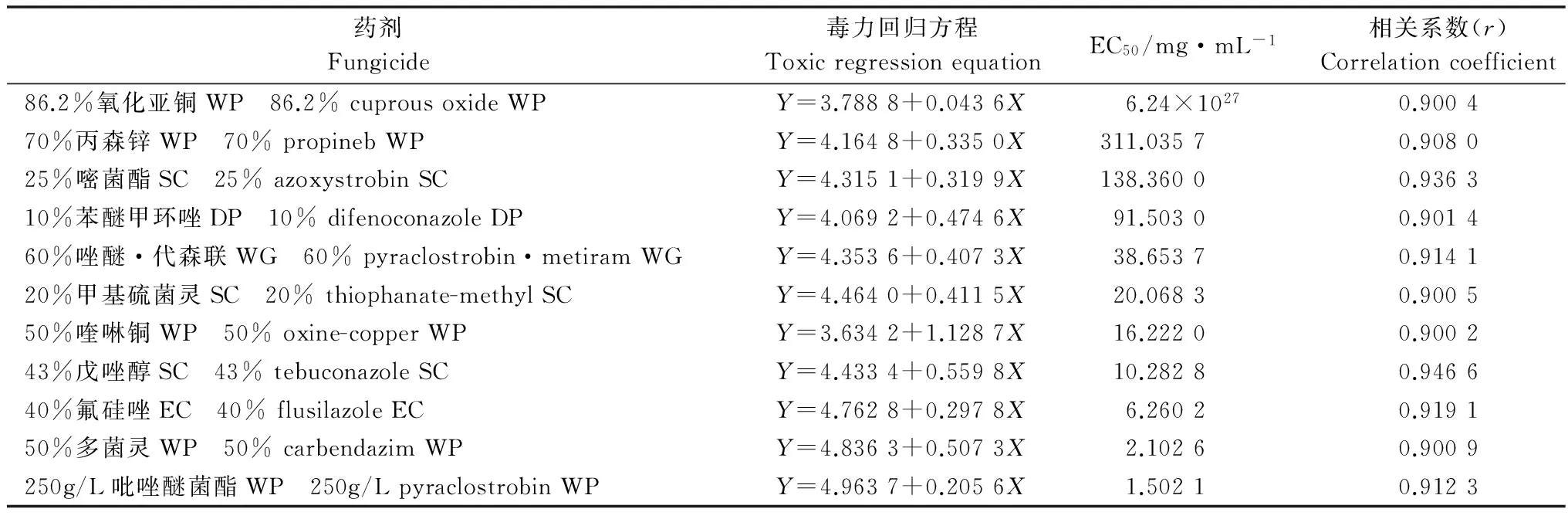
药剂Fungicide毒力回归方程ToxicregressionequationEC50/mg·mL-1相关系数(r)Correlationcoefficient86.2%氧化亚铜WP 86.2%cuprousoxideWPY=3.7888+0.0436X6.24×10270.900470%丙森锌WP 70%propinebWPY=4.1648+0.3350X311.03570.908025%嘧菌酯SC 25%azoxystrobinSCY=4.3151+0.3199X138.36000.936310%苯醚甲环唑DP 10%difenoconazoleDPY=4.0692+0.4746X91.50300.901460%唑醚·代森联WG 60%pyraclostrobin·metiramWGY=4.3536+0.4073X38.65370.914120%甲基硫菌灵SC 20%thiophanate-methylSCY=4.4640+0.4115X20.06830.900550%喹啉铜WP 50%oxine-copperWPY=3.6342+1.1287X16.22200.900243%戊唑醇SC 43%tebuconazoleSCY=4.4334+0.5598X10.28280.946640%氟硅唑EC 40%flusilazoleECY=4.7628+0.2978X6.26020.919150%多菌灵WP 50%carbendazimWPY=4.8363+0.5073X2.10260.9009250g/L吡唑醚菌酯WP 250g/LpyraclostrobinWPY=4.9637+0.2056X1.50210.9123
表8 5种杀螨剂对交枝顶孢霉生长的抑制作用
Table 8 Growth inhibitory effect of 5 kinds of acaricides onAcremoniumimplicatumstrain

杀螨剂Acaricide高浓度/μg·mL-1Highconcentration抑制率/%Inhibitionrate中浓度/μg·mL-1Mediumconcentration抑制率/%Inhibitionrate低浓度/μg·mL-1Lowconcentration抑制率/%Inhibitionrate240g/L螺螨酯SC 240g/LspirodiclofenSC6015.90405.10155.025%唑螨酯SC 5%fenpyroximateSC6020.504025.521524.2720%四螨嗪SC 20%clofentezineSC1000602.51202.5115%哒螨灵EC 15%pyridabenEC2521.341517.99511.7222.4%螺虫乙酯SC 22.4%spirotetramatSC5015.063019.251015.06
3 讨论
2012年姜立波等[16]的研究发现1×106个/mL顶孢霉孢子对二斑叶螨的校正致死率为23.33%,LT50为 9.57 d;2013年王婧[17]的研究表明,当顶孢霉孢子浓度为1×106个/mL时,对二斑叶螨的校正杀螨率为30.95%;本试验结果表明,交枝顶孢霉CQBBW8菌株分生孢子浓度为1.27×106个/mL时对柑橘全爪螨雌成螨的校正致死率高达54.42%,LC50和LT50分别为1.2×106个/mL和6.55 d,与以上研究报道的致死率相比有更好的杀螨效果。这也可能是由于菌株种类和叶螨种类不同、杀螨评价技术体系不一致等因素导致杀螨结果的差异,但同时也说明了CQBBW 8菌株具有生防潜力和开发为杀螨真菌制剂的价值。
从不同环境中分离到的不同生理小种的顶孢霉对营养的需求不尽相同。宋丽雯等[19]的研究显示萨氏培养基和萨氏蛋黄培养基最有利于顶孢霉A.hansfordiiAhy1菌落的生长和产孢,最佳生长和产孢碳源为葡萄糖和蔗糖,对甘油利用最差,最佳氮源为蛋白胨,氯化铵最差;孙冬梅等[20]报道桃色顶孢霉A.persicinum生长最佳碳源为蔗糖,不能利用纤维素,最佳氮源为胰蛋白胨,尿素最差;徐婧等[21]的研究表明葫芦科枝顶孢霉A.cucurbitacearum在PDA等培养基上生长良好,最适宜菌株生长的碳源为可溶性淀粉和麦芽糖,氮源为酵母膏、蛋白胨,对硝酸铵和氯化铵的利用较差。本试验结果与以上研究结果基本一致,总的来说,CQBBW8菌株能够利用多种碳源和氮源进行生长,对营养条件要求不高,易于培养。
菌株对环境条件适应性的强弱直接影响其能否在自然界中稳定存在。桃色顶孢霉[20]生长的最适pH8.5,最适温度为30℃;葫芦科枝顶孢霉A.cucurbitacearum[22]在5~33℃范围内均可生长,最适宜温度为25℃,超过35℃病菌不能生长。生长的pH范围为5~12,最适宜pH为8。康晓慧等[22]报道点枝顶孢霉A.strictum菌丝体生长的温度范围是10~25℃,在20~25℃生长最快,低于10℃或温度达到30~35℃时生长缓慢,40℃或45℃时菌丝体不生长;菌丝体生长以及孢子萌发最适宜pH范围为7~8,pH低于4或高于8菌丝不生长,孢子难以萌发;紫外照射对大多数真菌孢子都具有一定的杀伤力,张海英[23]研究了紫外线照射处理对顶孢霉A.hansfordii分生孢子萌发的影响,结果显示随着照射时间的不断延长,分生孢子的萌发率也逐渐降低。本试验结果与以上研究结果也基本一致,均表明顶孢霉具有较宽的温度和酸碱适应范围,比较适宜在25~30℃、中性环境中生长。本研究最值得一提的是,紫外线照射处理对CQBBW8菌株生长和产孢影响不大,而且随着紫外线照射时间的延长,孢子萌发率逐渐增高。相较而言,抗逆性较高的CQBBW8菌株更易于在重庆这种高温高湿、紫外线较强的环境中存活,能在田间施用后达到持续控制害螨的作用。
此外,笔者还研究了11种杀菌剂和5种杀螨剂与交枝顶孢霉的相容性,结果显示氧化亚铜、四螨嗪与交枝顶孢霉的相容性最好。2012年姜立波等[16]研究了常用杀螨剂与顶孢霉Ahy1菌株的相容性及协同作用,结果显示哒螨灵、虫螨腈、螺螨酯与顶孢霉混用对二斑叶螨有一定的协同作用,菌药复配使用能够提高杀螨效果。因此筛选与虫生真菌相容的化学药剂二者复配使用,不仅能够有效克服生防真菌制剂潜伏期长、药效缓慢的问题,同时还可以大幅降低化学药剂的施用量,对有效控制害虫、减少化学农药残留和环境保护具有重要意义。
综上所述,交枝顶孢霉CQBBW8菌株对柑橘全爪螨具有较高致病力,具有开发成为杀螨真菌制剂的潜力。下一步我们将系统研究CQBBW8对二斑叶螨、蚜虫、粉虱等柑橘害虫的杀虫效果,扩大其杀虫谱,以期为田间柑橘病虫害的综合防治做出贡献。同时CQBBW8菌株对营养需求不高,环境适应性较强,易于大批量培养,与氧化亚铜等杀菌剂和多种杀螨剂相容性较好,其生物学特性的阐明为后期菌株快速培养和开发为杀虫真菌制剂防治柑橘全爪螨及其他害虫奠定基础,使利用微生物农药来实现生物防控柑橘病虫害成为可能[24]。
[1] 樊美珍,郭超,燕新华. 从青杨天牛分离的几种致病真菌[J]. 真菌学报,1987,6(2):97-102.
[2] 林森,武侠,曹君正,等. 产生几丁质酶的交枝顶孢(Acremoniumimplicatum)对南方根结线虫生防潜力[J]. 植物病理学报,2013,43(5):509-517.
[3] Sun M H, Gao L, Shi Y X, et al. Fungi and actinomycetes associated withMeloidogynespp. eggs and females in China and their biocontrol potential [J]. Journal of Invertebrate Pathology, 2006, 93(1):22-28.
[4] 林森,武侠,王凤龙,等. 定殖烟草根结线虫卵和雌虫机会真菌的多样性[J].中国生态农业学报,2012,20(10):1353-1358.
[5] Satyandra S, Nita M.Invitrostudies of antagonistic fungi against the root-knot nematode,Meloidogyneincognita[J]. Biocontrol Science & Technology, 2010, 20(3):275-282.
[6] 侯爱菊,刘二曼,胜军. 杨干象寄生菌—枝顶孢霉的初步研究[C]∥《中国虫生真菌研究与应用》编委会.中国虫生真菌研究与应用(第二卷). 北京:中国农业科技出版社,1991.
[7] 刘星辰,刘强,刘艳飞,等.不同温度下交织顶孢霉对六星黑点豹蠹蛾幼虫的致病力研究[J]. 天津师范大学学报:自然科学版,2011,31(1):63-65.
[8] 李莉. 顶孢霉菌株(Acremoniumhansfordii)对菜青虫的杀虫机理和液体发酵培养的研究[D]. 兰州:甘肃农业大学,2007.
[9] 王琰, 沈慧敏, 杨顺义, 等. 顶孢霉菌对小菜蛾的毒力及体内保护酶活力的影响[J]. 甘肃农业大学学报,2010,45(6):105-109.[10]郭永霞, 刘庆洪, 王贺祥, 等.Acremoniumhansfordii,—中国新记录种及其抗植物病原真菌活性的研究[J].菌物学报, 2005, 24(4):505-509.
[11]何苏琴, 金秀琳, 王生荣. 白黄笋顶孢霉对几种植物病原真菌的拮抗作用[J]. 甘肃农业大学学报,2010,45(3):60-65.
[12]Xiang L B, Gong S J, Yang L J, et al. Biocontrol potential of endophytic fungi in medicinal plants from Wuhan Botanical Garden in China [J]. Biological Control, 2016, 94:47-55.
[13]彭凡, 胡丰林, 樊美珍, 等. 交织顶孢霉保肝活性物质的研究[J]. 生物学杂志,2005,22(3):25-27.
[14]龙雁华, 李春如, 樊美珍, 等. 不同营养液液体培养对交织顶孢霉形态和胞外多糖的影响[J]. 安徽农业大学学报, 2004, 31(3):269-272.
[15]宋丽雯, 白海莉, 沈慧敏. 几种病原真菌对二点叶螨、桃蚜的侵染能力研究[J]. 微生物学杂志,2005,25(6):52-55.
[16]姜立波, 赵亚冬, 周兴隆, 等. 常用杀螨剂与顶孢霉Ahy1菌株的相容性及协同作用[J]. 植物保护,2012,38(5):73-77.
[17]王婧. 顶孢霉对二斑叶螨的侵染及对表皮相关酶活性的影响[D]. 兰州:甘肃农业大学,2013.
[18]王娟, 胡军华, 龙艳玲, 等. 柑桔全爪螨高致病力菌株芽枝状枝孢霉的生物学特性研究[J]. 应用昆虫学报, 2016, 53(1):22-29.[19]宋丽雯, 杨顺义, 张新虎, 等. 顶孢霉Ahy1营养条件的初步研究[J]. 植物保护,2007,33(6):67-70.
[20]孙冬梅, 董雪梅, 王北艳, 等. 拮抗真菌—桃色顶孢霉生物学特性研究[J]. 黑龙江农业科学,2014(11):66-69.
[21]徐婧, 王丽娟, 徐秀德, 等. 西瓜衰萎病菌生物学特性研究[J]. 沈阳农业大学学报,2013,44(1):84-87.
[22]康晓慧, 贺新生. 双孢蘑菇顶枝孢霉病害的生物学特性和药剂筛选[J]. 植物保护,2004,30(1):28-31.
[23]张海英. 根虫瘟霉的生物学特性和对桃蚜致病机理的研究[D]. 兰州:甘肃农业大学,2005.
[24]Lacey L A, Frutos R, Kaya H K, et al. Insect pathogens as biological control agents: Do they have a future?[J]. Biological Control, 2001, 21(3):230-248.
(责任编辑:田 喆)
Biological characteristics and acaricidal activity ofAcremoniumimplicatumtoPanonychuscitri(McGregor)
Wang Juan, Hu Junhua, Long Yanling, Zhou Na, Peng Fengge, Yao Tingshan, Li Hongjun
(CitrusResearchInstitute,SouthwestUniversity,NationalEngineeringResearchCenterforCitrus,ScientificObservationandExperimentalStationofFruitTreeScience(SouthwestRegion),MinistryofAgriculture,Chongqing400712,China)
To explore the acaricidal activity and biological characteristics ofAcremoniumimplicatumCQBBW8, the lethal rate of CQBBW8 strain toPanonychuscitri(McGregor) was detected by using contact toxicity method, and the effects of different factors, such as culture medium, carbon source, nitrogen source, temperature, pH, and UV on the hyphal growth, sporulation and spore germination ofA.implicatumwere tested by using single factor test. The results indicated that the corrected mortality rate of CQBBW8 strain toP.citriwas 54.42%; the LC50was 1.2×106spores/mL and the LT50was 5.175 9 d. The optimum growth and sporulation culture medium were PDA and SEA. Mannite and peptone were the best carbon and nitrogen sources for hyphal growth, and soluble starch and ammonium chloride were the best carbon and nitrogen sources for sporulation, respectively. The most suitable culture temperature for hyphal growth was 25℃, and the most suitable temperature for sporulation and spore germination was 30℃. The optimum pH for hyphal growth and sporulation was 6.0, and the optimum pH for spore germination was 7.0. Although UV had no significant effect on fungal growth rate, it had a marked effect on sporulation; the longer the ultraviolet irradiation time, the higher the rate of spore germination. In summary, CQBBW8 strain had a strong toxicity toP.citri, without a high nutritional demand, and its environmental adaptability was strong, with a potential for development of the fungus preparation for killing mites.
Acremoniumimplicatum; biological characteristic; acaricidal activity
2016-04-20
2016-06-10
公益性行业(农业)科研专项(201103020);重庆市科技支撑示范工程(cstc2014fazktjcsf0075);“十二五”农村领域国家科技计划课题(2014BAD16B702-5)
S 476.1
A
10.3969/j.issn.0529-1542.2017.02.015
* 通信作者 E-mail:hujunhua@cric.cn
