甘草次酸脂化乳的质量评价指标探讨Δ
2017-03-29李士远张秀荣陈芳宁王秀丽北京中医药大学中药学院北京100102
金 粟,李士远,张秀荣,陈芳宁,王秀丽(北京中医药大学中药学院,北京 100102)
·药物分析与检定·
甘草次酸脂化乳的质量评价指标探讨Δ
金 粟*,李士远,张秀荣,陈芳宁,王秀丽#(北京中医药大学中药学院,北京 100102)
目的:为甘草次酸脂化乳的质量评价提供参考指标。方法:采用冷冻透射电子显微镜检测甘草次酸脂化乳粒子形态,激光纳米粒度仪测定其粒径、多分散系数(PDI)及电位情况;采用超高效液相色谱法测定其中有效成分甘草次酸的载药量;在30℃下放置10 d考察该制剂的稳定性。结果:制备的甘草次酸脂化乳轮廓清晰、结构完整、呈类圆形、排列紧密;平均粒径为(245.2± 4.29)nm,PDI为(0.054±0.01),平均电位为(-6.25±0.54)mV;甘草次酸的载药量平均值为(1.25±0.09)mg/mL;质量浓度为0.82 mg/mL的样品在10 d内稳定性良好。结论:粒径、电位、载药量、稳定性可作为甘草次酸脂化乳的评价指标。
甘草次酸脂化乳;质量评价;指标;载药量
脂化乳是一种新型给药系统,其结构与脂质体有相似之处,均属于脂质体系,能够促进药物的肠淋巴转运,从而促进药物吸收。脂质体可以通过将药物包封脂质层内,以增加难溶性药物溶解度,提高药物稳定性,降低药物刺激性等[1-3];但脂质体口服吸收会在胃肠道受到明显破坏,降低载药量,所以脂质体难以通过口服给药实现理想的药物递送。而脂化乳的稳定性和载药量较脂质体有明显提升,经高压乳匀纳米化后,脂化乳剂粒径分布均匀(可实现粒径为200 nm左右),制剂质地均匀。脂化乳制剂制备方法简单,辅料安全,具有良好的应用前景。作为一种全新的给药系统,需要建立合理的评价体系,以便对该制剂质量进行合理评价。而现有文献并未有该制剂的质量评价标准。因此,本课题组以甘草次酸为模型药物,制备甘草次酸脂化乳,鉴于脂化乳与脂质体结构有相似之处,在选择评价指标时参考了脂质体的评价指标[4],通过对粒径、电位、载药量、包封率、稳定性等的检测,确定脂化乳的评价指标,以期为脂化乳制剂的应用提供参考依据。
1 材料
1.1 仪器
超高效液相色谱(UPLC)Accuracy系统,包括二元超高压溶剂系统、自动进样恒温样本管理器、二极管阵列检测器、Empower3色谱工作站(美国Waters公司);NANO-pure Diamond Ro+型纯水仪(美国Thermo Fisher Scientific公司);FA1204B型电子天平(上海越平科学仪器有限公司);KQ-300VDB型超声波清洗仪(昆山市超声仪器有限公司,功率:300 W,频率:50 kHz);SCIENTZ-II D型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);HD-3型紫外检测仪(上海沪西分析仪器厂有限公司);Zetasizer Nano ZS90型激光纳米粒度仪(英国Malvern公司);G16型医用高速离心机(安新县白洋离心机厂);Tecnai G2-T20型冷冻透射电子显微镜,包括CCD数字成像系统、X射线能谱仪、扫描透射、高角环形暗场探测器、电子能量损失谱仪(美国FEI公司)。
1.2 试剂
甘草次酸提取物(宝鸡国康生物科技有限公司,批号:111215,纯度:≥98%);甘草次酸对照品(中国食品药品检定研究院,批号:110723-200411,纯度:96.2%);甲酸、甲醇为色谱纯,胆固醇(PC-98T型)、蛋黄卵磷脂(PL-100M型)、大豆卵磷脂、氢化大豆磷脂、无水乙醇为分析纯,水为娃哈哈纯净水。
2 方法与结果
2.1 甘草次酸脂化乳的制备
精密称取甘草次酸提取物25 mg、油相辅料(胆固醇、蛋黄卵磷脂、大豆卵磷脂、氢化大豆磷脂)1 025 mg、油脂2 mL,置于50 mL烧杯中,于(60±2)℃水浴上加热,并加入1 mL无水乙醇助溶,使其全部溶解;另取18 mL水,置于50 mL小烧杯中(60±2)℃水浴加热,作为水相。待无水乙醇挥发完全(无乙醇味)、油相溶解完全,用20 mL的一次性注射器将水相匀速、缓慢滴入到油相中,并在油相中加入转子使其充分混匀,以120 r/min低速搅拌10 min,在搅拌过程中温度始终保持(60±2)℃;混匀后,高压乳匀机600 bar压制60 s,即得。
2.2 形态观察、粒径分布及电位测定
2.2.1 形态观察 采用相关文献中收载的方法[5],取样品适量,置于1 mL离心管中,加入适量水稀释20倍,混合均匀。用移液枪精密吸取10 μL稀释后的样品准确滴加在微栅膜铜网上(微栅膜铜网预先进行亲水性处理),滤纸吸去多余液体,快速冲投到已被液氮充分冷却的液态乙烷中,液体水形成非晶态的冰,样品无损地包埋在其中;保持微栅膜铜网浸没在液氮中,迅速转移到预冷的样品杆中,将样品杆转移到冷冻样品传输架上,采用冷冻透射电子显微镜在10万倍下显像,加速电压300 kV,用CCD数字成像系统记录脂化乳粒子形态。甘草次酸脂化乳冷冻电镜图见图1。由图1可知,甘草次酸脂化乳轮廓清晰,结构完整,呈类圆形,排列紧密。
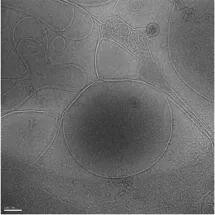
图1 甘草次酸脂化乳冷冻电镜图(×100 000)Fig 1 Croy-TEM photograph of glycyrrhetinic acidlipo-emul(×100 000)
2.2.2 粒径和电位分布情况 取样品适量,置于50 mL烧杯中,加入适量水,稀释100倍,混合均匀,取1.5 mL稀释液装入粒径杯中,用Zetasizer Nano ZS90型激光纳米粒度仪检测粒径及多分散系数(PDI)。用5 mL注射器吸取上述稀释液,注入电位杯,排空气泡,用Zetasizer Nano ZS90型激光纳米粒度仪检测电位情况。结果,甘草次酸的平均粒径为(245.2±4.29)nm,PDI为(0.054± 0.01),平均电位为(-6.25±0.54)mV。
2.3 载药量测定
2.3.1 超高效液相色谱条件 色谱柱:ACQUITY BEH C18(50 mm×2.1 mm,1.7 μm);流动相:甲醇-0.5%甲酸水溶液(77∶23,V/V);流速:0.4 mL/min;检测波长:251 nm;柱温:30℃;进样量:2 μL。
2.3.2 溶液的制备 ①对照品溶液:精密称取甘草次酸对照品15.05 mg,置于25 mL量瓶中,加甲醇定容,超声处理5 min,使其充分溶解,放至室温,经0.22 μm微孔滤膜滤过,弃去前3滴,制得甘草次酸质量浓度为602 μg/mL的对照品溶液。②供试品溶液:精密量取样品0.1 mL,置于5 mL量瓶中,加1 mL甲醇,超声处理5 min破乳,经0.22 μm微孔滤膜滤过,取续滤液,即得。③阴性对照溶液:按样品的处方比例和制备工艺制备缺甘草次酸的阴性样品,再按供试品溶液的制备方法制备阴性对照溶液。
2.3.3 系统适用性试验 精密量取“2.3.2”项下对照品溶液、供试品溶液和阴性对照溶液各适量,进行稀释,再按“2.3.1”项下色谱条件进样测定,记录色谱,详见图2。由图2可知,在该色谱条件下,分离度>1.5;理论板数以甘草次酸峰计>5 000;甘草次酸保留时间为2.3 min。结果表明,其他辅料对甘草次酸主峰的测定没有干扰。

图2 超高效液相色谱图Fig 2 UPLC chromatograms
2.3.4 线性关系考察 精密量取“2.3.2”项下对照品溶液适量,加甲醇稀释制备甘草次酸质量浓度分别为36.12、72.24、96.32、150.50、301.00、602.00 μg/mL的系列对照品溶液。取上述溶液各适量,按“2.3.1”项下色谱条件进样测定,记录峰面积。以甘草次酸质量浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得甘草次酸的回归方程为y=2 201.9x-30 792(r=0.999 9)。结果表明,甘草次酸检测质量浓度线性范围为36.12~602.00 μg/mL。
2.3.5 精密度试验 取“2.3.2”项下对照品溶液适量,按“2.3.1”项下色谱条件连续进样测定6次,记录峰面积。结果,甘草次酸峰面积的RSD=0.37%(n=6),表明仪器精密度良好。
2.3.6 稳定性试验 取“2.3.2”项下供试品溶液适量,分别于室温下放置0、1、2、3、5、7、9、11、13 h时按“2.3.1”项下色谱条件进样测定,记录峰面积。结果,甘草次酸峰面积的RSD=1.25%(n=9),表明供试品溶液在室温下放置13 h内稳定性良好。
2.3.7 重复性试验 按“2.1”项下方法制备样品,按“2.3.2”项下供试品溶液的制备方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,记录峰面积并计算含量。结果,甘草次酸峰面积的RSD=1.19%(n=6),表明本方法重复性良好。
2.3.8 回收率试验 取阴性对照品溶液适量,共9份,各置于5 mL量瓶中,分别加入一定质量的甘草次酸对照品,按“2.3.2”项下供试品溶液的制备方法制备供试品溶液。取上述溶液适量,按“2.3.1”项下色谱条件进样测定,记录峰面积并计算回收率,结果见表1。
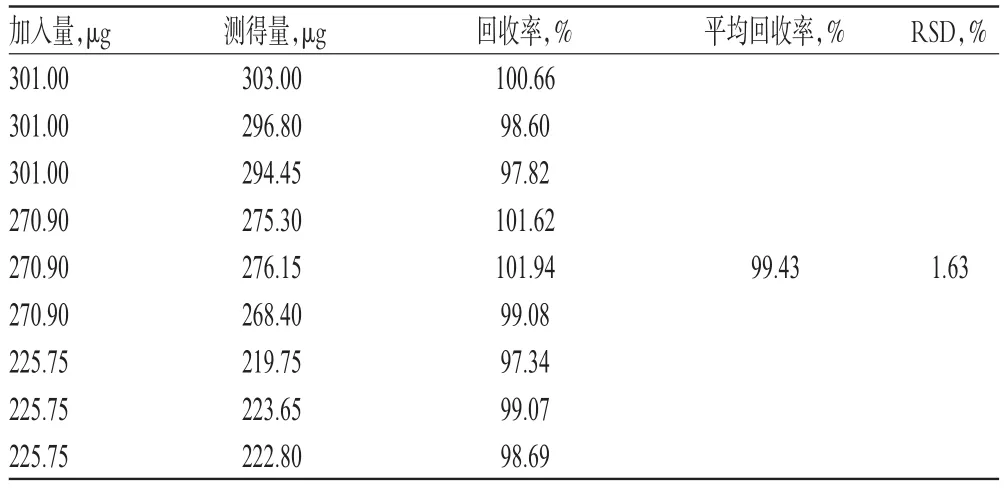
表1 回收率试验结果(n=9)Tab 1 Results of recovery test(n=9)
2.4 载药量的测定
精密吸取“2.1”项下制备的样品0.1 mL,置于2 mL离心管中,加1 mL甲醇,超声处理5 min破乳,再经0.22 μm微孔滤膜滤过,取续滤液,按“2.3.1”项下色谱条件进样测定,记录峰面积。将峰面积带入标准曲线计算甘草次酸含量,得到甘草次酸脂化乳中甘草次酸载药量的平均值为(1.25±0.09)mg/mL。
2.5 稳定性考察
按“2.1”项下方法分别制备一系列质量浓度的样品,恒温(30℃)下避光放置,分别于放置1、5、10 d时观察制剂状态,再按“2.4”项下方法测定载药量,以考察样品的稳定性。甘草次酸脂化乳稳定性试验结果见表2。由表2可知,样品放置1 d时,各组制剂状态稳定;放置5 d时,2.53 mg/mL组(A组)产生少量沉淀,1.25 mg/mL组(B组)和0.82 mg/mL组(C组)无沉定产生;放置10 d时,A组产生较多沉淀,B组产生少量沉淀,C组未见沉淀;由载药量变化情况可见,A组放置5 d载药量已降至71%,B组虽未见沉淀但载药量略降低,C组稳定性状况较好。
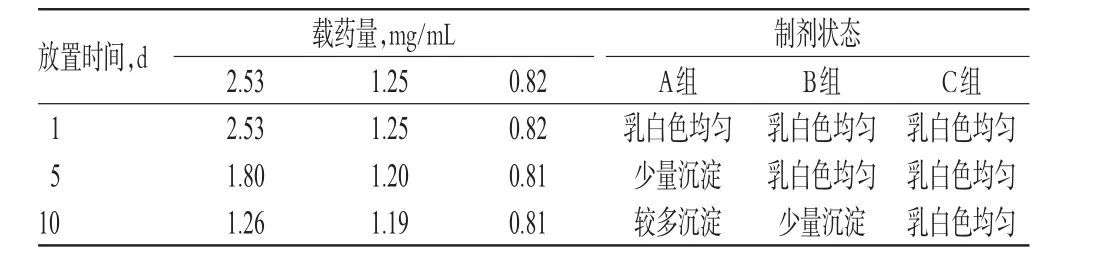
表2 甘草次酸脂化乳稳定性试验结果Tab 2 Results of stability test of glycyrrhetinic acid
3 讨论
在脂化乳质量评价标准考察过程中,因脂化乳与脂质体具有相似结构,笔者曾以脂质体考察指标中的包封率(大小)来评价甘草次酸脂化乳。脂质体包封率测定方法[4,6-7]较多,常用的方法包括葡聚糖凝胶法[8-11]、透析法[12]、超滤法[13]、离心法[14]和鱼精蛋白法[15]等。经过预试验,排除了透析法、超滤法、鱼精蛋白法,最终确定尝试葡聚糖凝胶法和离心法。
葡聚糖凝胶法测定甘草次酸脂化乳包封率时,本课题组考察了不同上样量(0.2、0.5、1 mL),以纯水、生理盐水、0.5%十二烷基硫酸钠为洗脱溶剂对脂化乳包封率结果的影响,最终确定上样量为0.5 mL、以生理盐水为洗脱溶剂条件下进行洗脱。结果,以上述最佳条件对葡聚糖凝胶柱进行柱效考察,3次回收率平均值不足80%,表明葡聚糖凝胶柱对甘草次酸脂化乳存在一定吸附。另笔者参考相关文献以低速离心法对甘草次酸脂化乳包封率进行考察[4,13-14],以半径为2 cm,1 000、2 000、3 000、4 000 r/min的转速分别离心5或10 min的条件来处理本品,通过测定离心后上层甘草次酸含药量与未离心甘草次酸脂化乳制剂含药量的差值,计算脂化乳包封率,初步确定最佳离心条件为以半径为2 cm、2 000 r/min的转速离心5 min。以此最佳条件对离心效率进行考察,结果显示离心效率为80%,回收率结果均较低。
这可能是由于油脂的存在,使得脂溶性药物部分以溶解于油相的状态存在,部分包封于脂质层中,而不是脂质体中而导致包封率过低。所以,包封率不适合作为脂化乳的评价指标。
综上所述,初步确定粒径、电位、载药量、稳定性可作为甘草次酸脂化乳的评价指标。
[1] 吴军,张玉良,马卓.脂质体新剂型的研究进展[J].广东化工,2014,41(10):69-70.
[2] 曹健,陆锦芳.眼用制剂的研究进展[J].中国药学杂志,2003,38(3):161-163.
[3] 黄梓源,孙玉琦,胡海洋,等.脂质体制剂学稳定性的研究技术与方法[J].药学学报,2016,51(3):356-361.
[4] 林珈好,王秀丽,曹唯仪,等.甘草次酸-丹参酮ⅡA复方脂质体包封率测定方法研究[J].北京中医药大学学报,2013,36(10):701-704.
[5] 李茵茵,李鲲鹏,李向辉,等.含水纳米材料冷冻电镜直接成像研究[J].电子显微学报,2012,31(4):346-349.
[6] 陈召红,刘皈阳,魏亚超.脂质体包封率测定方法研究进展[J].解放军药学学报,2011,27(1):79-82.
[7] 邵红霞,奉建芳,龙晓英.脂质体包封率的测定方法[J].中南药学,2009,7(3):212-215.
[8] 陈蓓,袁明奎,王建华,等.葡聚糖凝胶柱色谱法测定阿苯达唑纳米脂质体包封率的方法研究[J].中国药房,2012,23(45):4281-4284.
[9] 赵锋,栾瀚森,罗华菲,等.葡聚糖凝胶色谱法用于纳米粒包封率的测定[J].中国药学杂志,2012,47(17):1385-1390.
[10] 李学涛,唐炜,姜英,等.转铁蛋白修饰长春新碱-粉防己碱脂质体中主药含量及包封率的测定[J].中国药房,2016,27(22):3034-3036.
[11] 万胜利,钟萌,赵德璋,等.葡聚糖凝胶柱色谱法测定姜黄素囊泡包封率[J].激光杂志,2015(2):142-144.
[12] 白兰,赵明琴,尹蓉莉,等.龙胆苦苷脂质体含量测定及包封率考察[J].中国实验方剂学杂志,2012,18(7):48-50.
[13] 郑杭生,佐拉·沙肯迪克,王湘林,等.离心沉淀-离心超滤法测定盐酸青藤碱脂质体的包封率[J].中草药,2011,42(8):1523-1527.
[14] 李琅琅,王文喜,牛泱平.低速离心法测定荧光红GG脂质体包封率[J].浙江工业大学学报,2009,37(5):535-537.
[15] 刘卫斌,薛彦宁,秦永刚.鱼精蛋白凝聚法测定和厚朴酚脂质体的包封率[J].中国药房,2010,21(39):3695-3697.
Quality Evaluation and Index Exploration of the Glycyrrhetinic Acid Lipo-emul
JIN Su,LI Shiyuan,ZHANG Xiurong,CHEN Fangning,WANG Xiuli(School of Traditional Chinese Medicine,Beijing University of Chinese Medicine,Beijing 100102,China)
OBJECTIVE:To provide reference indexs for the quality evaluation of Glycyrrhetinic acid lipo-emul.METHODS:Croy-TEM was used to detect the morphology of Glycyrrhetinic acid lipo-emul,laser nano-particle size analyzer was used to determine the particle size,polydispersity index(PDI)and the zeta potential;UPLC was used to determine the drug loading of its active ingredient glycyrrhetinic acid;placing 10 d in 30℃,then stability was detected.RESULTS:Prepared Glycyrrhetinic acid lipoemul was clear outline,structural integrity,roundlike and arranged closely;the mean particle size was(245.2±4.29)nm,PDI was(0.054±0.01)and the mean zeta potential was(-6.25±0.54)mV;the average drug loading of glycyrrhetinic acid was(1.25± 0.09)mg/mL;the sample with mass concentration of 0.82 mg/mL showed good stability in within 10 d.CONCLUSIONS:Particle size,zeta potential,drug loading and stability can be used as the evaluation index of Glycyrrhetinic acid lipo-emul.
Glycyrrhetinic acid lipo-emul;Quality evaluation;Index;Drug loading
R943
A
1001-0408(2017)06-0800-04
2016-10-16
2016-12-12)
(编辑:刘 柳)
国家自然科学基金资助项目(No.81202928)
*硕士研究生。研究方向:中药药剂学。电话:010-84738657。E-mail:Jinsu9010@foxmail.com
#通信作者:副研究员,博士。研究方向:中药复方新型给药系统与新型辅料。E-mail:Lnwangxiuli@163.com
DOI10.6039/j.issn.1001-0408.2017.06.22
