粉末冶金注射成型技术制备的新型血管内支架的动物应用研究
2017-03-29舒畅蔡文武何昊王暾娄嘉李益民
舒畅,蔡文武,何昊,王暾,娄嘉,李益民
(1.中南大学湘雅二医院 血管外科,湖南 长沙 410011;2.中国医学科学院阜外医院 血管外科,北京 100037;3.湘潭大学材料科学与工程学院,湖南 湘潭 411005;4.中南大学粉末冶金国家重点实验室,湖南 长沙 410083)
自Dotter等[1]在1964年首先正式提出经皮腔内血管成形术(percutaneous transluminal angioplasty,PTA)概念以来,因其微创、痛苦小、围手术期并发症发生率低等优势使其已经成为临床上治疗血管疾病的最重要的方法之一。据卫生部统计,我国心血管及周围血管疾病的发病率逐年增高,需要接收心血管手术的患者已达400万例,但全国每年的手术量尚不足4万例。因此,中国是全球最大的支架产品潜在市场,但是由于专利、材料、设计技术以及生产工艺等各方面的限制,绝大多数血管内支架需要从国外进口。这些因素导致临床上血管内支架费用高昂,单枚小动脉支架动辄2~3万,大动脉支架甚至需要上10万。除此之外,支架植入术后血栓形成、管腔再狭窄也是临床上一个棘手的问题,严重影响着术后支架的远期通常率,甚至导致手术失败。有研究[2]报道:早期金属裸支架植入术后的管腔再狭窄率高达30%~63%。因此,研制优质高效经济实用的国产化支架及其附属装置和导入技术是广泛开展我国腔内技术的关键,具有广阔的发展前景和社会效益。
针对此状况,本中心在国内首先提出采用金属粉末冶金注射成型技术制备新型血管内支架,并进行动物实验了解该支架植入术后的通畅率、内皮化速度、理化稳定性、生物相容性以及病理学改变等,从而评估新型血管内支架临床应用的可行性和安全性,为进一步的临床试验及推广应用奠定基础。
1 材料与方法
1.1 新型血管内支架的制备
新型血管内支架采用气雾化316L不锈钢粉末为原料,主要成分包括Fe、Cr、Ni、Mo等在内的多种金属成分。支架整体结构采用双正弦波形开孔设计,支架杆之间交错相连呈菱形排列。这些设计可以最大限度地降低手术过程中因使用球囊反复扩张支架时可能导致支架杆连接处断裂、结构解体等异常情况的几率,从而保持支架结构的稳定性。其生产工艺流程如图1所示。
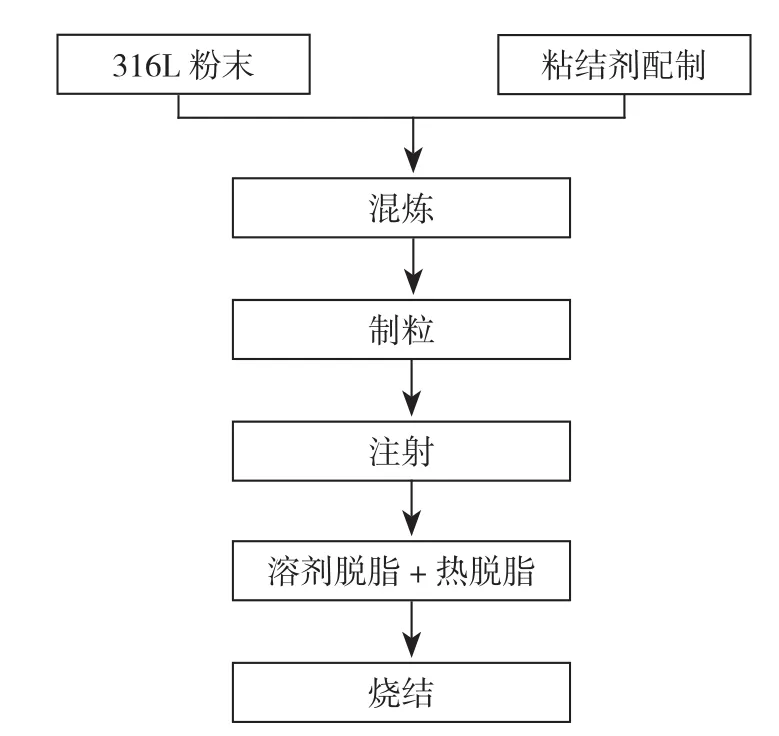
图1 新型血管内支架基本工艺流程Figure 1 Brief technological process of the new intravascular stent
依次经过制备喂料、注射成形、脱脂以及烧结等4道主要工艺,并通过进一步表面及后处理措施,最终成功制备新型血管内支架。支架成品无断裂、无毛刺、无结点等缺陷,表面光洁、无黑点以及杂质等问题,结构稳固。
1.2 实验动物
选取健康杂种犬30只,体质量12~15 kg,平均(13.24±1.68)kg;12~24月龄,雌雄不限。所有的实验犬均饲养在中南大学湘雅二医院动物实验中心,自由进食、饮清洁水,并有饲养员专门负责喂养、清洁卫生,饲养室内温度保持在18~25 ℃,湿度保持在50%~70%。
1.3 实验方法
实验犬接受肌肉注射戊巴比妥钠(30 mg/kg)行全身麻醉后,无菌操作下解剖游离单侧股动脉,静脉推注普通肝素钠(100 U/kg)2 min后,采用Seldinger穿刺法置入10 F鞘管,超滑导丝引导下置入猪尾标记导管至胸主动脉内,手推碘海醇10mL造影,确定待植入新型支架靶血管的位置后撤出猪尾导管,将载有新型血管内支架的球囊导管置入目标位置,充分膨胀球囊(8 atm,1 atm=101.325 kPa)释放新型支架。释放支架后再次扩张球囊持续20 s,再次手推造影明确支架位置,随后撤出导丝及导管,拔出穿刺鞘管,缝合股动脉及伤口。在术后即刻及术后2 h分别对实验犬进行全主动脉CTA检查以了解新型支架植入后的通畅情况,并测量记录支架长度及外径的变化情况,从而了解新型支架的轴向及径向回缩率[3]。
实验犬术后被随机分为5组,每组6只,分别被饲养观察1周及1、2、3、6个月。详细记录在预定观察期内各组实验犬的健康状况、精神状态、饮食活动情况等。术后3 d内,每只实验犬均需接受肌肉注射青霉素钠(160万U/d)预防抗感染治疗。每只实验犬均需喂服阿司匹林片(100 mg/d)及双嘧达莫片(25 mg/d),持续至术后1个月。
1.4 标本收集及处理
在各组实验犬预定的观察期末,全麻及全身肝素化状态下,开胸开腹,将支架段主动脉及其近远端各约1.0cm的主动脉完整取出,测量记录相关数据后,拍照留取影像资料。沿着支架长轴小心纵行剖开,仔细观察支架表面新生内膜生长爬行情况,有无附壁血栓及局部内膜异常增厚等情况。取支架表面部分新生内膜组织及支架段血管壁置于10%福尔马林溶液固定后行光镜观察,部分新生内膜组织置于2.5%戊二醛溶液中固定后行透射电镜观察,并取部分新生内膜组织进行免疫组织化学研究。
1.5 统计学处理
将所有的实验数据输入到SPSS 17.0统计软件包进行统计处理。计量资料均采用均数±标准差表示。实验数据均先行描述性统计分析,两组间实验数据比较采用两独立样本t检验进行统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1 支架植入一般情况
共30枚新型血管内支架均被成功植入到30只实验犬主动脉内(1枚/只)。实验犬均健康存活至预定的观察期末,无主动脉穿孔、破裂出血或主动脉夹层、主动脉瘤以及假性动脉瘤形成等异常情况。新型血管内支架在实验犬体内形态良好,通畅率100%;无支架移位、扭曲、断裂、支架感染及支架内血栓形成;管腔无狭窄或闭塞。支架段主动脉与周围组织无明显粘连,主动脉周围未发现肿大淋巴结等慢性炎症改变。
2.2 新型血管内支架轴向及径向回缩率
新型血管内支架被植入到实验犬主动脉内后,全主动脉CTA检查显示:支架位置良好,无移位、塌陷、扭曲、断裂、解体等;管腔通畅,无狭窄(图2)。术后各时间点测量支架长度以及外径数据如下表(表1),经计算得知:新型血管内支架的轴向回缩率均<2%,径向回缩率均<4%。
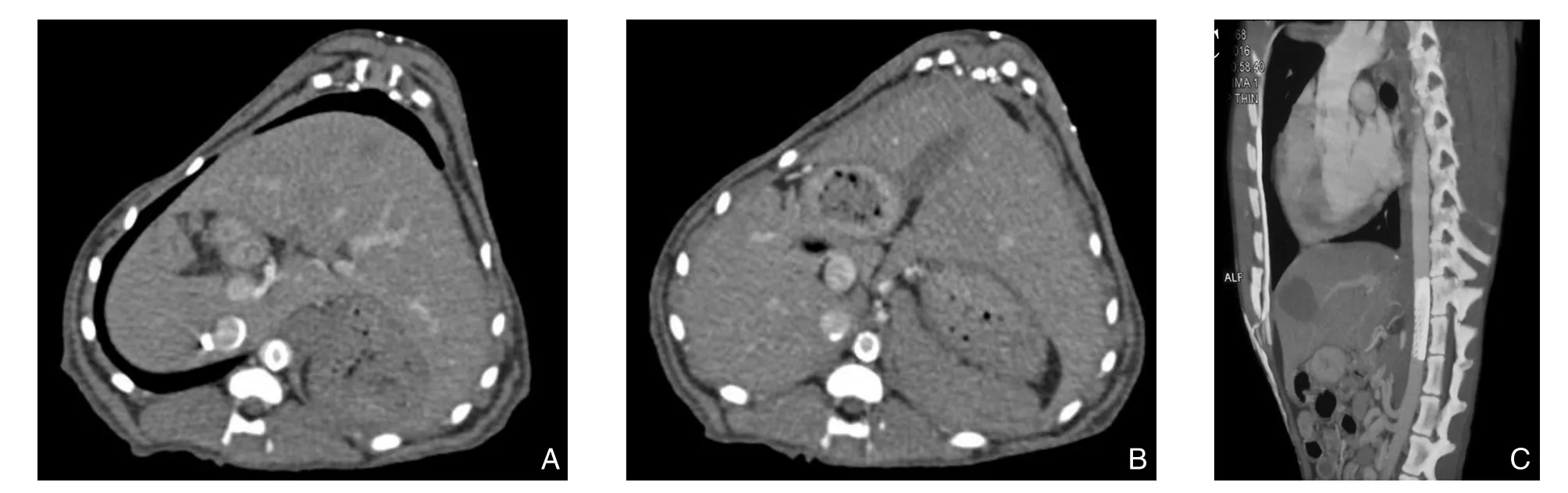
图2 实验犬手术后行全主动脉CTA的结果 A:横断面主动脉内血管支架近心端;B:横断面主动脉内血管支架远心端;C:矢状面主动脉内血管支架全貌Figure 2 Images whole aorta CTA of the experimental dog A: Transverse section of the proximal end of the intravascular stent;B: Transverse section of the distal end of the intravascular stent; C: Sagittal plane of full view of the intravascular stent
表1 血管支架的轴向回缩率和径向回缩率情况(±s)Table 1 The longitudinal and radial shrinkage rates of the stents ±s)
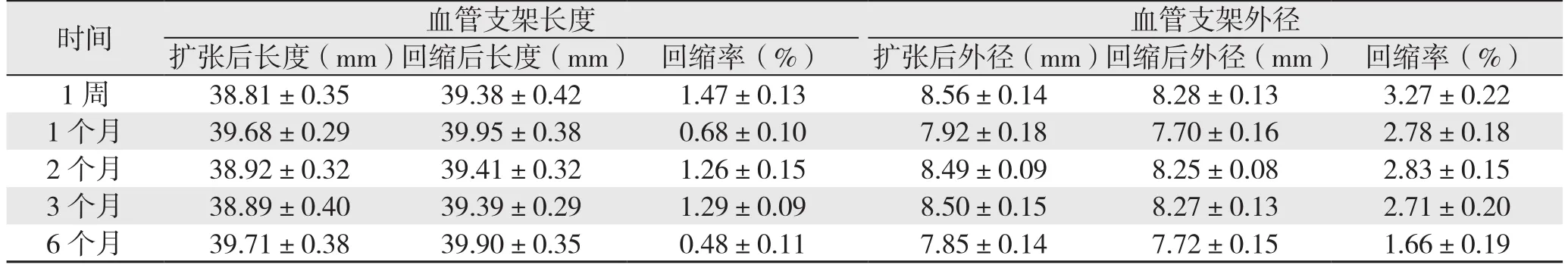
表1 血管支架的轴向回缩率和径向回缩率情况(±s)Table 1 The longitudinal and radial shrinkage rates of the stents ±s)
时间 血管支架长度 血管支架外径扩张后长度(mm)回缩后长度(mm) 回缩率(%) 扩张后外径(mm)回缩后外径(mm) 回缩率(%)1 周 38.81±0.35 39.38±0.42 1.47±0.13 8.56±0.14 8.28±0.13 3.27±0.22 1 个月 39.68±0.29 39.95±0.38 0.68±0.10 7.92±0.18 7.70±0.16 2.78±0.18 2 个月 38.92±0.32 39.41±0.32 1.26±0.15 8.49±0.09 8.25±0.08 2.83±0.15 3 个月 38.89±0.40 39.39±0.29 1.29±0.09 8.50±0.15 8.27±0.13 2.71±0.20 6 个月 39.71±0.38 39.90±0.35 0.48±0.11 7.85±0.14 7.72±0.15 1.66±0.19
2.3 支架表面新生内膜情况
2.3.1大体病理新型血管内支架植入到实验犬主动脉内后,其表面迅速被一层新生内膜覆盖。各组实验犬支架表面新生内膜爬行面积、内膜厚度以及管腔内径变化情况如下(表2)。
表2 实验犬支架表面新生血管内膜情况(±s)Table 2 Neointimal formations in the luminal surface of the stent ±s)
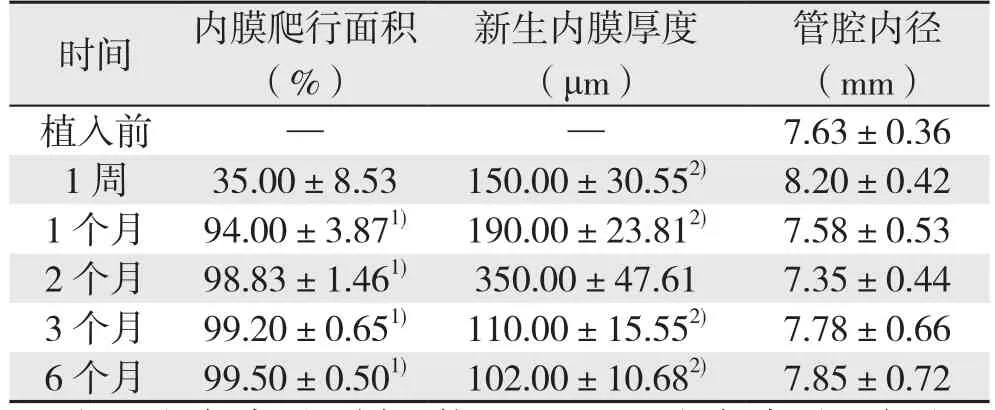
表2 实验犬支架表面新生血管内膜情况(±s)Table 2 Neointimal formations in the luminal surface of the stent ±s)
注:1)与术后1周比较,P<0.05;2)与术后2个月,P<0.05Note: 1) P<0.05 vs.postoperative one-week value; 2) P<0.05 vs.postoperative two-month value
时间 内膜爬行面积(%)管腔内径(mm)植入前 — — 7.63±0.36 1 周 35.00±8.53 150.00±30.552) 8.20±0.42 1 个月 94.00±3.871) 190.00±23.812) 7.58±0.53 2 个月 98.83±1.461) 350.00±47.61 7.35±0.44 3 个月 99.20±0.651) 110.00±15.552) 7.78±0.66 6 个月 99.50±0.501) 102.00±10.682) 7.85±0.72新生内膜厚度(μm)
术后1周,支架部分表面被一薄层半透明膜状结构覆盖,无血栓形成,管腔内径较植入前主动脉内径增宽致。术后1个月,支架绝大部分表面已经形成一层光滑透明状的,与周围正常的血管内膜相延续的新生内膜。从术后2个月开始及以后各组,可以观察到一层新生内膜基本上已经完整覆盖整个支架表面,彻底隔绝血液成分与金属支架直接接触。随着植入时间的延长,支架表面新生内膜厚度逐渐增加,至术后2个月,其厚度达到峰值,管腔内径最小。随后,随着新生内膜的结构重塑,其厚度又逐渐降低,管腔内径又逐渐增大,至术后3个月,支架表面新生血管内膜厚度及管腔内径不再发生明显变化。
2.3.2光镜观察新型血管内支架均展开良好,部分支架丝深陷进主动脉壁内。术后1周,新生内膜成分主要是纤维蛋白、血小板以及红细胞,偶见不成熟的内皮细胞附着,并可见散在吞噬含铁血黄素的肥大巨噬细胞增生,无炎性细胞浸润。术后1个月,新生内膜表层为多层形态各异的尚未完全成熟的内皮细胞,可见大量血管平滑肌细胞和纤维结缔组织增生,并有少许吞噬含铁血黄素的肥大巨噬细胞增生,无炎性细胞浸润。术后2、3个月,新生内膜表层为多层完全成熟的、呈梭形或是纺锤状的内皮细胞,可见有大量血管平滑肌细胞以及纤维结缔组织增生,同样可见吞噬含铁血黄素的肥大巨噬细胞增生,无炎性细胞附着。术后6个月,新生内膜表层为单层完全成熟的内皮细胞,其余新生内膜情况较3个月组无明显差异(图3)。
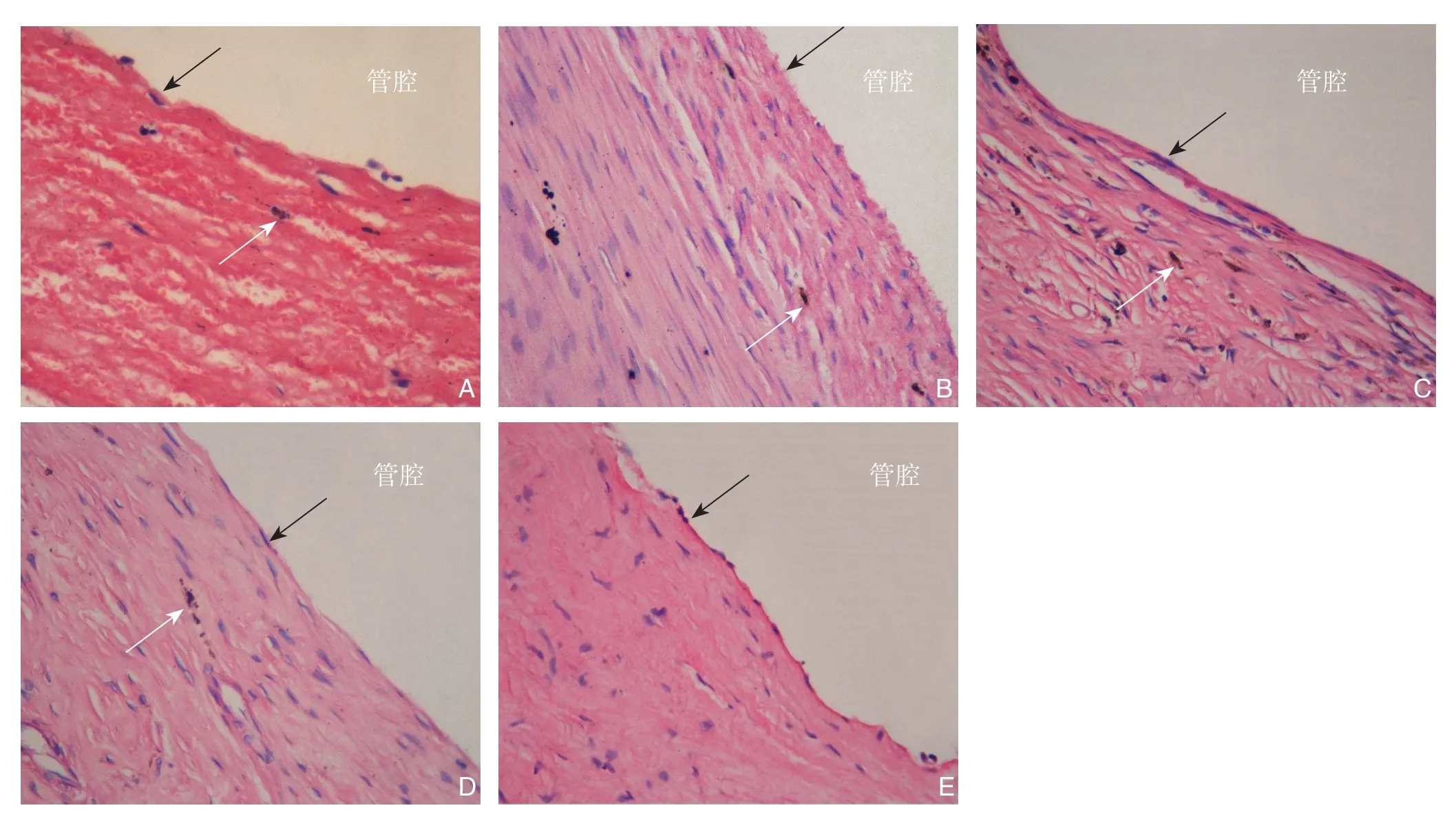
图3 支架表面新生血管内膜光镜观察(HE×400;黑色箭头示内皮细胞,白色箭头示含铁血黄素巨噬细胞) A:术后1周;B:术后1个月;C:术后2个月;D:术后3个月;E:术后6个月Figure 3 Light microscopic observation of the neointima in the luminal surface of the stent (HE×400; black arrow showing the endothelial cells,white arrow showing the phagocytes containing granules of hemosiderin) A: Postoperative one week;B: Postoperative one month; C: Postoperative two months; D: Postoperative three months; E: Postoperative three months
术后1周,支架表面新生内膜组织中可见散在不成熟的内皮细胞,形态各异,细胞核肿大且突出,内皮细胞排列杂乱无规律性;术后1个月,支架表面新生内膜组织中的纤维蛋白、血小板及红细胞已被多层尚不成熟的内皮细胞所取代,内皮细胞大致呈多角形、梭形或是不规则形状,排列尚无规律性,大部分随血流方向排列一致,部分区域细胞排列较紊乱,细胞间多为紧密连接;随着植入时间延长,术后2、3个月,支架表层多层内皮细胞已经完全成熟,内皮细胞呈梭形或是纺锤形,沿着血流方向排列,细胞间为紧密连接;随着支架表面新生血管内膜组织不断进行结构重塑,术后6个月,其表层已经形成单层完全成熟的内皮细胞,内皮细胞呈梭形或是纺锤状循着血流方向排列一致,内皮细胞间为紧密连接。
另外,除了1周组外,其余4组支架表面新生内膜组织中均可观察到大量呈梭形的血管平滑肌细胞增生,并且伴有纤维结缔组织沉积(图4)。
2.3.3免疫组织化学非定量分析支架表面新生内膜组织行免疫组化研究发现:除了1周组外,其余4组支架表面新生内膜组织中血管平滑肌细胞(VSMC)α-肌动蛋白染色均呈阳性,主要表现为细胞浆被染色为明显的棕黄色,而细胞核则被染色为蓝色,其中2个月组实验犬的阳性染色最为明显(图5A)。另外,5组实验犬支架表面新生内膜组织中血管内皮生长因子(VEGF)染色均呈阳性,主要表现为细胞浆被染色为深棕黄色,而细胞核被染色为蓝色,在新生内膜增生较严重处表现最明显(图5B)。上述结果表明血管平滑肌细胞及血管内皮生长因子参与了支架表面新生内膜的形成,在支架表面的内皮化过程中起着重要作用。
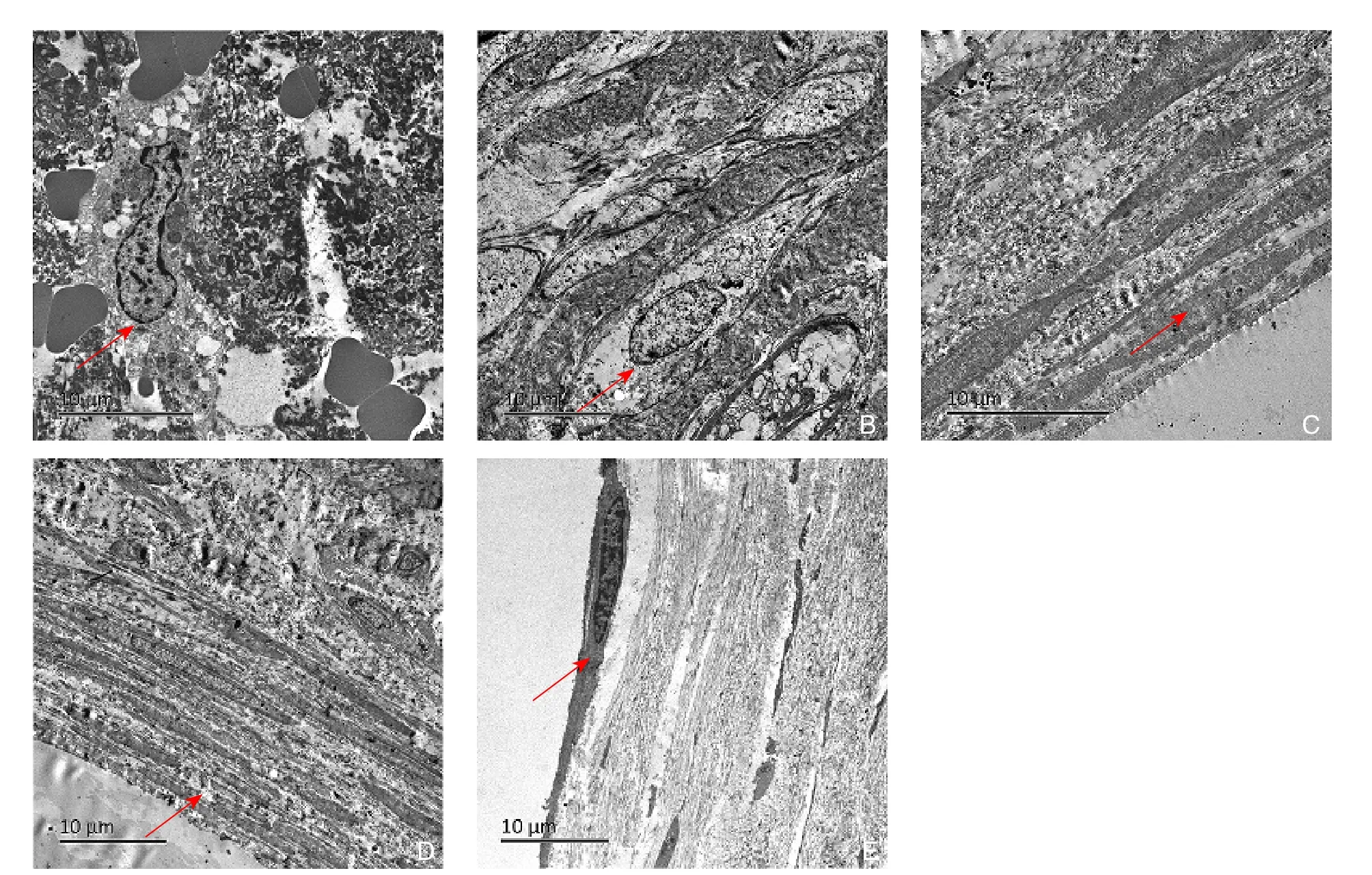
图4 血管支架表面新生血管内膜透射电镜观察(箭头示内皮细胞) A:术后1周;B:术后1个月;C:术后2个月;D:术后3个月;E:术后6个月Figure 4 Transmission electron microscopic observation of the neointima in the luminal surface of the stent (arrow showing the endothelial cells) A: Postoperative one week; B: Postoperative one month; C: Postoperative two months; D: Postoperative three months; E: Postoperative three months

图5 免疫组化染色结果(×400) A:VSMC-α-肌动蛋白;B:VEGFFigure 5 Results of immunohistochemical staining (×400) A: VSMC-α-actin; B: VEGF
3 讨 论
3.1 新型血管内支架独特的结构优势
目前在临床上应用的传统血管内支架多采用金属丝编织技术或激光镂刻技术制备而成。这两种生产制备工艺均具有制作成本高、设备投资大、周期长等缺陷,而且设计制备工艺等核心技术多被国外医药科技公司掌控。除此之外,金属丝编织工艺制备的血管内支架具有较多凸出结点,植入后血栓形成几率较高;而激光切割工艺制备的血管内支架边缘粗糙、毛刺多,精度及光洁度等关键性能较差,需要更多的后处理措施。针对于此,笔者在国内外首先提出采用金属粉末冶金注射成型技术制备新型血管内支架。和目前在临床上应用的传统血管内支架相比,新型血管内支架具有的优势在于:先天无结点,因而其被植入到机体内后,血栓形成的几率更小,从而显著降低术后管腔再狭窄的概率;其次新型血管内支架具有丝径细小的特点,能有效降低支架金属覆盖面积,从而大大降低支架植入术后血栓形成的几率[4]。此外这种技术采用模具量产的工艺,自动化程度高,产量大,还能大大减低了制作过程中对支架材料的浪费,从而显著地降低支架临床价格;同时易于根据临床需求需要更换外形设计,其在大批量制备小型、复杂形状的血管支架方面也具有其他生产工艺所无法比拟的优势,能够满足普通患者的需求,具有良好的临床应用前景。
3.2 新型血管内支架理化稳定性和生物相容性评价
3.2.1新型血管内支架理化稳定性评价本研究中,通过手捏法将新型血管内支架径向压缩、固定在球囊导管上,术中无1例出现支架脱落,并且通过球囊扩张能够将支架顺利达到预先设定的直径,且术后支架均能保持通畅,说明了新型血管内支架具有良好的几何顺应性,这种特性可以减轻新型支架植入到机体内后对靶血管壁本身正常的舒缩功能的影响。其次,新型血管内支架在实验犬主动脉内均保持良好的通畅性,无管腔内血栓形成、狭窄以及闭塞等问题;术后3个月支架内径和植入前血管内径相比已无明显差异;全主动脉CTA测量得知新型支架的径向回缩率<4%。这些均说明新型血管内支架具有良好的径向支撑力,可以满足机体病变血管所需的足够的径向支撑强度。值得一提的是植入新型血管内支架的实验犬均健康存活至预定的观察期末,在整个观察期内没有出现支架结构断裂、扭曲、解体等现象,无主动脉破裂出血、主动脉夹层或主动脉瘤、假性动脉瘤形成等问题,这些都说明新型血管内支架具有良好的结构稳定性。
3.2.2新型血管支架生物相容性评价本研究采用的新型血管内支架选用316L不锈钢粉末制作而成。之前已有研究[5]以及多年临床应用表明:316L不锈钢在生物体内具有良好的生物相容性。本研究结果发现支架植入后无急性血栓形成,支架所在段主动脉壁无炎症、坏死以及异物反应等,无炎性细胞浸润;支架植入后1个月,表面已经被一层基本完整的与周围正常血管内膜相互延续的新生内膜组织覆盖,从而确保新型支架能够长时间保持通畅。植入2个月后,支架所在段主动脉壁各层形态及结构均已经恢复正常,支架已和主动脉壁完美地“融为一体”。这些均证明了新型血管内支架具有良好的生物相容性。此外,所有的实验犬在整个实验观察期间没有出现血液系统疾病、肿瘤以及明显的精神状态异常等问题,均健康存活至预定的观察期末,这些均说明新型血管内支架无明显毒性作用。
3.3 新型血管内支架表面新生内膜机制的探讨
支架植入后管腔再狭窄是临床上一个棘手的问题[6]。国内有学者[7-8]研究认为:术后支架管腔再狭窄是由术中球囊扩张以及支架植入共同作用引起靶血管壁损伤,从而导致机体产生过度修复反应的结果。受损的血管内膜以及中膜在炎性因子、内皮细胞生长因子以及血小板活性因子的作用下出现增殖、迁移,还有大量的血小板以及细胞外基质等在受损伤部位堆积,从而导致术后支架管腔再狭窄[9-11]。因此得出结论:术后支架管腔再狭窄几乎全部是因为血管内膜过度增生所致。这种增生反应和支架下方的斑块数量、内弹力层断裂以及支架展开时引起的局部血管壁损伤等因素相联系。本研究中,VSMC-α-肌动蛋白免疫组化染色结果证实VSMC参与了支架表面新生内膜的形成,光镜及透射电镜下可观察到大量VSMC也印证了这点。这些实验结果与国内外的相关文献研究报道一致。此外,免疫组织化学研究发现2个月组实验犬支架表面的VSMC-α-肌动蛋白染色最为明显,考虑其原因可能是此组实验犬中膜VSMC向支架表面新生血管内膜中迁移、增殖达到最高峰,这与2个月组实验犬支架表面的新生血管内膜厚度达到峰值相吻合。在最终的实验结果中,我们并没有发现有新生内膜过度增生致管腔狭窄的问题,充分证实了新型血管内支架良好的性能。除此之外,支架表面新生内膜组织的免疫组化研究结果显示VEGF染色阳性,且其在内膜增生较严重处表达最明显,这些充分说明了VEGF参与了新生血管内膜的形成,在支架表面内皮化的过程中发挥着重要的作用。实验结果与国内外相关研究文献[12-14]结果一致,但是VEGF是否确定能够减少新生血管内膜厚度和壁内血栓形成,本实验无法证实,还需要进一步相关研究。
本研究中,新型血管内支架植入术后,仅采取阿司匹林片和双嘧达莫片祛聚治疗,未采取任何促进支架表面内皮化措施的情况下,支架表面迅速被一层新生内膜覆盖;光镜以及透射电镜观察结果显示:术后2个月左右,支架表面已经形成完全成熟的内皮细胞,而到术后6个月左右,支架表面已经形成单层内皮细胞覆盖的结构基本成熟的血管内膜。考虑其原因主要是因为新型血管内支架无结点、具有更小的金属覆盖率以及多孔结构,这种独特的结构可以最大限度地降低支架植入术后血栓形成的几率,并有利于支架周围血管内皮细胞生长爬行,再加上来自于循环血液中的多潜能干细胞在支架表面的沉积,诸多因素共同促进了新型血管内支架表面迅速地完成内皮化[15-16]。
采用金属注射成形法制备了新型血管支架,支架形状复杂,力学性能高,表面光洁度高,可以满足植入的需求。新型血管内支架植入后实验犬体内后形态结构稳定,并可迅速完成支架表面内皮化,保持长期的通畅性,表现出良好的结构及理化稳定性和生物相容性,具有很好的临床应用前景。
[1]Dotter CT,Judkins MP.Percutaneous transluminal treatment of arteriosclerotic obstruction[J].Radiology,1965,84:631–643.
[2]de Jaegere PP,Serruys PW,Bertrand M,et al.Wiktor stent implantation in patients with restenosis following balloon angioplasty of a native coronary artery[J].Am J Cardiol,1992,69(6): 598–602.
[3]YY/T 0663–2008,无源外科植入物、心脏和血管植入物的特殊要求、动脉支架的专用要求[S].2009–06-01.YY/T 0663–2008,Non active surgical implants-Particular requirements for cardiac and vascular implants-Specific requirement for arterial stents[S].2009–06-01.
[4]McLean DR,Eiger NL.Stent design: implications for restenosis[J].Rev Cardiovasc Med,2002,3(Suppl 5):S16–22.
[5]赵振心,刘道志,张一.血管支架材料及其临床研究进展[J].中国医疗器械杂志,2005,29(6):391–395.Zhao ZX,Liu DZ,Zhang Y.Research Progresses in Endovascular Stent Biomaterials[J].Chinese Journal of Medical Instrumentation,2005,29(6):391–395.
[6]De Luca G,Suryapranata H,Marino P.Reperfusion strategies in acute ST-elevation myocardial infarction: an overview of current status[J].Prog Cardiovasc Dis,2008,50(5):352–382.doi: 10.1016/j.pcad.2007.11.004.
[7]王俊杰,周旭晨,方唯一.大连DW冠状动脉支架的动物实验研究[J].海南医学,2004,15(3):74–78.Wang JJ,Zhou XC,Fang WY.The Animal Experiment Study of Da Lian DW Coronary Stent[J].Hainan Medical Journal,2004,15(3):74–78.
[8]Edelman ER,Rogers C.Pathobiologic responses to stenting[J].Am J Cardiol,1998,81(7A):4E-6E.
[9]Inoue T,Croce K,Morooka T,et al.Vascular inflammation and repair: implications for re-endothelialization,restenosis,and stent thrombosis[J].JACC Cardiovasc Interv,2011,4(10):1057–1066.doi: 10.1016/j.jcin.2011.05.025.
[10]Maffia P,Grassia G,Di Meglio P,et al.Neutralization of interleukin-18 inhibits neointimal formation in a rat model of vascular injury[J].Circulation,2006,114(5):430–437.
[11]吴元兵,朱云峰,葛红卫,等.下肢动脉硬化闭塞症腔内治疗后支架内再狭窄的治疗[J].中国普通外科杂志,2015,24(12):1687–1690.doi:10.3978/j.issn.1005–6947.2015.12.010.Wu YB,Zhu YF,Ge HW,et al.Management of in-stent restenosis in lower limb arteriosclerosis obliterans after endovascular treatment[J].Chinese Journal of General Surgery,2015,24(12):1687–1690.doi:10.3978/j.issn.1005–6947.2015.12.010.
[12]Gaffney MM,Hynes SO,Barry F,et al.Cardiovascular gene therapy: current status and therape-utic potential[J].Br J Phormocol,2007,152(2):175–188.
[13]郭兴友,包文.严重肢体缺血的干细胞治疗研究进展.中国普通外科杂志,2012,21(6):721–724.Guo XY,Bao W.Advances in stem cell therapy for critical limb ischemia[J].Chinese Journal of General Surgery,2012,21(6):721–724.
[14]魏立春,侯培勇,李祺熠,等.自体移植静脉再狭窄基因水平的研究进展[J].中国普通外科杂志,2013,22(6):766–770.doi:10.7659/j.issn.1005–6947.2013.06.021.Wei LC,Hou PY,Li QY,et al.Stenosis of autogenous vein graft:processes at the gene level[J].Chinese Journal of General Surgery,2013,22(6):766-770.doi:10.7659/j.issn.1005-6947.2013.06.021.
[15]Shi Q,Wu MH,Hayashida N,et al.Proof of fallout endothelialization of impervious Dacron grafts in the aorta and inferior vena cava of the dog[J].J Vasc Surg,1994,20(4):546–556.
[16]Rotmans JI,Heyligers JM,Stroes ES,et al.Endothelial progenitor cell-seeded grafts: rash and risky[J].Can J Cardiol,2006,22(13):1113–1116.
