TNF-α对兔胆管成纤维细胞P311/TGF-β1/α-SMA通路的影响及川芎嗪的干预作用
2017-03-29李克跃石承先汤可立刘振华黎涛张帅民徐贤刚
李克跃,石承先,汤可立,刘振华,黎涛,张帅民,徐贤刚
(1.天津医科大学研究生院,天津 300070;2.贵州省人民医院 肝胆外科,贵州 贵阳 550002)
良性胆道狭窄(benign biliary stricture,BBS)是由于胆道损伤、复发性胆管炎、肝移植等病因导致的胆管腔疤痕性缩窄[1]。近年来,随着腹腔镜胆囊切除及肝移植等腹部手术的开展,BBS的发病率逐渐增高,有报道[2-4]显示腹腔镜胆囊切除及肝移植引起的BBS发病率分别为0.2%~0.7%及3%~13%。BBS常表现为胆道压力增高、胆管炎反复发作、肝功能衰竭等并发症,严重威胁患者健康及生命。研究[5-7]发现胆管成纤维细胞(fibroblast,FB)大量增殖并转化为表现α-平滑肌动蛋白(α-smooth muscle actin,α-SMA)阳性的肌成纤维细胞(myofibroblast,MFB)、成纤维细胞功能异常是导致胆管疤痕挛缩及BBS形成的主要原因;转化生长因子β1(transforming growth factor β1,TGF-β1)是诱导成纤维细胞转化为肌成纤维细胞的关键刺激因素,是与胆管疤痕及BBS形成最重要、最直接的因素。笔者[8]的前期研究发现P311等基因在BBS模型胆管成纤维细胞中的表达明显增高,提示P311基因在BBS形成过程中可能发挥了重要作用。BBS的治疗核心是解除胆道梗阻,外科手术,内镜引流及介入治疗是目前治疗BBS的主要方式,但它们均有一定的并发症及病死率[1]。药物是治疗疤痕的方式之一,但令人遗憾的是目前尚缺乏一种可靠、特效的药物用于临床[9]。肿瘤坏死因子α(tumor necrosis factor α,TNF-α)是一种重要的免疫及炎症介质,在组织损伤后迅速升高,在组织损伤修复的炎症反应阶段具有重要的调节作用[10]。与正常皮肤相比,疤痕组织及其成纤维细胞的TNF-α mRNA及蛋白表达均明显增高,提示TNF-α可能在皮肤疤痕形成的病理过程中发挥了重要作用[11-12]。笔者[8]前期的研究发现中药单体川芎嗪(tetramethylpyrazine,TMP)能下调BBS模型胆管成纤维细胞中P311及TGF-β1等基因的表达,并且能抑制BBS模型胆管成纤维细胞的增殖,提示TMP可能在抑制BBS形成过程中发挥了重要作用。但TNF-α在胆管疤痕修复及BBS形成过程中的作用尚不清楚,TMP对TNF-α处理的胆管成纤维细胞的作用也不清楚。本研究对TNF-α诱导的兔胆管成纤维细胞使用不同浓度的TMP进行干预,观察细胞增殖水平及P311/TGF-β1/α-SMA通路表达的变化,现汇报如下。
1 材料与方法
1.1 材料
UNIQ-10柱式TRIZOL总RNA提取试剂盒、反转录试剂盒、α-SMA引物、β-Actin引物、Trizol、CCK-8细胞计数盒、胎牛血清、DMEM(高糖型)、全蛋白提取试剂盒(上海生工生物工程有限公司);TGF-β1及P311引物(上海Introgen公司);P311上游引物序列为:5'-TAA TAA ATG CCC TCT GAA AAA GCC A-3',下游引物序列为:5'-GGA GCA AGG ACA AAA GTG TAA AAT C-3';TGF-β1上游引物序列为:5'-GGC TCA CCT TCT GCC CGT CT-3',下游引物序列为:5'-GTC TCG GTA TCC CAC GAA AGA AAC G-3';α-SMA上游引物序列为:5'-GCT GTC CCT CTA TGC CTC TG-3',下游引物序列为:5'-TAG CCA CGC TCA GTC AGG AT-3';β-Actin上游引物序列为:5'-CTC TCC ACC TTC CAG CAG AT-3',下游引物序列为:5'-TGG CTC TAA CAG TCC GCC TA-3';抗-TGFβ1多克隆抗体(ab99562)、抗-α-SMA单克隆抗体(ab7817)(英国abcam公司);抗-Vimentin单克隆抗体(V2258)、抗-cytokeratin单克隆抗体(C-1801)、PVDF膜(美国sigma公司);抗-β-Actin单克隆抗体、HRP标记的第二抗体(北京全式金生物技术有限公司);ECL发光试剂盒(美国Millipore公司);SYBR®Premix Ex Taq™(Tli RNaseH Plus)(大连宝生物工程有限公司);DAPI(瑞士Roche公司);盐酸川芎嗪注射液(北京四环科宝制药有限公司,批号14032015);TNF-α(sigma,T7539,USA);家兔2只(购自贵州医科大学实验动物中心)。
1.2 家兔胆管成纤维细胞的获取及鉴定
清洁级家兔2只,术前12 h禁食,分笼饲养,动物的饲养在贵州医科大学实验动物中心进行。2.5%戊巴比妥钠溶液(40~45 mg/kg)静脉注射麻醉,取上腹部正中切口,长4~6cm,逐层切开皮肤皮下组织,取出长约2cm胆总管后用深麻醉处死动物,逐层关腹。胆管组织用无菌PBS清洗3次后剪为约2~3 mm3大小,将组织转移到25cm2培养瓶中放入37 ℃、5% CO2的培养箱中干燥贴壁4 h,加入少许含20%(v/v)胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的DMEM培养液进行培养[13-14]。使用差速贴壁法分离纯化成纤维细胞(将消化后的细胞悬浮液以1:3传代,30 min后除去未贴壁的细胞,加入新培养液继续生长,直到细胞全部为成纤维细胞),细胞生长至80%~90%融合时传代。选择第3代的成纤维细胞进行细胞鉴定。实验所用细胞为第3~5代成纤维细胞。使用细胞免疫荧光法检测波形蛋白[13]、细胞角蛋白[15]抗体的表达进行成纤维细胞的鉴定。
1.3 实验分组及各组细胞的处理
实验分为正常胆管成纤维细胞组(空白对照组);正常胆管成纤维细胞+TNF-α 30 ng/mL处理组(TNF-α组);正常胆管成纤维细胞+TNF-α 30 ng/mL+3个不同浓度TMP(0.08、0.4、2.0 mg/mL)mg/mL处理组(低、中、高浓度TMP组)。各组细胞经细胞消化后,转移到6孔板(细胞增殖测定用96孔板),调整细胞密度为2×105/孔(细胞增殖测定2×104/孔),用含10%FBS的培养基培养4 h后改为不含FBS的培养基饥饿过夜,根据不同的分组加用含有对应浓度药物的培养基在37 ℃、5% CO2培养箱分别培养48 h。
1.4 观察指标及测定方法
1.4.1成纤维细胞的鉴定采用细胞免疫荧光法。取第3代处于对数期生长期细胞,胰酶消化细胞,细胞计数后按照2×105/孔均匀接种至带有玻璃片的六孔板中,24 h后进行免疫荧光操作,具体步骤如下:4%多聚甲醛固定15min;0.1%的Triton-100孵育10 min;10%山羊血清封闭30 min;第一抗体4 ℃孵育过夜;第二抗体室温孵育30 min;滴加稀释的DAPI(l:100);荧光显微镜下观察并且拍照;阴性对照以PBS代替第一抗体。
1.4.2成纤维细胞增殖的测定用CCK-8法,具体按CCK-8说明书进行。接种成纤维细胞于96孔板,调整细胞为2×104/孔,每孔体积为100 µL,做5个复孔。细胞在37 ℃、5% CO2培养箱培养24 h后根据分组加入对应的培养基分别培养48 h,每孔加入10 µL CCK-8试剂培养2.5h,在酶标仪上450 nm波长处测定每个孔的光密度值(OD值),采用扣除本底策略来消除误差。
1.4.3P311、TGF-β1及α-SMA mRNA的表达 用Real-time PCR方法检测。分别将各组细胞提取总RNA,选择纯度好、完整性高的RNA合成cDNA。设置real-time PCR反应体系为20 µL,其中上、下游引物各 0.8 µL,2×SYBRRPremix 10µL,样品cDNA 2 µL,ROX Reference Dye(50×)0.4 µL,双蒸水6 µL,每个样品重复3次。PCR反应条件为:95℃ 30 s,然后进行40个扩增循环(95 ℃ 5 s,60 ℃ 30 s)。采用 ABI Stepone software v2.3实时荧光定量PCR系统采集并分析结果,以β-actin为内参,溶解曲线为单峰表示引物特异性好,采用2-△△Ct方法计算目的基因的相对表达量。
1.4.4TGF-β1及 α-SMA蛋白的表达用Western blot方法检测。分别提取各组细胞总蛋白,用BCA法测定蛋白浓度,放置蛋白于聚丙烯酰胺凝胶中进行电泳,进行PVDF转膜后以封闭液给予封闭,按1:5 000稀释目的蛋白的一抗,在4 ℃冰箱内孵育过夜后用TBST在摇床上洗PVDF膜3次。按1:5 000稀释二抗,在室温下振荡孵育2 h,以TBST清洗PVDF膜3次。电化学发光后用显影和定影方法对胶片进行扫描,用β-actin为内参,以Quantity one系统分析目的条带的相对灰度值。实验重复3次。
1.5 统计学处理
2 结 果
2.1 成纤维细胞的鉴定
镜下可见原代培养的胆管成纤维细胞呈不规则三角形,随后逐渐变为梭形的单个核细胞,为成纤维样细胞。第3代成纤维细胞波形蛋白细胞免疫荧光阳性,角蛋白细胞免疫荧光阴性,符合成纤维细胞的特点(图1)。

图1 兔成纤维细胞的鉴定(×100) A:波形蛋白阳性;B:细胞角蛋白阴性Figure 1 Identi fi cation of rabbit bile duct fi broblasts (×100)A: Positive vimentin expression; B: Negative cytokeratin expression
2.2 各组细胞增殖水平检测
与空白对照组比较,TNF-α处理的胆管成纤维细胞的增殖(OD)明显增加(均P<0.05),使用不同浓度的TMP干预后,TNF-α诱导的胆管成纤维细胞增殖被明显抑制,并呈浓度依耐趋势,中、高浓度TMP的抑制作用有统计学意义(均P<0.05)(表1)。
表1 各组细胞增殖情况(±s)Table 1 Proliferation in cells of each group (±s)

表1 各组细胞增殖情况(±s)Table 1 Proliferation in cells of each group (±s)
注:1)与空白对照组比较,P<0.05;2)与TNF-α组比较,P<0.05Note: 1) P<0.05 vs.blank control group; 2) P<0.05 vs.TNF-α group
组别 OD空白对照组 0.331±0.005 TNF-α 组 0.390±0.0081)低浓度TMP组 0.376±0.0041)中浓度TMP组 0.364±0.0091),2)高浓度TMP组 0.352±0.0041),2)
2.3 各组细胞P311、TGF-β1及α-SMA mRNA表达检测结果
与空白对照组比较,TNF-α处理的胆管成纤维细胞中P311、TGF-β1、α-SMA mRNA表达较明显上调(均P<0.05),使用不同浓度的TMP干预后,TNF-α诱导的胆管成纤维细胞中P311、TGF-β1、α-SMA mRNA表达上调被不同程度的抑制,并呈浓度依耐趋势,中、高浓度TMP的抑制作用有统计学意义(均P<0.05)(表2)。
表2 各组细胞P311、TGF-β1及α-SMA mRNA表达水平(±s)Table 2 Expression levels of P311,TGF-β1 and α-SMA mRNA±s)
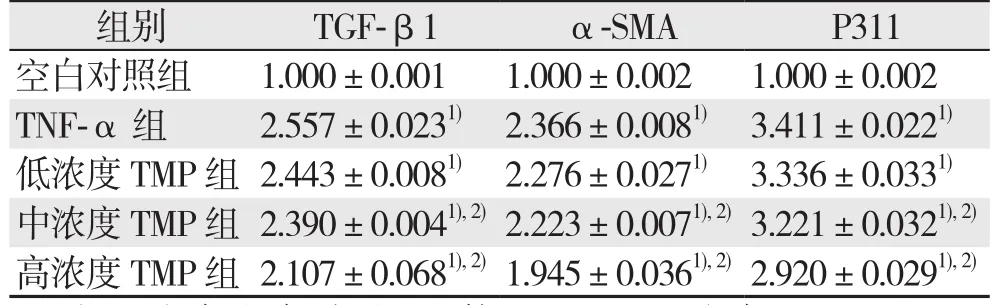
表2 各组细胞P311、TGF-β1及α-SMA mRNA表达水平(±s)Table 2 Expression levels of P311,TGF-β1 and α-SMA mRNA±s)
注:1)与空白对照组比较,P<0.05;2)与TNF-α组比较,P<0.05Note: 1) P<0.05 vs.blank control group; 2) P<0.05 vs.TNF-α group
组别 TGF-β1 α-SMA P311空白对照组 1.000±0.001 1.000±0.002 1.000±0.002 TNF-α 组 2.557±0.0231) 2.366±0.0081) 3.411±0.0221)低浓度TMP组 2.443±0.0081) 2.276±0.0271) 3.336±0.0331)中浓度TMP组 2.390±0.0041),2)2.223±0.0071),2)3.221±0.0321),2)高浓度TMP组 2.107±0.0681),2)1.945±0.0361),2)2.920±0.0291),2)
2.4 各组细胞TGF-β1及α-SMA蛋白表达检测结果
与空白对照组比较,TNF-α处理的胆管成纤维细胞中TGF-β1与α-SMA蛋白表达明显上调,使用不同浓度的TMP干预后,TNF-α诱导的胆管成纤维细胞的TGF-β1与α-SMA蛋白表达上调受到不同程度的抑制,并呈浓度依耐趋势,中、高浓度TMP的抑制作用有统计学意义(均P<0.05)(图2)(表3)。

图2 Western blot检测结果Figure 2 Results of Western blot analysis
表3 各组细胞TGF-β1与α-SMA蛋白表达水平(±s)Table 3 Expression levels of TGF-β1 and α-SMA protein (±s)
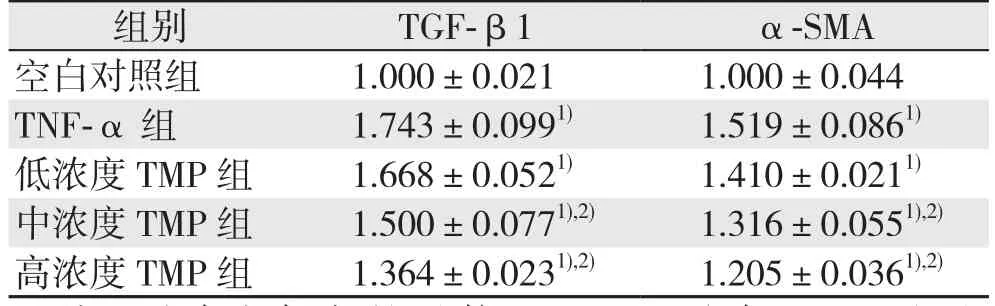
表3 各组细胞TGF-β1与α-SMA蛋白表达水平(±s)Table 3 Expression levels of TGF-β1 and α-SMA protein (±s)
注:1)与空白对照组比较,P<0.05;2)与TNF-α组比较,P<0.05Note: 1) P<0.05 vs.blank control group; 2) P<0.05 vs.TNF-α group
组别 TGF-β1 α-SMA空白对照组 1.000±0.021 1.000±0.044 TNF-α 组 1.743±0.0991) 1.519±0.0861)低浓度TMP组 1.668±0.0521) 1.410±0.0211)中浓度TMP组 1.500±0.0771),2) 1.316±0.0551),2)高浓度TMP组 1.364±0.0231),2) 1.205±0.0361),2)
3 讨 论
在损伤修复的过程中,增生性疤痕(HS)的形成是不可避免的结果,HS接着形成不同程度的疤痕疙瘩[16],疤痕疙瘩如果较轻微,通过组织塑形得以纠正,如疤痕过多,就难以通过简单的组织塑形予以解决。在胆道,HS的形成伴随着较高的BBS发病率。
成纤维细胞是由胚胎时期的间充质细胞(mesenchymal cells)分化而来,在组织损伤修复过程中发挥了重要作用。组织损伤后,成纤维细胞大量增殖并分化为肌成纤维细胞,分泌细胞外基质(extracellular matrix,ECM),收缩并填补创面,正常情况下,一旦创面被完全表皮化,成纤维细胞及肌成纤维细胞就开始加速凋亡,细胞外基质的分泌就明显减少,组织修复过程趋于停止;另一方面,一旦成纤维细胞及肌成纤维细胞等组织修复细胞持续过度增殖、细胞外基质过度积聚,则形成HS[17]。胆道创伤修复过程中,成纤维细胞大量增殖,同时转化为肌成纤维细胞收缩创面、分泌细胞外基质填补创面,在胆管疤痕修复及BBS形成过程中发挥了主要作用[6-7]。
TGF-β1是具有多种生物学效应的细胞因子,在细胞的增殖、分化、免疫调节及疤痕形成等生理及病理过程中发挥了重要作用[18]。组织创伤后,TGF-β1在成纤维细胞及肌成纤维细胞中的表达明显增高,TGF-β1反过来又能激活成纤维细胞,使其增殖旺盛,促进组织损伤后的修复。如果TGF-β1过度作用或持续过表达,将会引起成纤维细胞过度增殖,诱导其转化为大量肌成纤维细胞,分泌大量细胞外基质,同时抑制细胞的凋亡及细胞外基质的降解,从而导致瘢痕形成,是目前已知的与疤痕及胆管疤痕形成最密切的细胞因子[5-7]。TGF-β1主要是通过TGF-β1/Smads信号传导通路发挥作用,抑制疤痕组织及疤痕成纤维细胞中TGF-β1/Smads通路的表达是目前治疗疤痕的重要措施之一[19]。
α-SMA阳性表达是肌成纤维细胞较特异的标志,肌成纤维细胞具有成纤维细胞及平滑肌细胞的特点,具有较强的收缩性,同时能分泌大量的ECM及ECM的调控物基质金属蛋白酶(matrix metalloproteinases,MMPs)、基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinases,TIMPs)[20]。研究[6-7]发现,在疤痕组织及胆管疤痕组织中细胞外基质尤其是I、III型胶原过度沉积,细胞外基质的过度沉积是疤痕的主要生物学特征之一。MMPs 及TIMPs正常情况下能维持ECM的代谢平衡,异常情况下,MMPs及TIMPs的表达出现异常,引起ECM降解减少,导致细胞外基质的大量积聚,形成HS[21]。而α-SMA在胆管疤痕成纤维细胞及肌成纤维细胞中的表达主要受到TGF-β1的调控[5-7]。在创伤修复晚期,成纤维细胞逐渐转变为功能呈静止状态的纤维细胞。
P31 1(neuronal regeneration related protein,NREP)基因含有在人及小鼠等物种间高度保守的PEST域(为一富含谷氨酰胺、脯氨酸、丝氨酸、苏氨酸的约10个氨基酸组成的结构序列),该结构域是调节细胞内蛋白代谢中发挥重要作用的泛素-蛋白酶体通路(ubiquitin/proteasome pathway)的结合位点。如前所述,TGF-β1在疤痕及BBS形成过程中发挥了关键作用,并且TGF-β1主要是通过TGF-β1/Smads信号传导通路发挥其生物学作用的,而Smads在转录表达后受泛素-蛋白酶体通路的降解,以维持Smad通路信号的正常传导[22]。报道[23]显示P311基因在皮肤疤痕组织成纤维细胞及肌成纤维细胞中高度表达,对正常皮肤成纤维细胞转染P311基因后,该细胞的TGF-β1及α-SMA表达明显上调,提示P311基因可能通过对成纤维细胞TGF-β1及α-SMA表达的调控在HS的形成过程中发挥了重要作用。笔者[8]的前期研究结果也提示P311基因在BBS模型胆管成纤维细胞中的表达明显增高,提示P311基因在BBS形成过程中可能发挥了重要作用。本实验结果提示P311基因在TNF-α处理的胆管成纤维细胞中的表达较正常胆管成纤维细胞中的表达明显增高(P<0.01),提示P311基因在胆道疤痕修复及BBS形成过程中可能发挥了重要的作用,其机理可能与对成纤维细胞TGF-β1/α-SMA通路的调控有关。
TNF-α是一种主要由单核细胞、巨噬细胞及T淋巴细胞产生的26 kD的蛋白,可分为溶解型(sTNF-α)和膜结合型(mTNF-α),mTNF-α是sTNF-α的前体,在TNF-α转化酶(TNF-α converting enzyme,TACE)的作用下mTNF-α解离成为sTNF-α[24]。TNF-α在组织损伤修复的炎症反应阶段具有重要的调节作用[10]。在人体皮肤损伤修复的过程中TNF-α的最高峰值出现在损伤后的12~24 h[25]。与正常皮肤相比,疤痕组织及其成纤维细胞的TNF-α mRNA及蛋白表达均明显增高,提示TNF-α可能在皮肤疤痕形成的过程中发挥了重要作用[11,12]。TNF-α调控的下游主要成分NF-κB、肿瘤坏死因子受体相关因子(TNF receptor-associated factors,TRAF,分为TRAF1及TRAF2)及细胞凋亡抑制剂(cellular inhibitor of apoptosis,c-IAP1)在疤痕组织及其成纤维细胞中的表达较正常组织及其成纤维细胞中的表达也明显增高,提示TNF-α及其传导通路在疤痕形成过程中发挥了重要作用[11]。在滑膜成纤维细胞中,TNF-α刺激细胞增殖及上调TGF-β1等细胞因子的表达[26]。干预疤痕成纤维细胞中TNF-α及其调控的NF-κB等信号转到通路的表达是目前治疗疤痕的方式之一[12]。也有报道[27]显示TNF-α能够抑制成纤维细胞α-SMA、胶原及纤维素的表达,从而降低胶原基质的硬度及收缩,提示TNF-α在一定条件下可能具有抑制疤痕形成的作用。报道[12]显示TNF-α通过激活2条相互竞争的通路调控细胞的凋亡:激活NF-κB通路抑制细胞的凋亡,激活caspase-8通路促进细胞的凋亡。因此,TNF-α对细胞的双向调节作用可能与不同浓度的TNF-α作用于细胞后介导不同的信号传导途径有关。本实验结果提示TNF-α浓度为30 ng/mL时上调正常胆管成纤维细胞TGF-β1、α-SMA、P311基因mRNA及蛋白的表达,从而刺激胆管成纤维细胞的增殖,这与以前报道[12]的50 ng/mL TNF-α激活NF-κB通路抑制细胞凋亡及相关基因表达的浓度趋于一致。提示TNF-α在胆道疤痕修复及BBS形成过程中可能发挥了重要作用,而机理可能与其对胆管成纤维细胞P311/TGF-β1/α-SMA通路的调控有关。
以往报道[28]TMP能抑制血管紧张素II诱导的心肌细胞肥大及通过NF-κB通路抑制TNF-α的表达,从而达到保护心肌的作用。也有报道[29]显示TMP能抑制小神经胶质细胞TNF-α及NF-κB等炎症相关细胞因子的表达。同时TMP还能通过抑制TNF-α的表达抑制肺纤维化的形成[30]。本实验结果提示TMP(0.4~2.0 mg/mL)能下调TNF-α诱导的胆管成纤维细胞P311/TGF-β1/α-SMA通路的mRNA及蛋白的表达,从而抑制TNF-α诱导的胆管成纤维细胞的增殖,提示TMP抑制BBS形成的机理之一可能与其直接或间接调控TNF-α有关。
[1]Shimada H,Endo I,Shimada K,et al.The current diagnosis and treatment of benign biliary stricture[J].Surg Today,2012,42(12):1143–1153.doi: 10.1007/s00595–012–0333–3.
[2]MacFadyen BV Jr,Vecchio R,Ricardo AE,et al.Bile duct injury after laparoscopic cholecystectomy.The United States experience[J].Surg Endosc,1998,12(4):315–321.
[3]Pascher A,Neuhaus P.Bile duct complications after liver transplantation[J].Transpl Int,2005,18(6):627–642.
[4]Windsor JA,Pong J.Laparoscopic biliary injury: more than a learning curve problem[J].Aust N Z J Surg,1998,68(3):186–189.
[5]Geng ZM,Zheng JB,Zhang XX,et al.Role of transforming growth factor-beta signaling pathway in pathogenesis of benign biliary stricture[J].World J Gastroenterol,2008,14(31):4949–4954.
[6]Geng ZM,Yao YM,Liu QG,et al.Mechanism of benign biliary stricture: a morphological and immunohistochemical study[J].World J Gastroenterol,2005,11(2):293–295.
[7]Xu J,Geng ZM,Ma QY.Microstructural and ultrastructural changes in the healing process of bile duct trauma[J].Hepatobiliary Pancreat Dis Int,2003,2(2):295–299.
[8]Li KY,Shi CX,Huang JZ,et al.Tetramethylpyrazine Effects on the Expression of Scar-Related Genes in Rabbit Benign Biliary Stricture Fibroblasts[J].J Coll Physicians Surg Pak,2016,26(10):813–817.
[9]Huang C,Ogawa R.Pharmacological treatment for keloids[J].Expert Opin Pharmacother,2013,14(15):2087–2100.doi:10.1517/14656566.2013.826651.
[10]Barrientos S,Stojadinovic O,Golinko MS,et al.Growth factors and cytokines in wound healing[J].Wound Repair Regen,2008,16(5):585–601.doi: 10.1111/j.1524–475X.2008.00410.x.
[11]Messadi DV,Doung HS,Zhang Q,et al.Activation of NFkappaB signal pathways in keloid fibroblasts[J].Arch Dermatol Res,2004,296(3):125–133.
[12]Zhu G,Cai J,Zhang J,et al.Abnormal nuclear factor (NF)-kappaB signal pathway and aspirin inhibits tumor necrosis factor alphainduced NF-kappaB activation in keloid fibroblasts[J].Dermatol Surg,2007,33(6):697–708.
[13]Tian Y,Yang G,Zhang X,et al.Effects of substance P on growth of fibroblast-like cells derived from bile duct: an in vitro cell culture study[J].Chin Med J (Engl),2014,127(17):3121–3126.
[14]Kuver R,Savard C,Nguyen TD,et al.Isolation and long-term culture of gallbladder epithelial cells from wild-type and CF mice[J].In Vitro Cell Dev Biol Anim,1997,33(2):104–109.
[15]Gunter-Smith PJ,Abdulkadir O,Hammonds-Odie L,et al.A primary culture of guinea pig gallbladder epithelial cells that is responsive to secretagogues[J].Am J Physiol Gastrointest Liver Physiol,2000,279(5):G866–874.
[16]Gauglitz GG,Korting HC,Pavicic T,et al.Hypertrophic scarring and keloids: pathomechanisms and current and emerging treatment strategies[J].Mol Med,2011,17(1–2):113–125.doi: 10.2119/molmed.2009.00153.
[17]Hu B,Phan SH.Myofibroblasts[J].Curr Opin Rheumatol,2013,25(1):71–77.doi: 10.1097/BOR.0b013e32835b1352.
[18]No authors listed.Correction: Role of Transforming Growth Factor(beta) in Human Disease[J].N Engl J Med,2000,343(3):228.
[19]Zhou P,Shi L,Li Q,et al.Overexpression of RACK1 inhibits collagen synthesis in keloid fibroblasts via inhibition of transforming growth factor-beta1/Smad signaling pathway[J].Int J Clin Exp Med,2015,8(9):15262–15268.
[20]Li B,Wang JH.Fibroblasts and myofibroblasts in wound healing:force generation and measurement[J].J Tissue Viability,2011,20(4):108–120.doi: 10.1016/j.jtv.2009.11.004.
[21]Arpino V,Brock M,Gill SE.The role of TIMPs in regulation of extracellular matrix proteolysis[J].Matrix Biol,2015,44–46:247–254.doi: 10.1016/j.matbio.2015.03.005.
[22]Liu W,Wang DR,Cao YL.TGF-beta: a fibrotic factor in wound scarring and a potential target for anti-scarring gene therapy[J].Curr Gene Ther,2004,4(1):123–136.
[23]Tan J,Peng X,Luo G,et al.Investigating the role of P311 in the hypertrophic scar[J].PLoS One,2010,5(4):e9995.doi: 10.1371/journal.pone.0009995.
[24]Black RA,Rauch CT,Kozlosky CJ,et al.A metalloproteinase disintegrin that releases tumour-necrosis factor-alpha from cells[J].Nature,1997,385(6618):729–733.
[25]Han YP,Tuan TL,Wu H,et al.TNF-alpha stimulates activation of pro-MMP2 in human skin through NF-(kappa)B mediated induction of MT1-MMP[J].J Cell Sci,2001,114(Pt 1):131–139.
[26]Li J,Shao X,Wu L,et al.Honokiol: an effective inhibitor of tumor necrosis factor-alpha-induced up-regulation of inflammatory cytokine and chemokine production in human synovial fibroblasts[J].Acta Biochim Biophys Sin (Shanghai),2011,43(5):380–386.doi: 10.1093/abbs/gmr027.
[27]Goldberg MT,Han YP,Yan C,et al.TNF-alpha suppresses alphasmooth muscle actin expression in human dermal fibroblasts: an implication for abnormal wound healing[J].J Invest Dermatol,2007,127(11):2645–2655.
[28]Yu L,She T,Li M,et al.Tetramethylpyrazine inhibits angiotensin II-induced cardiomyocyte hypertrophy and tumor necrosis factoralpha secretion through an NF-kappaB-dependent mechanism[J].Int J Mol Med,2013,32(3):717–722.doi: 10.3892/ijmm.2013.1436.
[29]Kim M,Kim SO,Lee M,et al.Tetramethylpyrazine,a natural alkaloid,attenuates pro-inflammatory mediators induced by amyloid beta and interferon-gamma in rat brain microglia[J].Eur J Pharmacol,2014,740:504–511.doi: 10.1016/j.ejphar.2014.06.037.
[30]黄成亮,李艳艳,范贤明,等.丹参联合川芎嗪对肺纤维化大鼠血清、支气管肺泡灌洗液中TNF-α和TGF-β1水平的影响[J].细胞与分子免疫学杂志,2013,29(7):673–676.Huang CL,Li YY,Fan XM,et al.Effects of combination of Salvia and Ligustrazine on TNF-alpha and TGF-beta1 in serum and BALF of rats with pulmonary fibrosis[J].Chinese Journal of Cellular and Molecular Immunology,2013,29(7):673–676.
