阿瑞匹坦用于乳腺癌患者化疗的止吐效果观察
2017-03-28姜敏,迟峰,吴荣
姜 敏,迟 峰,吴 荣
阿瑞匹坦用于乳腺癌患者化疗的止吐效果观察
姜 敏,迟 峰,吴 荣*
目的 观察分析阿瑞匹坦用于乳腺癌患者化疗的止吐效果及安全性。方法 选取我院经病理确诊的68例初诊化疗的乳腺癌患者,随机分为试验组及对照组。试验组34例,给予阿瑞匹坦联合托烷司琼、地塞米松;对照组给予安慰剂、格拉司琼、地塞米松,用药剂量及用法与试验组相同。观察两种治疗方案对化疗所致恶心、呕吐的疗效。结果 68例患者均纳入分析,阿瑞匹坦组患者完全缓解率明显优于对照组(61.8% vs. 31.3%,P=0.029);阿瑞匹坦组与对照组的急性呕吐完全缓解率分别为85.3%和67.6%(P=0.086),呈降低趋势,但差异无统计学意义;阿瑞匹坦组迟发性呕吐的完全缓解率明显高于对照组(70.6% vs. 44.1%,P=0.027),迟发性呕吐的发生率明显低于对照组(5.9% vs. 29.4%,P=0.011)。本研究中未观察到阿瑞匹坦相关中重度不良反应,药物安全性良好。结论 阿瑞匹坦对于乳腺癌化疗患者止吐效果良好,在迟发性呕吐的缓解方面尤其突出,且不良反应较轻,患者可耐受。
阿瑞匹坦;乳腺癌;恶心、呕吐
0 引言
乳腺癌是严重威胁女性健康的恶性肿瘤,其发病率与死亡率在全球女性恶性肿瘤中均居首位[1]。目前,乳腺癌的内科治疗方式主要为化疗、放疗及靶向治疗,以化疗为最常应用的效果明确的治疗手段,常用的治疗方案包括以蒽环类、紫杉类、铂类等为主的方案。而化疗诱发的恶心及呕吐(Chemotherapy-induced nausea and vomiting,CINV)作为化疗最常见的不良反应之一,往往是患者对化疗感到恐惧的原因[2]。严重的恶心、呕吐反应会极大降低患者的生活质量,增加患者对化疗的抵触感,影响患者治疗依从性,导致延误治疗时机,带来不良预后[3]。
目前,临床主要应用5-羟色胺3受体拮抗剂(Serotonin receptor antagonists,5-HT3RA)联合地塞米松预防及治疗CINV,虽然取得了一定效果,但对于应用中重度致吐化疗方案的患者来说,尤其在延迟期,效果仍欠佳[4]。阿瑞匹坦是一种新型预防CINV药物,为神经激肽-1受体拮抗剂(Neurokinin-1 receptor antagonists,NK-1 RA),是2003年美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市的第一个NK-1拮抗剂[5]。阿瑞匹坦可透过血脑屏障,通过作用于中枢达到预防CINV的作用,对于急性及迟发性恶心、呕吐均有疗效。本文纳入我院2014年3月至2016年4月初诊化疗的乳腺癌患者68例,观察阿瑞匹坦联合托烷司琼、地塞米松用于化疗所致恶心、呕吐的疗效。
1 材料与方法
1.1 入组及排除标准 入组标准:入组68例患者均为女性,已经由细胞学或病理学明确诊断为乳腺癌;年龄<75岁,ECOG PS评分≤2分,预测生存期≥3个月;初次入院行内科抗肿瘤治疗;患者用药前血常规、血生化、常规心电图等化验检查基本正常,排除化疗禁忌;化疗前24 h无恶心、呕吐症状且未口服任何止吐药物。入组患者签署知情同意书,自愿参与并配合治疗及随访。排除标准:排除由于颅内压增高、消化道梗阻、胃肠炎或其他药物等原因所致的恶心、呕吐。
1.2 一般资料 入组68例初诊化疗的乳腺癌患者,随机分为试验组和对照组。患者年龄跨度为27~71岁,中位年龄53岁;绝经前45例,绝经后23例,4例ECOG评分2分;用药方案包括AC(环磷酰胺+表阿霉素)序贯T(多西紫杉醇),CEF(环磷酰胺+表阿霉素+氟尿嘧啶)序贯T(多西紫杉醇),GP(吉西他滨+顺铂),NP(盖诺+顺铂)。两组患者一般情况见表1。
1.3 ECOG PS评分标准 0分:活动能力完全正常,与生病前相比较没有明显差异;1分:具备自由行走、从事轻体力活动的能力,但不能够从事较重体力活动;2分:虽然能够自由行走,生活基本可自理,但不具备工作能力,日内超过一半的时间能下床进行活动;3分:生活仅能够部分自理,日间超过一半的时间需要卧床或者需要轮椅支撑;4分:卧床不起,无生活自理能力;5分:死亡。

表1 两组患者一般资料比较(例,%)
1.4 治疗方法 试验组:阿瑞匹坦联合托烷司琼、地塞米松。具体用药:阿瑞匹坦(意美,美国Merck Sharp & Dohme Corp.)化疗当天用药前1 h口服阿瑞匹坦125 mg,当日1次;格拉司琼5 mg静脉推注,化疗当日1次;地塞米松5 mg静脉推注,化疗当日1次;第2、3天晨起口服阿瑞匹坦80 mg,1次/d。对照组:格拉司琼、地塞米松。用药剂量及用法与试验组相同。
1.5 疗效评价标准 参照《美国国家癌症研究所-通用不良反应评价标准》(Common Terminology Criteria for Adverse Events,CTCAE)3.0版关于胃肠道不良反应的评价标准,将恶心、呕吐各分为5个等级。恶心分级:0级:无恶心;Ⅰ级:轻微恶心,食欲下降,对食物摄入无影响;Ⅱ级:明显恶心,影响食物摄入,但不伴有明显体重变化、脱水或营养不良,静脉补充液体时间不超过24 h;Ⅲ级:重度恶心,摄入食物能量或水分不足,需要静脉补充液体、鼻饲或全静脉营养时间大于24 h;Ⅳ级:发生危及生命的事件;Ⅴ级:死亡。呕吐分级:0级:24 h内未发生呕吐;Ⅰ级:24 h内发生呕吐1次;Ⅱ级:24 h内发生呕吐2~5次,需要静脉补充液体,但补液时间不超过24 h;Ⅲ级:24 h内发生呕吐大于6次,需要静脉补充液体、鼻饲或全静脉营养时间大于24 h;Ⅳ级:发生危及生命的事件;Ⅴ级:死亡。依据以上标准,记录患者化疗后5 d内的恶心、呕吐情况。完全缓解(CR):恶心、呕吐均为0级;部分缓解(PR):发生Ⅰ级恶心或呕吐;轻度缓解(MR):发生Ⅱ级恶心或呕吐;无效(F):发生Ⅱ级以上的恶心或呕吐。
1.6 统计学处理 采用SPSS 17.0统计软件进行统计学分析。分类变量用计数和百分数来表示,计数资料两组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者CINV发生率比较 两组患者年龄及化疗疗程比较,差异均无统计学意义,具有可比性。入组的68例患者均可以评价疗效。两组患者急性恶心、迟发性恶心、急性呕吐发生率比较,差异无统计学意义;两组患者迟发性呕吐发生率比较,差异有统计学意义(P<0.05)。见表2。
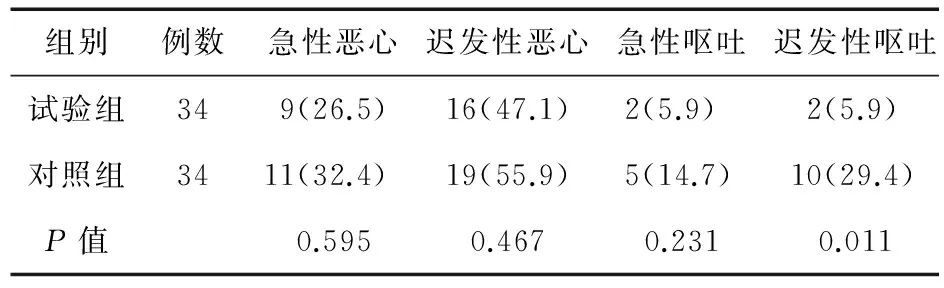
表2 两组患者CINV发生率比较(例,%)
2.2 两组患者CINV完全缓解率比较 两组患者急性呕吐完全缓解率比较,差异无统计学意义,而迟发性呕吐的完全缓解率及总完全缓解率比较,差异有统计学意义(P<0.05)。见表3。

表3 两组患者CINV完全缓解率比较(例,%)
2.3 不良反应 与对照组比较,试验组头晕及乏力的发生率有所升高,但差异无统计学意义(P>0.05),其他消化道相关不良反应及肝功能损伤的发生率未见明显变化(P>0.05)。试验组不良反应均较轻微,未见重度不良反应,阿瑞匹坦临床应用的安全性高,患者耐受性好。见表4。

表4 两组患者不良反应比较(例)
3 讨论
化疗是目前乳腺癌治疗的主要手段之一,抗肿瘤药物可按照其引起恶心、呕吐的几率分为高、中、低和轻微4个致吐风险等级,若不进行任何干预,恶心呕吐发生的几率分别为>90%、30%~90%、10%~29%和<10%[6]。铂类、环磷酰胺及表阿霉素类等乳腺癌化疗常用药物均属于高致吐药物,虽然临床疗效确切,但因其恶心、呕吐的不良反应,使得患者可能出现营养物质代谢障碍,能量与体液量不足,导致化疗进程无法正常完成,影响患者疗效、预后,甚至严重降低患者生活质量,从而失去治疗的耐受性,放弃治疗机会[7]。虽然近年来在CINV的防治方面取得了一定的进步,但对于需要接受高、中度致吐化疗药物的患者来说,CINV仍然是临床治疗的难点[8]。
CINV目前主要分为5个级别:急性、迟发性、预期性、难治性及爆发性[9],本研究主要针对急性与迟发性恶心呕吐。急性恶心呕吐:应用化疗药物后24 h内发生的恶心呕吐,一般于用药后很快出现,并在4 h左右达高峰,症状常常最严重;迟发性恶心呕吐:应用化疗药物后24~96 h出现的恶心呕吐,出现晚但持续时间较长,控制难度大,对化疗患者的生活质量影响较大。CINV的发生机制复杂,与中枢及外周神经系统相关,目前认为主要有5-HT(5-羟色胺)、P物质、组胺、多巴胺等神经递质等在其中发挥作用[10]。人体内绝大部分5-HT存在于肠道嗜铬细胞中,化疗药物可以刺激小肠嗜铬细胞大量释放5-HT,通过与5-HT3受体结合兴奋传入迷走神经,从而将信号传导至中枢引起恶心呕吐。临床应用5-HT3受体拮抗剂联合激素类治疗CINV,在急性恶心呕吐中取得了较好的疗效,但针对迟发性呕吐的缓解效果欠佳。不同的神经递质可能参与了不同类型的CINV,发挥的作用也存在差异。P物质是一种调节多肽,含有11个氨基酸,广泛分布于外周及中枢神经系统。P物质的受体共有3种亚型,分别为神经激肽NK-1(Neurokinin-1)、NK-2和NK-3,其中NK-1与P物质结合能力最强,由于NK-1分布于脑干呕吐中枢及胃肠道,而在脑干呕吐中枢的含量最多,二者结合后可以兴奋呕吐中枢诱发恶心呕吐[11]。动物实验发现,P物质可以引起呕吐,而特异性阻断NK-1受体能够缓解致吐药物导致的恶心呕吐[12]。
阿瑞匹坦对于NK-1受体具有高选择性及高亲和力,而对于NK-2、NK-3、5-HT3受体及地塞米松等其他受体的亲和力较低,因而联合用药对于改善CINV效果有益[13-15]。阿瑞匹坦蛋白结合率高,能够穿透血脑屏障,作用于脑干呕吐中枢的NK-1受体,且由于其半衰期长,止吐作用维持时间也较长,因此,对于急性及迟发性CINV均可发挥抑制作用。阿瑞匹坦为口服制剂,服用方便,且不受食物影响,一般情况下无需调整药物剂量,且不良反应较轻,患者耐受性良好[16]。近年研究发现,阿瑞匹坦对迟发性恶心呕吐的治疗具有优势,联合5-HT3受体拮抗剂与激素的三联用法对于防治CINV的效果良好[17-19]。临床研究表明,阿瑞匹坦用于肺癌患者中预防高剂量顺铂所致恶心呕吐时,急性CINV的完全缓解率为79.9%,而对照组为80.9%,差异无统计学意义(P=0.914),而在延迟性CINV中,阿瑞匹坦组完全缓解率为60%,对照组为33%,差异有统计学意义(P=0.019)[20]。一项包含了17项随机临床研究的Meta分析结果显示,对于入组的8 740例患者,阿瑞匹坦三联止吐方案使CINV的患者总完全缓解率由54%提高至72%(OR=0.51,P<0.001),显著降低了急性呕吐发生率(OR=0.56,P<0.001)和迟发性呕吐的发生率(OR=0.48,P<0.001)[21]。可见,阿瑞匹坦三联方案用于CINV治疗时,对迟发性CINV的治疗效果较为明确,而对于急性期的缓解率,不同研究的结论并不统一。国外学者也有将阿瑞匹坦用于术后止吐治疗的研究,并取得了一定的结果,但确切结论仍然需要进一步多中心大样本进行验证[22]。
目前,有学者进行体外研究发现,NK1受体拮抗剂具有促进凋亡、抑制肿瘤细胞迁移和抗血管生成从而发挥抗黑色素瘤的作用[23],但上述结论还有待于大样本研究来验证。而阿瑞匹坦对乳腺癌的疗效是否存在影响尚有待于进一步研究。
本研究探索了阿瑞匹坦在接受中、高致吐方案治疗的乳腺癌患者中的止吐效果,结果显示,阿瑞匹坦组患者的完全缓解率明显高于对照组,阿瑞匹坦组与对照组的急性呕吐完全缓解率呈降低趋势,但差异无统计学意义;阿瑞匹坦组迟发性呕吐的完全缓解率明显高于对照组,并且阿瑞匹坦能够显著降低患者迟发性呕吐的发生率。本研究的结果与既往国内外报道的相关研究结果基本一致[24-25]。本研究中未观察到阿瑞匹坦相关中重度不良反应,两组不良反应发生率比较差异无统计学意义,患者耐受性及药物安全性良好。
综上所述,阿瑞匹坦对于乳腺癌化疗患者止吐效果良好,在迟发性呕吐的缓解方面尤其突出,且不良反应较轻,患者可耐受,可保证患者的生活质量。但阿瑞匹坦费用较高,在一定程度上限制了其广泛应用,希望日后通过对NK1受体拮抗剂的不断研发,能够让更多的患者受益,使得CINV不再成为肿瘤患者治疗时的困扰。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Hesketh PJ.Chemotherapy-induced nausea and vomiting[J].N Engl J Med,2008,358(23):2482-2494.
[3] Fernández-Ortega P,Caloto MT,Chirveches E,et al.Chemotherapy-induced nausea and vomiting in clinical practice:impact on patients′ quality of life[J].Support Care Cancer,2012,20(12):3141-3148.
[4] Warr D.Management of highly emetogenic chemotherapy[J].Curr Opin Oncol,2012,24(4):371-375.
[5] Rojas C,Slusher BS.Pharmacological mechanisms of 5-HT3 and tachykinin NK1 receptor antagonism to prevent chemotherapy-induced nausea and vomiting [J].Eur J Pharmacol,2012,684(13):1-7.
[6] Jordan K,Gralla R,Jahn F,et al.Molassiotis,International antiemetic guidelines on chemotherapy induced nausea and vomiting (CINV):content and implementation in daily routine practice[J].Eur J Pharmacol,2014,722:197-202.
[7] Sommariva S,Pongiglione B,Tarricone R.Impact of chemotherapy-induced nausea and vomiting on health-related quality of life and resource utilization:A systematic review[J].Crit Rev Oncol Hematol,2016,99:13-36.
[8] Molassiotis A,Saunders MP,Valle J,et al.A prospective observational study of chemotherapy-related nausea and vomiting in routine practice in a UK cancer centre[J].Support Care Cancer,2008,16(2):201-208.
[9] Navari RM.Management of chemotherapy-induced nausea and vomiting:focus on newer agents and new uses for older agents[J].Drugs,2013,73(3):249-262.
[10]Rojas C,Raje M,Tsukamoto T,et al.Molecular mechanisms of 5-HT(3) and NK(1) receptor antagonists in prevention of emesis[J].Eur J Pharmacol,2014,722:26-37.
[12]Tattersall FD,Rycroft W,Francis B,et al.Tachykinin NK1 receptor antagonists act centrally to inhibit emesis induced by the chemotherapeutic agent cisplatin in ferrets[J].Neuropharmacology,1996,35(8):1121-1129.
[13]农巧红,王树滨,彭小丹,等.阿瑞匹坦与托烷司琼联用或单用预防晚期肺癌顺铂化疗引起呕吐的比较研究[J].中国医药,2015,10(8):1123-1125.
[14]Di MM,Bria E,Banna GL,et al.Prevention of chemotherapy-induced nausea and vomiting and the role of neurokinin 1 inhibitors:from guidelines to clinical practice in solid tumors[J].Anticancer Drugs,2013,24(2):99-111.
[15]杨凡,李卉惠,赵磊,等.阿瑞匹坦联合5-HT3RA预防化疗引起呕吐的Meta分析[J].实用医学杂志,2016,32(19):3255-3259.
[16]Aapro M,Carides A,Rapoport BL,et al.Aprepitant and fosaprepitant:a 10-year review of efficacy and safety[J].Oncologist,2015,20(4):450-458.
[17]Yoshida M,Suzuki S,Enokida T,et al.Evaluation of aprepitant as a prophylactic antiemetic in the Cisplatin split regimen combined with radiation for patients with head and neck cancer[J].Gan To Kagaku Ryoho,2014,41(9):1103-1106.
[18]Mizuno M,Hiura M,Kikkawa F,et al.A prospective observational study on chemotherapy-induced nausea and vomiting (CINV) in patients with gynecologic cancer by the CINV Study Group of Japan[J].Gynecol Oncol,2016,140(3):559-564.
[19]Rapoport BL.Efficacy of a triple antiemetic regimen with aprepitant for the prevention of chemotherapy-induced nausea and vomiting:effects of gender,age,and region[J].Curr Med Res Opin,2014,30(9):1857-1881.
[20]陈丽昆,程颖,张红雨,等.阿瑞吡坦在中国肺癌患者中预防高剂量顺铂引起恶心和呕吐的疗效[J].中国新药与临床杂志,2015,34(10):757-763.
[21]Dos SLV,Souza FH,Brunetto AT,et al.Neurokinin-1 receptor antagonists for chemotherapy-induced nausea and vomiting:a systematic review[J].J Natl Cancer Inst,2012,104(17):1280-1292.
[22]Gan TJ,Apfel CC,Kovac A,et al.A randomized,double-blind comparison of the NK1 antagonist,aprepitant,versus ondansetron for the prevention of postoperative nausea and vomiting[J].Anesth Analg,2007,104(5):1082-1089.
[24]Jang G,Song HH,Park KU,et al.A phase Ⅱ study to evaluate the efficacy of ramosetron,aprepitant,and dexamethasone in preventing cisplatin-induced nausea and vomiting in chemotherapy-naive cancer patients[J].Cancer Res Treat,2013,45(3):172-177.
[25]Choi CH,Kim MK,Park JY,et al.Safety and efficacy of aprepitant,ramosetron,and dexamethasone for chemotherapy-induced nausea and vomiting in patients with ovarian cancer treated with paclitaxel/carboplatin[J].Support Care Cancer,2014,22(5):1181-1187.
Efficacy of aprepitant in preventing chemotherapy-induced nausea and vomiting in patients with breast cancer
JIANG Min,CHI Feng,WU Rong*
(Department of Medical Oncology,Shengjing Hospital of China Medical University,Shenyang 110022,China)
Objective To observe and analyze the efficacy and safety of aprepitant in preventing chemotherapy-induced nausea and vomiting in patients with breast cancer.Methods A total of 68 patients with breast cancer were randomly divided into two groups:treatment group (n=34) and control group (n=34).Treatment group was treated with aprepitant combined with tropisetron and dexamethasone;control group was given placebo,granisetron and dexamethasone,the dosage and usage being the same as the treatment group.The efficacy of the two therapeutic schemes in preventing chemotherapy-induced nausea and vomiting was observed.Results All 68 patients were included for analysis.The overall complete response rate of treatment group was higher than that of control group (61.8% vs.31.3%,P=0.029).The overall complete response rate of acute vomiting in treatment group and control group was 85.3% and 67.6% (P=0.086),showing a decreasing trend,but the difference was not statistically significant.The overall complete response rate of delayed vomiting of treatment group was significantly higher than that of control group (70.6% vs.44.1%,P=0.027),and the incidence of delayed vomiting was significantly lower than that of control group(5.9% vs.29.4%,P=0.011).No aprepitant-related severe adverse reaction were observed in this study,which showed that the drug was safe.Conclusion Aprepitant is safe and effective in preventing chemotherapy-induced nausea and vomiting for patients with breast cancer,especially in the delayed phase,and the adverse reaction is mild and tolerable.
Aprepitant;Breast cancer;Nausea and vomiting
2016-08-26
中国医科大学附属盛京医院肿瘤科,沈阳 110022
*通信作者
10.14053/j.cnki.ppcr.201703015
