活性维生素D类似物对内毒素感染小鼠肾脏细胞因子的影响
2017-03-28徐樱溪车千红
徐樱溪,赵 晴,孙 灿,车千红,付 瑜,丁 丁,孔 娟
活性维生素D类似物对内毒素感染小鼠肾脏细胞因子的影响
徐樱溪,赵 晴,孙 灿,车千红,付 瑜,丁 丁,孔 娟*
目的 研究活性维生素D类似物对内毒素感染小鼠肾脏细胞因子的影响。方法 将C57 BL/6源性野生小鼠(20只)随机分为正常对照组(CON组)、帕立骨化醇组(P组)、脂多糖组(LPS组)、帕立骨化醇+脂多糖组(P+LPS组)。比较各组小鼠一般状态,应用ELISA试剂盒检测小鼠血清肌酐含量,实时定量PCR法测定小鼠肾脏中细胞因子水平。结果 一般状态比较,P+LPS组小鼠较LPS组小鼠不良反应减轻。各组小鼠肾脏形态学及血清肌酐水平未见明显差异。P+LPS组肾脏组织细胞因子IL-1β、ICAM、TNF-α、INF-γ表达比LPS组明显下降(P<0.05)。结论 活性维生素D类似物能显著减少内毒素感染小鼠肾脏组织中IL-1β、ICAM、TNF-α、INF-γ的含量,减轻炎性细胞因子介导的肾脏损伤,从而起到对肾脏的保护作用。
活性维生素D类似物;内毒素;细胞因子
0 引言
维生素D主要通过作用于骨、肾、甲状旁腺等组织调节钙磷代谢,维持矿物质及骨代谢平衡,其非传统生物学效应近年来也受到广泛的重视。1,25-(OH)2D3是维生素D的活性形式,大多数维生素D的生物学效应都是通过1,25-(OH)2D3与维生素D受体(VDR)结合发挥调节下位基因的作用实现的。随着VDR在不同组织表达的发现,其相应的生理功能被揭示,活性维生素D及其类似物的作用也得到证实,在肾脏疾病、心血管疾病、免疫炎性反应、肿瘤等方面都有一定作用,其抗炎和免疫调节作用近来更是受到了广泛的关注[1-5]。活性维生素D及其类似物作用于抗原提呈细胞(APCs)及T淋巴细胞参与免疫系统的调节及炎症反应,其可调控多种免疫、防御细胞的功能,包括巨噬细胞、单核细胞、上皮细胞、淋巴细胞等[6]。实验中发现,活性维生素D及其类似物可以延长肾脏、肝脏、胰腺等存活时间,降低慢性肾脏病患者尿蛋白[7]、减少足细胞损伤和丢失[8],增加糖尿病肾病小鼠超氧化物歧化酶活性,抑制肾素受体、转化生长因子-βl、单核细胞趋化蛋白l的活性,恢复nephrin的表达[9]。活性维生素D及其类似物的缺乏与慢性炎症及糖尿病肾病的发生及发展相关[10-12]。目前针对活性维生素D及其类似物对肾脏作用的研究多为对慢性损伤肾脏的保护作用,而活性维生素D及其类似物对急性炎症反应所致肾脏损伤影响的研究较少。本研究采用活性维生素D类似物干预内毒素感染小鼠模型,以探究活性维生素D类似物对内毒素感染小鼠肾脏细胞因子的影响,从而进一步研究活性维生素D及其类似物对肾脏应激损伤的影响。
1 材料与方法
1.1 实验动物及处理方法 C57 BL/6源性野生小鼠20只,2月龄,体重20~25 g,性别不限,室温饲养,饲料为普通动物饲料,自由饮水进食。随机分4组,每组5只。正常对照组(CON组):腹腔注射60%丙二醇注射液2周,隔日1次,每次200 μL/只。帕立骨化醇组(P组):400 ng/kg帕立骨化醇溶解在60%丙二醇注射液中,每次200 μL/只,腹腔注射2周,隔日1次。脂多糖组(LPS组):腹腔注射60%丙二醇注射液,隔日1次,每次200 μL/只,2周后予LPS以15 mg/kg腹腔注射,18 h后处死。帕立骨化醇+脂多糖组(P+LPS组):400 ng/kg帕立骨化醇溶解在60%丙二醇注射液中,每次200 μL/只,腹腔注射,隔日1次,喂养2周后予LPS以15 mg/kg腹腔注射,18 h后处死。
1.2 组织学处理 脱颈处死各组小鼠,立即冰上取新鲜肾脏组织,应用OCT复合物包埋,-80 ℃冰箱冷冻、切片,苏木精伊红(HE)染色,200倍显微镜下观察肾脏组织病变情况。
1.3 各组小鼠血清肌酐测定 经右心室取血,离心后取上清,应用ELISA试剂盒检测各组小鼠血清肌酐含量,采用ABCAM公司试剂盒,货号Creatinine Assay(ab30719),依照说明操作。
1.4 各组小鼠肾脏组织细胞因子测定 实时定量PCR法测定小鼠肾脏组织中细胞因子mRNA的表达水平:提取小鼠肾组织,按照试剂说明书用TRizol法提取总RNA,用美国Invitrogen公司的反转录试剂盒将RNA反转录成cDNA。使用Primer 3.0设计合成特异性引物(如表1)。
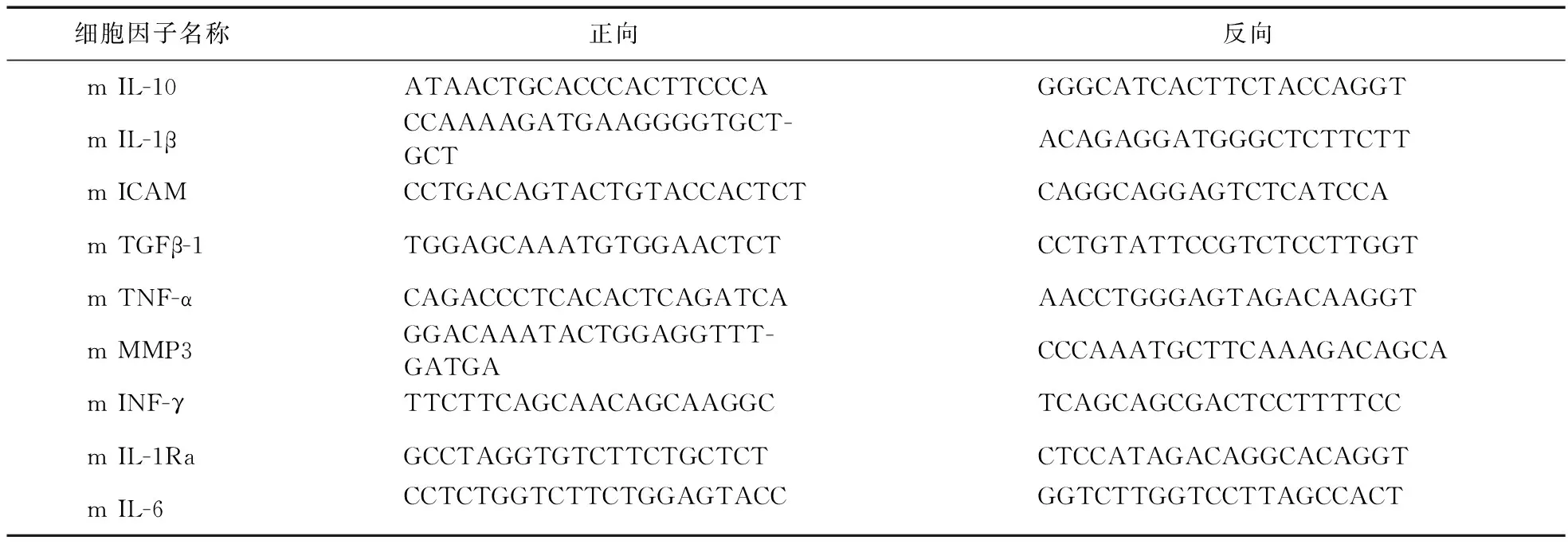
表1 细胞因子引物序列
2 结果
2.1 各组小鼠一般状态比较 CON组及P组小鼠一般状态良好,活动情况、进食(水)量、尿量、体温等指标无明显差异。注射LPS 3 h后,LPS组5只小鼠均逐渐出现皮肤潮湿,倦怠,活动能力下降,进食及进水量进行性下降,排便明显增多,呼吸深大。注射LPS 4 h后,P+LPS组3只小鼠逐渐出现皮肤潮湿,倦怠,活动能力下降,进食及进水量进行性下降,腹泻明显,呼吸深大,但较LPS组减轻,且其中2只小鼠一般状态良好,活动情况、进食(水)量、尿量、体温等指标较CON组无明显差异。
2.2 各组小鼠肾脏形态学及组织学比较 四组小鼠肾脏大小正常,颜色红润,无肿胀、出血,光镜下可见肾小球、肾小管结构正常,无变性坏死,细胞形态比较无明显差异。
2.3 各组小鼠肾脏功能的比较 经右心室取血,离心后取上清,应用ELISA试剂盒检测各组小鼠血清肌酐含量。各组小鼠肌酐值比较,P+LPS组较LPS组小鼠血清肌酐值略下降,差异无统计学意义(P>0.05)(见图1)。
2.4 各组小鼠细胞因子水平的变化 用实时定量PCR法测定各组小鼠肾脏组织中细胞因子mRNA的表达水平。P+LPS组IL-1β、TNF-α、
ICAM、INF-γ表达均低于LPS组,差异有统计学意义(P<0.05);P+LPS组TGFβ-1、MMP3、IL-10较LPS组略有降低,IL-1Ra、IL-6表达较LPS组略有增加,但差异均无统计学意义(P>0.05)。结果提示,活性维生素D类似物降低肾脏组织中IL-1β、TNF-α、ICAM、INF-γ等炎性细胞因子在急性感染时对肾脏的损伤(见图2)。

图1 各组小鼠肌酐值比较

图2 各组小鼠细胞因子水平的变化
3 讨论
帕立骨化醇是一种活性维生素D类似物,通过结合VDR而发挥相应的生理效应,同时具有对血钙影响较小的优点[13]。感染所致的脓毒症是引起急性肾损害的常见原因,LPS是G-菌脓毒血症致病过程中最重要的介质。LPS与细胞膜上的清道夫受体结合可激活巨噬细胞内的多条信号转导途径,如丝裂原活化蛋白激酶(MAPK)通路、蛋白激酶c(PKC)通路、核因子(NF)-κB通路等,当巨噬细胞与LPS接触40~60 min后即分泌大量炎症介质[14]。炎症介质大量释放及继之的级联反应,造成微循环障碍、组织细胞缺氧,全身炎症反应失控,最终造成多器官功能衰竭,目前已知多种细胞因子参与了内毒素血症所引发的多脏器功能衰竭。
本实验研究中,C57 BL/6源性的野生小鼠注射LPS 18 h后小鼠无死亡,进行小鼠肾脏形态学及组织学观察及血清肌酐测定,各组未见明显差异。既往研究中曾发现,在LPS行腹腔注射18 h后,小鼠的肝脏中巨噬细胞特异性抗体染色的巨噬细胞数量明显增多[15],LPS注射12 h后,小鼠后肠道黏膜损伤程度评分明显增高[16],肺上皮细胞屏障完整性明显受损[6]。本研究中,LPS组小鼠注射内毒素3 h后,5只小鼠均逐渐出现异常表现,以倦怠、排便明显增加及呼吸深大为主,尿量无明显变化,从小鼠的一般状态分析,考虑此时内毒素血症主要影响小鼠肝脏、肠道及呼吸系统,对肾脏的损伤无论从组织形态学还是肾脏功能肌酐的测定中均未出现明显异常。LPS趋化作用来自于血液循环中的单核细胞,LPS腹腔注射后,经肠系膜、大小网膜吸收入血,进入肠系膜静脉到达肝脏,首先对肠道及肝细胞产生毒性作用[15]。考虑本研究中小鼠出现异常表现的原因多为肠道、肝脏及肺损伤所致,对肾脏为早期损伤,在肾脏形态学上并未明显变化,对细胞因子的影响较为明显。
本研究为内毒素所致肾脏损伤的早期,活性维生素D类似物对细胞因子的影响更具有指导意义。IL-1的活性形式有IL-1α、IL-1β、IL-1γ 3种,IL-1β是其在血液和组织液中的主要形式,不仅能够协同其他细胞因子促进T、B细胞活化,而且能够诱导其他炎症性介质的产生,加强白细胞与内皮细胞黏附,调节TNF-α、IL-6的产生[17]。本研究发现,活性维生素D类似物可以抑制内毒素血症早期肾脏组织中IL-1β的升高,抑制炎症反应对肾脏的损伤。血管内皮细胞是内毒素作用早期的主要靶细胞,内毒素对血管内皮细胞的损伤与激活和重度感染后机体免疫功能紊乱与多器官功能衰竭密切相关[18]。ICAM-1在增生的血管内皮细胞上表达最强,ICAM-1促进白细胞与内皮细胞之间的黏附可能是诱导血管生成,因此,ICAM在炎症反应中发挥了重要作用。本研究发现,活性维生素D类似物可以降低内毒素血症早期肾脏组织中ICAM-1的分泌,使后续肾缺血再灌注损伤减轻。TNF是细胞因子系统的关键部分,当细菌或毒素进入机体后,TNF-α在循环中较早出现并迅速达到高峰,可以直接损伤组织细胞,还可以激活中性粒细胞,使后者进一步释放各种炎症因子,引起进一步损伤,也可以介导IL-1,使损伤进一步加重[19]。既往研究发现,活性维生素D可通过抑制慢性肾脏损伤中TNF-α的表达,减轻炎性浸润,减少蛋白尿,进而缓解肾损伤[20]。辅助性T淋巴细胞在细胞免疫中起主要的作用。IFN-γ是Th1细胞分泌的细胞因子中的代表性因子,能够促进原始T细胞分化为Th1细胞,并增强Th1细胞的活性,同时能有效抑制原始T细胞向Th2细胞分化增殖,也可上调单核巨噬细胞的杀菌作用。IFN-γ还是激活并调节单核巨噬细胞分化的重要细胞因子之一。Th1和Th2细胞是决定细胞免疫类型的主要因素,Th1细胞选择性激活引起细胞免疫,而Th2细胞选择性激活体液免疫。IFN-γ抑制Th2细胞,进一步抑制体液免疫,而使免疫应答向细胞免疫应答的方向进行。急性感染期,Th1细胞处于激活状态,IFN-γ明显增高[21-23]。本研究发现,P+LPS组IFN-γ较LPS组下降明显,考虑内毒素所致的肾脏损伤在肾脏组织学及肾脏功能尚未发生异常的早期阶段,活性维生素D类似物抑制诱导后续炎症及免疫反应细胞因子,对肾脏起到保护作用。
IL-6是单核巨噬细胞产生的细胞因子,在正常情况下可调节免疫应答,在炎症反应和抗感染防御中起重要作用,而在病理状态下,其过度升高可造成机体的病理性损伤。IL-6可刺激肾小球系膜细胞的活化和增生,分泌大量的细胞因子,如IL-1、TGF-I、IL-6等,导致肾小球硬化。IL-6亦可活化B细胞,产生大量的IgE和IgA,形成循环免疫复合物,沉积于肾小球系膜区,引起局部炎症反应。既往研究中证明,活性维生素D可降低糖尿病肾病小鼠肾脏组织中的IL-6,抑制糖尿病肾病肾组织炎症状态,减少蛋白尿,进而保护肾脏。本研究表明,应用活性维生素D小鼠肾脏组织中IL-6较LPS组增加,但差异无统计学意义,考虑本实验设计为急性炎症反应时活性维生素D对肾脏的保护作用,糖尿病肾病小鼠的炎症状态为慢性炎性过程,而且IL-6浓度不同对组织器官的作用也存在差异。有研究提示,低浓度的IL-6预先提示炎症反应,促进组织复苏;而较高浓度的IL-6可导致组织出现瀑布链式炎症损伤反应[24]。IL-10通过抑制Th1细胞的增殖和IL-2、IFN等细胞因子的产生,从而抑制Th1免疫应答,降低患者的细胞免疫功能,促进Treg的增殖和活化,从而有利于诱导机体对外来病原的耐受。IL-1Ra是主要由单核/巨噬细胞产生的一种IL-1的内源抑制剂,可与Ⅰ型和Ⅱ型IL-1R结合,但不启动信号转导,其结合IL-1受体,与IL-1竞争结合位点,在阻碍IL-1促炎效应中发挥重要作用。IL-10、IL-1Ra为体内重要的抗炎性细胞因子,在应用活性维生素D类似物后,在肾脏表达出现增加趋势,但差异无统计学意义,考虑可能与本实验样本数较小有关,因此,后续研究中应进一步关注活性维生素D对抗炎性细胞因子的影响。
综上所述,活性维生素D类似物能显著减少内毒素感染小鼠肾组织中IL-1β、ICAM、TNF-α、INF-γ的含量,减轻炎性细胞因子介导的肾脏损伤,保护肾脏功能,本研究进一步证明了维生素D受体及其信号系统在感染早期对肾脏的保护作用。
[1] Dáňová K,Klapetková A,Kayserová J,et al.NF-κB,p38 MAPK,ERK1/2,mTOR,STAT3 and increased glycolysis regulate stability of paricalcitol/dexamethasone-generated tolerogenic dendritic cells in the inflammatory environment[J].Oncotarget,2015,6(16):14123-14138.
[2] Wong KE,Kong J,Zhang W,et al.Targeted expression of human vitamin D receptor in adipocytes decreases energy expenditure and induces obesity in mice[J].J Biol Chem,2011,286(39):33804-33810.
[3] 熊洋洋,李丹,付瑜,等.维生素D类似物对心肌肥厚的抑制作用[J].医学研究杂志,2015,44(6):31-35.
[4] Kong J,Kim GH,Wei M,et al.Therapeutic effects of vitamin D analogs on cardiac hypertrophy in spontaneously hypertensive rats[J].Am J Pathol,2010,177(2):622-631.
[5] 袁思捷,李申恒.维生素D缺乏与慢性肾脏病[J].实用医学杂志,2016,32(2):320-323.
[6] Shi YY,Liu TJ,Fu JH,et al.Vitamin D/VDR signaling attenuates lipopolysaccharide-induced acute lung injury by maintaining the integrity of the pulmonary epithelial barrier[J].Mol Med Rep,2016,13(2):1186-1194.
[7] 卢永新,杨胜淋,李玉敏,等.帕立骨化醇对慢性肾脏病患者肾小球滤过率及尿蛋白影响的Meta分析[J].中华肾脏病杂志,2015,31(1):30-36.
[8] Wang Y,Deb DK,Zhang Z,et al.Vitamin D receptor signaling in podocytes protects against diabetic nephropathy[J].J Am Soc Nephrol,2012,23(12):1977-1986.
[9] 邹敏书,余健,聂国明,等.帕立骨化醇对糖尿病大鼠肾脏保护作用的机制探讨[J].解放军药学学报,2011,27(6):475-479.
[10]Wu EL,Cui HX.Effect of 1,25-(OH)2D3 and lipopolysaccharide on mononuclear cell inflammation in type 2 diabetes mellitus and diabetic nephropathy uremia[J].Genet Mol Res,2016,15(3).
[11]Xu JR,Yang Y,Liu XM,et al.Association of VDR polymorphisms with type 2 diabetes mellitus in Chinese Han and Hui populations[J].Genet Mol Res,2014,13(4):9588-9598.
[12]Wang Y,Deb DK,Zhang Z,et al.Vitamin D receptor signaling in podocytes protects against diabetic nephropathy[J].J Am Soc Nephrol,2012,23(12):1977-1986.
[13]Eleftheriadis T,Antoniadi G,Liakopoulos V,et al.Paricalcitol reduces basal and lipopolysaccharide-induced (LPS) TNF-alpha and IL-8 production by human peripheral blood mononuclear cells[J].Int Urol Nephrol,2010,42(1):181-185.
[14]施海燕,林琳,朱昌来,等.HSPgp96和LPS激活小鼠腹腔巨噬细胞的比较研究[J].细胞与分子免疫学杂志,2007,23(11):1050-1052.
[15]赵晴,娄岩,李丹,等.维生素D受体对急性肝脏损伤保护作用的研究[J].实用药物与临床,2015,18(1):24-27.
[16]庞庆丰,徐文莉,何俊,等.谷氨酰胺对内毒素血症大鼠肠道损伤的保护作用及对血红素加氧酶-1表达的影响[J].中国危重病急救医学,2011,23(2):95-98.
[17]Suharti C,van Gorp EC,Setiati TE,et al.The role of cytokines in activation of coagulation and fibrinolysis in dengue shock syndrome[J].Thromb Haemost,2002,87(1):42-46.
[18]肖宇宏,白云,宋敏,等.内毒素刺激人脐静脉内皮细胞免疫相关分子的表达[J].免疫学杂志,2006,22(2):124-128.
[19]李秀江,杜玉君,王丽萍.乌司他丁对多器官功能障碍综合征大鼠肾脏的保护作用[J].中华急诊医学杂志,2006,15(6):510-512.
[20]Zhang XL,Guo YF,Song ZX,et al.Vitamin D prevents podocyte injury via regulation of macrophage M1/M2 phenotype in diabetic nephropathy rats[J].Endocrinology,2014,155(12):4939-4950.
[21]Gadeock S,Tran JN,Georgiou JG,et al.TGF-β1 prevents up-regulation of the P2X7 receptor by IFN-γ and LPS in leukemic THP-1 monocytes[J].Biochim Biophys Acta,2010,1798(11):2058-2066.
[22]Altamura M,Casale D,Pepe M,et al.Immune responses to fungal infections and therapeutic implications[J].Curr Drug Targets Immune Endocr Metabol Disord,2001,1(3):189-197.
[23]Koch A,Knobloch J,Dammhayn C,et al.Effect of bacterial endotoxin LPS on expression of INF-gamma and IL-5 in T-lymphocytes from asthmatics[J].Clin Immunol,2007,125(2):194-204.
[24]Devaraj S,Yun JM,Duncan-Staley CR,et al.Low vitamin D levels correlate with the proinflammatory state in type 1 diabetic subjects with and without microvascular complications[J].Am J Clin Pathol,2011,135(3):429-433.
Effects of active vitamin D analogues on cytokines in kidney of mice with endotoxin infection
XU Ying-xi,ZHAO Qing,SUN Can,CHE Qian-hong,FU Yu,DING Ding,KONG Juan*
(Department of Clinical Nutrition,Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To study the protective effect of active vitamin D analogue on cytokines in kidney of mice with endotoxin infection.Methods Twenty C57 BL/6 mice were randomly divided into four groups:normal control group (CON group),paricalcitol group (P group),lipopolysaccharide group (LPS group),and paricalcitol+lipopolysaccharide group (P+LPS group).The general status was compared,the levels of serum creatinine in the kidneys were measured by ELISA kit,and the levels of cytokines in the kidneys were determined by real-time PCR methods in the four groups.Results The general state of P+LPS group was better than that of LPS group.There was no significant difference in renal morphology and serum creatinine level between the two groups.The expression of IL-1β,ICAM,TNF-α and INF-γ in renal tissue of P+LPS group was significantly lower than that of LPS group (P<0.05).Conclusion Active vitamin D analogues can significantly reduce the levels of IL-1β,ICAM,TNF-α and INF-γ in renal tissue of mice induced by LPS,reduce inflammatory cytokine-mediated kidney damage,and protect the kidney function.
Active vitamin D analogues;LPS;Cytokines
2016-10-17
中国医科大学附属盛京医院临床营养科,沈阳 110004
国家自然科学基金(81570811);辽宁省攀登学者计划;辽宁省十百千计划
10.14053/j.cnki.ppcr.201703002
*通信作者
