HLA-DRB1等位基因多态性与广西青年女性宫颈癌易感性的关联研究▲
2017-03-28卢庭婷梁惠萍黄韦小玲
卢庭婷 梁惠萍黄 艳 韦小玲
(广西卫生职业技术学院,南宁市 530021)
HLA-DRB1等位基因多态性与广西青年女性宫颈癌易感性的关联研究▲
卢庭婷 梁惠萍*黄 艳 韦小玲
(广西卫生职业技术学院,南宁市 530021)
目的探讨HLA-DRB1等位基因多态性对广西青年女性宫颈癌发生的影响,为寻找广西女性宫颈癌的遗传易感基因或拮抗基因提供线索。方法选取广西地区25~35岁确诊为宫颈癌的患者(宫颈癌组)、无癌健康年轻女性(对照组)各57例作为研究对象,采集研究对象外周血并提取基因组DNA,应用 PCR-SSP方法对HLA-DRB1等位基因进行基因型检测,最后进行统计学分析。结果宫颈癌组 HLA-DRB1*04/10等位基因出现频率显著高于对照组,差异有统计学意义(P<0.05);宫颈癌组 HLA-DRB1*09等位基因出现频率显著低于对照组,差异有统计学意义(P<0.05);而两组间HLA-DRB1*01/07/08/11/12/13/14/15/16/17/18等位基因出现频率比较,差异无统计学意义(P>0.05)。结论HLA-DRB1*04/10等位基因可能是广西青年女性宫颈癌发生的易感基因;HLA-DRB1*09等位基因可能是广西青年女性宫颈癌的保护基因。而HLA-DRB1*01/07/ 08/11/12/13/14/15/16/17/18等位基因可能与广西青年女性宫颈癌遗传易感性无关。
HLA-DRB1;宫颈癌;遗传易感性
宫颈癌是威胁女性生命的第二大恶性肿瘤,仅次于乳腺癌,每年全球新发病例约50万例[1]。我国宫颈癌的患病率和病死率约占全世界的1/3[2]。宫颈癌系多因素关联疾病,其中高危型人乳头瘤病毒(HR-HPV)感染是宫颈癌发生的重要因素[3],但并非所有的HPV感染者最终都发展为宫颈癌。研究表明,在HPV致癌过程中协同宿主的遗传易感性是宿主感染HPV后是否发生肿瘤的关键因素[4]。近年来,HLA基因多态性对宫颈癌等肿瘤的遗传易感性备受关注[5],尤其是HLAⅡ类基因中的DRB1、DQB1与宫颈鳞癌的发生密切相关[6]。为了明确HLA-DRB1对广西女性宫颈癌易感性的影响及相关性,本实验采用聚合酶链反应-序列特异性引物(PCR-SSP)的方法,检测广西地区57例宫颈癌年轻患者和57例宫颈细胞学正常的年轻妇女的HLA-DRB1等位基因,以初步探讨HLA-DRB1等位基因与广西青年女性宫颈癌易感性的关联,为寻找广西女性宫颈癌的遗传易感基因或拮抗基因提供线索。
1 材料与方法
1.1 研究对象 选取2015年1月至2016年5月期间在广西医科大学附属肿瘤医院确诊的宫颈癌患者57例为宫颈癌组,年龄25~35岁;另选取同期在广西医科大学第一附属医院接受宫颈癌筛查,年龄、民族与宫颈癌组相匹配的57名健康女性为对照组。所有入选对象均为广西户籍,对照组均无肿瘤病史,研究对象相互间均无血缘关系。本研究已通过广西卫生职业技术学院伦理委员会的审批,所有研究对象均签署知情同意书,接受流行病学调查并提供血液标本。
1.2 方法
1.2.1 标本的采集与处理 采集两组研究对象的空腹外周静脉血5 mL(EDTA抗凝),混匀后进行600 μL/管分装,-80℃冰箱保存,待提取外周血白细胞DNA。
1.2.2 基因组DNA的提取 取冷冻的血样600 μL,提取DNA的步骤严格按照艾德莱生物科技有限公司的人基因组DNA试剂盒使用说明书进行,然后使用超微量紫外分光光度计NanoDrop 2000检测DNA的纯度与浓度,DNA的纯度(A260/A280值)在1.6~2.0,浓度在20~100 ng/μL的样品可以用于PCR检测。
1.2.3 基因型检测 选用天津秀鹏公司的HLA-DR基因分型低分辨测定试剂盒(PCR-SSP法)进行PCR检测。
1.2.4 PCR反应体系及扩增条件 ①PCR反应体系:先配制 dNTP-BufferⅠ 工作液:在 440 μL浓缩dNTP-BufferⅠ中加入560 μL纯化水,震荡混匀数秒,800 rpm离心数秒;每人份用量:取210 μL dNTP-BufferⅠ工作液,加入21 μL DNA,混匀,点动离心数秒;在引物板中,每人份(1~21孔)每孔各加入10 μL上述混合液,最后每孔再分别加入15~20 μL石蜡油蜡封,用密封膜封好PCR反应板(引物板)。②PCR扩增条件:将PCR反应板放入PCR仪样本槽相应位置,并记录放置顺序。按表1设定的参数,启动PCR反应程序直至循环结束:③PCR产物鉴定:从PCR扩增仪中取出PCR反应板,点动离心,轻轻撕掉密封膜。按照引物孔位图的顺序,将每个PCR反应产物(6 μL)加样到2.5%(m/v)的琼脂糖凝胶孔中。150V电泳10~15 min,内参带与阳性带清晰分开时即可停止电泳。
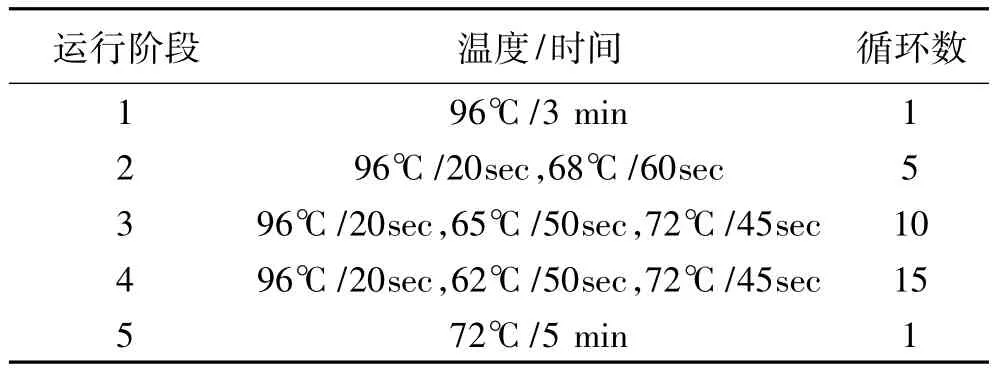
表1 PCR扩增条件
1.3 统计学处理 应用SPSS 16.0软件进行统计分析,HLA-DRB1各基因位点分布的组间比较采用χ2检验进行分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 观察及判读结果 在紫外凝胶成像系统下观察结果并拍摄成像,根据试剂盒说明书中提供的结果分型表判读基因分型情况。详见图1、图2。
2.2 结果分析 等位基因HLA-DRB1*04、HLA-DRB1 *10在宫颈癌组中出现的频率明显高于对照组,差异有统计学意义(P<0.05);等位基因HLA-DRB1*09在宫颈癌组中出现的频率明显低于对照组,差异有统计学意义(P<0.05);等位基因HLA-DRB1*01/07/08/11/12/ 13/14/15/16/17/18在两组间的频率分布比较,差异无统计学意义(P>0.05)。详见表2。

图1 HLA-DRB1等位基因的PCR扩增电泳图(宫颈癌组)
参照结果分型表,宫颈癌组中标本T409在第6、16、18、20、21泳道出现阳性带,为HLA-DRB1*04和HLA-DRB1 *14的杂合体。
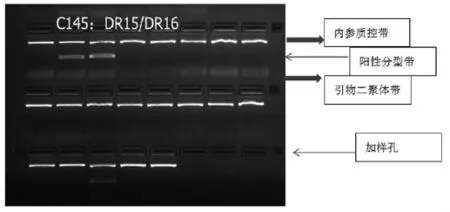
图2 HLA-DRB1等位基因的PCR扩增电泳图(对照组)
参照结果分型表,对照组中标本C145在第2、3、19泳道出现阳性带,为HLA-DRB1*15和HLA-DRB1*16的杂合体。
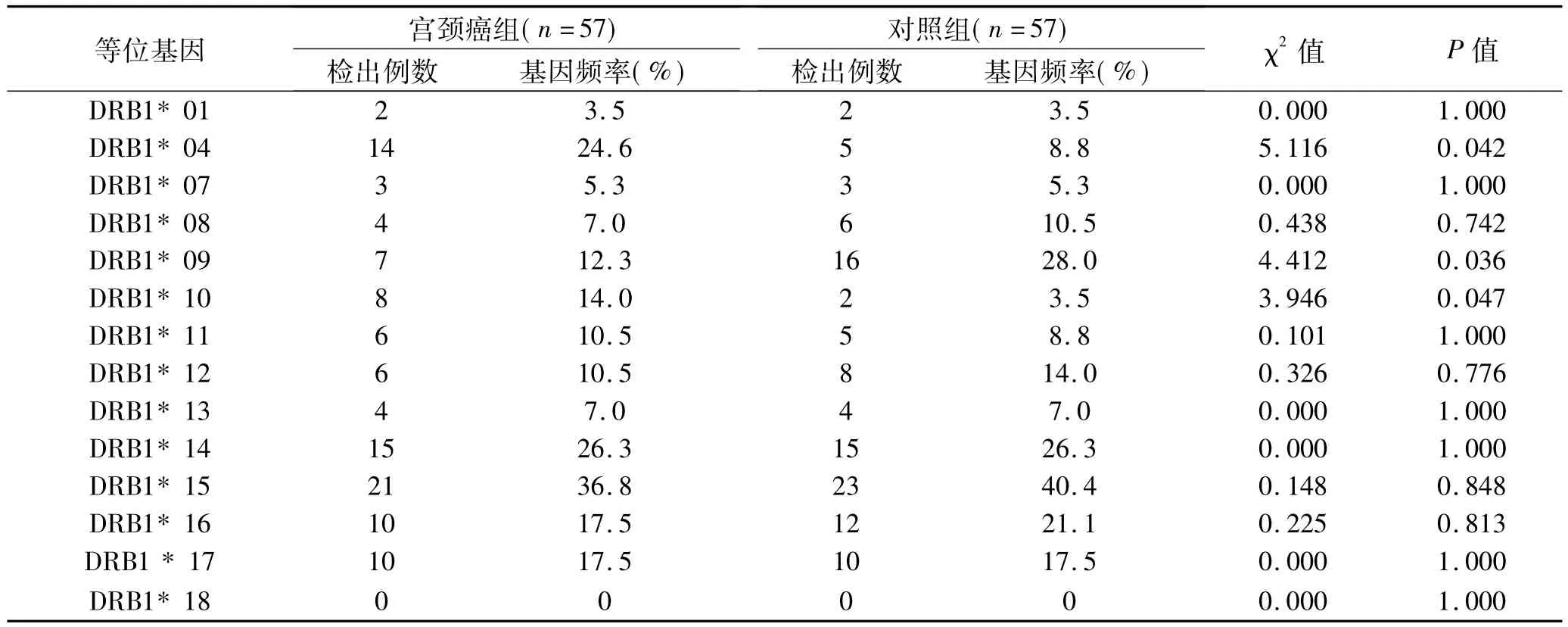
表2 宫颈癌患者组与无癌对照组中HLA-DRB1各等位基因频率分布比较
3 讨论
由于HLA-DR基因的多态性,对该等位基因与疾病相关性的研究已经成为HLA系统研究的热点[7]。但是,纵观国内外学者对HLA-DR的研究结果发现,不同国家、不同地区、不同种族间研究结果的差异较大[8],这可能是因为人群异质性、样本含量等原因,造成不同研究结果无法重复,甚至相互矛盾。例如,Cuzick等[9]在英国人中的研究显示,HLA-DRB1*03等位基因与宫颈癌呈正相关;而Wang等[10]在哥斯达黎加人中的研究显示,HLA-DRB1*03等位基因与宫颈癌无相关性。Climent等[11]研究发现,DRB1*11和DRB1*16与宫颈癌呈正相关,而DRB1*01/04/14/15则显示呈负相关。而国内的李华等[12]报道,HLA-DRB1*15可能是新疆喀什维吾尔族妇女宫颈癌的易感基因;而HLA-DRB1*04可能是喀什维吾尔族妇女宫颈癌的保护基因。而杨桂芳等[13]认为HLA-DRB1*15与宫颈癌易感性无关。张素琴等[14]认为HLA-DRB1*15和HLA-DRB1*04都是有宫颈癌家族史的危险因素,这与李华报道的HLA-DRB1*04是喀什维吾尔族妇女宫颈癌的保护基因相矛盾[12]。
本研究结果显示,宫颈癌组HLA-DRB1*04/10等位基因出现频率显著高于对照组(P<0.05),提示HLA-DRB1*04/10等位基因可能是广西青年女性宫颈癌发生的易感基因。此外,宫颈癌组HLA-DRB1*09等位基因出现频率显著低于对照组(P<0.05),提示HLA-DRB1*09等位基因可能是广西青年女性宫颈癌的保护基因。而两组间的HLA-DRB1*01/07/08/11/ 12/13/14/15/16/17/18等位基因出现频率无统计学差异(P>0.05),由此推测HLA-DRB1*01/07/08/11/12/ 13/14/15/16/17/18等位基因可能与广西青年女性宫颈癌易感性无关。本次研究收集的样本量较少,但两组成员的年龄、地域及民族是一致的,这在一定程度上排除了年龄、地域、民族这些混杂因素对研究结果的影响。此结果与李华的结果相矛盾,但却与杨桂芳的结果相一致(认为HLA-DRB1*15与宫颈癌易感性无关)。而HLA-DRB1*04基因可能是广西青年女性宫颈癌发生的易感基因这一点也与张素琴的结果相一致而与李华的结果相矛盾。分析其原因可能是由于HLA等位基因在不同种族、不同地域人群分布有差异,在一个种族有阳性意义的等位基因在另一个种族可能就没有统计学意义,即使在同一个种族,在不同地区的HLA等位基因的出现频率也会有所不同。另外,也可能是由于目前的研究方法、研究对象以及样本量的选择等方面均缺乏统一的标准,这些原因都可能导致不同地区、不同人群研究结果之间存在差异和矛盾。
本研究在一定程度上说明了广西地区青年女性HLA-DRB1等位基因多态性与宫颈癌发病的相关性,目前国内对于宫颈癌与HLA-DRB1基因多态性方面的研究还不多,故有必要在今后的研究中鉴定和筛选出更多有价值的宫颈癌的易感基因和保护基因,从而为宫颈癌的早期发现和治疗提供理论依据。
[1]Poggio JL.Premalignant lesions of the anal canal and squamous cell carcinoma of the anal canal[J].Clin Colon Rectal Surg,2011,24(3):177-192.
[2]Li S,Hu T,Lv W,et al.Changes in prevalence and clinical characteristics of cervical cancer in the People's Republic of China:a study of 10,012 cases from a nationwide working group[J].Oncologist,2013,18(10):1101-1107.
[3]Lin CW,Lin CC,Mo LR,et al.Heavy alcohol consumption increases the incidence of hepatocellular carcinoma in hepatitis B virus-related cirrhosis[J].J Hepatol,2013,58(4):730-735.
[4]Castro FA,Haimila K,Sareneva I,et al.Association of HLA-DRB1,interleukin-6 and cyclin D1 polymorphisms with cervical cancer in the Swedish population--a candidate gene approach[J].Int J Cancer,2009,125(8):1851-1858.
[5]魏林珍,王海琳,录亚鹏,等.中国人群HLA-DRB1基因多态性与宫颈癌易感性的Meta分析[J].实用预防医学,2014,21(3):264-267.
[6]祖菲娅·艾力,再努尔·阿布都热衣木,拉莱·苏祖克,等.喀什维吾尔族宫颈癌患者HPV16型感染及其人类白细胞抗原-DQB1基因多态性的关系[J].临床与实验病理学杂志,2011,27(3):274-277.
[7]樊晓妹,单保恩,李魁秀.基因多态性与宫颈癌易感性研究进展.[J].中华肿瘤防治杂志,2014,21(14):1125-1128.
[8]Nieters A,Yuan JM,Sun CL,et al.Effect of cytokine genotypes on the hepatitis B virus-hepatocellular carcinoma association[J].Cancer,2005,103(4):740-748.
[9]Cuzick J,Terry G,Ho L,et al.Association between highrisk HPV types,HLA DRB1*and DQB1*alleles and cervical cancer in British women[J].Br J Cancer,2000,82(7):1348-1352.
[10]Wang SS,Wheeler CM,Hildesheim A,et al.Human leukocyte antigen classⅠandⅡalleles and risk of cervical neoplasia:results from a population-based study in Costa Rica[J].J Infect Dis,2001,184(10):1310-1314.
[11]Climent C,Nazario CM,Umpierre S,et al.Major histocompatibility complex classⅡpolymorphisms and risk of cervical cancer in Puerto Rican women[J].P R Health Sci J,2007,26(2):97-101.
[12]李 华,百合尼莎·阿不都热西提,张苏琴,等.喀什维吾尔族妇女宫颈癌与HLA-DRB1*15和HLA-DRB1* 04的关系[J].复旦学报(医学版),2010,37(5):555-559.
[13]杨桂芳,李艳芸,贾艳菊,等.子宫颈癌HLA-DRB1基因型的初步研究[J].中华妇产科杂志,2009,44(5):383-385.
[14]张素琴,拉来·苏祖克,古扎丽努尔·阿不力孜,等.宫颈癌高发区新疆墨玉县有宫颈癌家族史的维吾尔族妇女人类白细胞抗原等位基因多态性的分布[J].中华肿瘤杂志,2012,34(4):272-277.
The relationship between HLA-DRB1 allele polymorphism and susceptibility to cervical cancer of Guangxi young women
LU Tingting,LIANG Huiping*,HUANG Yan,WEI Xiaoling
(Guangxi Medical College,Nanning 530021,China)
ObjectiveStudy on the relationship of Guangxi young women suffering from cervical cancer with HLA-DRB1 allele polymorphism.Provide clues for seeking hereditary susceptibility gene or resistant gene of cervical cancer of Guangxi women.MethodsChoose the cervical cancer diagnosed female patient and health woman 57 cases respectively aged between 25 and 35 of Guangxi as subject investigated.Take their peripheral blood samples to extract genome DNA.Then detect HLA-DRB1 genetype applying PCR-SSP technology.Finally the data were statistically analyzed.ResultsThe allele carrying rate of HLA-DRB1*04/ 10 in the cervical cancer group was higher than the health control group with statistically significant difference (P<0.05).The allele carrying rate of HLA-DRB1*09 in the cervical cancer group was lower than the health control group with statistically significant difference(P<0.05).There was no significant difference of the allele carrying rate of HLA-DRB1* 01/07/08/11/12/13/14/15/16/17/18 between two groups (P>0.05).ConclusionsHLA-DRB1*04/10 alleles are probably the susceptibility genes of cervical cancer of Guangxi young women;HLA-DRB1*09 alleles are probably the protective genes of cervical cancer of Guangxi young women;HLA-DRB1*01/07/08/11/12/13/14/15/16/17/18 alleles seem irrelevant to hereditary susceptibility of cervical cancer of Guangxi young women.
HLA-DRB1;Cervical cancer;Hereditary susceptibility
R 392.11
A
1673-6575(2017)01-0011-04
10.11864/j.issn.1673.2017.01.03
2016-10-30
2016-12-27)
广西壮族自治区教育厅 2016年度广西高校中青年教师基础能力提升项目(编号: KY2016YB740);广西高校科学技术研究项目(编号:YB2014546);广西壮族自治区教育厅项目(编号: GXGZJG2015B240)
卢庭婷(1979~),女,硕士,讲师,研究方向:生物化学与分子生物学。
*通信作者
