超声辅助胶内酶切方法的优化及其酶切特点的分析
2017-03-28肖晓萍郭正光
肖晓萍,郭正光,成 洁,孙 伟
(中国医学科学院基础医学研究所,北京协和医学院基础学院中心实验室,北京 100005)
超声辅助胶内酶切方法的优化及其酶切特点的分析
肖晓萍,郭正光,成 洁,孙 伟
(中国医学科学院基础医学研究所,北京协和医学院基础学院中心实验室,北京 100005)
分别应用20、100和200 W超声功率对牛血清白蛋白以及人尿蛋白组的胶内条带进行胶内酶切,通过比较不同功率鉴定的多肽数和蛋白数,确定最优的超声功率。同时比较超声辅助酶切与传统过夜酶切方法,并分析超声辅助胶内酶切方法的特点。结果表明,超声功率为20 W时对胶粒破坏最小,样品损失最少,在牛血清白蛋白样品中鉴定的多肽数最多为65。在人尿蛋白组2个条带中,20 W方法鉴定的蛋白数分别为168和199,鉴定效果最优。通过对多肽误切率和不完全酶切多肽的定性和定量分析发现,超声酶切方法的误切率高于传统方法,但不完全酶切率较低。通过分析多肽误切位点发现,传统过夜酶切法和超声辅助酶切法的主要误切类型分别为脯氨酸(P)和天冬氨酸/谷氨酸(D/E),3种超声方法之间各种误切类型所占比例均无明显差别。超声辅助酶切可显著缩短蛋白质胶内酶切时间,其中20 W功率超声酶切的效果最佳。与传统过夜酶切法相比,超声辅助酶切多肽的鉴定结果更好,其多肽的误切率更高,不完全酶切率较低,可用于发现蛋白质组学研究。
蛋白质组;胶内酶切;超声辅助酶切
胶内酶切是蛋白质组研究中常用的一种方法,即首先将蛋白质点(或条带)从一维胶或者二维胶内切除,然后进行胰酶消化[1],这种方法可以有效地去除蛋白质组样品中的杂质[2],现已得到广泛应用。
传统的过夜胶内酶切法耗时长,一般需要16 h以上,限制了蛋白质组分析的通量[3-4]。近年来,多种不同快速酶切法被用于蛋白质组研究,例如,微波辅助酶切[5]、酸水解酶切[6]、加热酶切[7]、超声辅助酶切[8-9]等,这些方法可以有效地缩短酶切时间,增加蛋白质组研究的通量[8-9]。目前已有应用超声辅助酶切法进行蛋白质酶切的报道,如Lopez-Ferrer等[9]将高强度聚焦超声应用于蛋白质样品胶内酶切,可以在60 s内完成牛血清白蛋白的酶切,其酶切效率与传统过夜酶切无明显差异;Kirk等[10]研究了超声辅助酶切与常规方法对难以酶切蛋白的酶切效果,所使用的超声功率低于10 W,超声辅助酶切效率高于传统过夜酶切法。Lopez-Ferrer等[11]将超声辅助酶切法与固定化胰酶联合,用于血浆球蛋白等的酶切,并应用该方法标记酶切18O蛋白,可以将酶切时间缩短至30 s,且标记效率比常规酶切法高90%。
超声酶切方法所使用的超声功率不尽相同,其酶切效果也不完全一致,超声辅助酶切后,所得多肽的酶切特点有待于进一步研究。本研究拟应用简单样品(牛血清白蛋白)及复杂样品(人尿蛋白)对上述问题进行全面的比较和分析,以期得到最优的超声酶切方法及其酶切特点。
1 实验部分
1.1 仪器与试剂
基质辅助激光飞行时间质谱仪(MALDI-TOF):德国Bruker公司产品;Triple TOF 5600液质联用分析仪:美国AB Sciex公司产品;Acquity高效液相色谱仪:美国Waters公司产品;UP200S超声波细胞破碎仪:德国Heilscher公司产品;Powerpac 1000电泳仪:美国BioRad公司产品;电泳槽:美国Invitrogen公司产品。
牛血清白蛋白(Bovine serum albumin, BSA):北京鼎国生物技术有限公司产品;二硫苏糖醇(Dithiothreitol, DTT)、碘乙酰胺(Iodoacetamide, IAM)、血管紧张素II:均为美国Sigma公司产品;胰蛋白酶(质谱级):美国Promega公司产品;乙腈、甲酸、三氟乙酸、碳酸氢铵:均为色谱级,德国Merk公司产品;氯化钠、乙醇、盐酸:北京化学试剂公司产品;4%~12%聚丙烯酰胺(SDS)预制胶:美国Invitrogen公司产品。
1.2 蛋白样品的制备
人尿蛋白组样品来自10例健康男性和10例健康女性的晨尿,等量混合后以2 400 r/min离心30 min,去掉沉淀,向上清液中加入3倍体积的乙醇,于4 ℃过夜;然后以10 200 r/min离心30 min,沉淀蛋白溶解于裂解液(7 mol/L尿素,2 mol/L硫脲,0.1 mol/L二硫苏糖醇,50 mol/L三羟甲基氨基甲烷(Tris))中,所得蛋白样品使用Bradford法测定其浓度。
1.3 胶内酶切
首先将BSA及人尿蛋白组等量上样至预制胶进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后将BSA及人尿蛋白胶内酶切目标条带切下,将切成的体积约1 mm3的小粒分别放入1.5 mL EP管,示于图1。
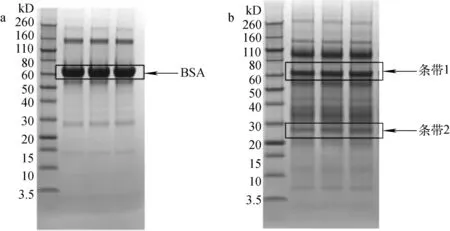
注:a为牛血清白蛋白SDS-PAGE胶图,将67 kD 处3个条带分别切下后进行胶内酶切;b为人尿蛋白SDS-PAGE胶图,随机选择2处不同分子质量条带,将同一分子质量条带分别切下混合后进行胶内酶切图1 胶内酶切条带Fig.1 Stripe on SDS-PAGE for in-gel digestion
使用含有50%乙腈的25 mmol/L NH4HCO3清洗胶粒,向胶粒中加入100%乙腈干燥,然后加入100 μL 10 mmol/L DTT-25 mmol/L NH4HCO3,于37 ℃恒温水浴箱中还原1 h;再加入100 μL 55 mmol/L IAM/25 mmol/L NH4HCO3,于室温避光反应45 min,加入100%乙腈使胶粒完全脱水;最后加入10 mg/L酶液至胶粒完全溶胀,于4 ℃冰箱中放置1 h。将样品置于37 ℃水浴中13 h后,以比例1∶50加入胰蛋白酶,继续水浴3 h后完成传统过夜酶切。超声辅助酶切法则用2 mm超声破碎仪探头伸入胶粒溶液中进行超声,功率分别为20、100、200 W,工作时间60 s,暂停30 s,2个循环后,再以比例1∶50加入胰蛋白酶,超声2个循环,完成酶切,得到的多肽用C18柱萃取后真空抽干。传统过夜酶切法和超声辅助酶切法的结果比较列于表1。
为了验证实验的可重复性,重复3次BSA样品的酶切处理方法,随机选取人尿蛋白组样品的2条蛋白条带进行分析。

表1 传统过夜酶切法和超声辅助酶切法的比较Table 1 Comparison of overnight and ultrasound-assisted digestion methods
1.4 质谱分析
BSA多肽溶于0.1%三氟乙酸(TFA)中,将1 μL样品点入384孔MALDI-TOF靶中,待样品自然干燥后,加入α-氰基-4-羟基肉桂酸(α-Cyano-4-hydrocycin-namie acid, CHCA)饱和溶解基质(70%乙腈,0.1% TFA),于室温下干燥。质谱方法采用反射正离子模式,加速电压20 kV,激光强度1%,质量扫描范围0.5~3.5 kD。
抽干后,将人尿蛋白组多肽样品溶解于0.1%甲酸(缓冲液A),进样至C18反相毛细管柱(100 mm×0.075 mm×3 μm)。多肽洗脱梯度为5%~30%,洗脱液为缓冲液B(0.1%甲酸,99.9%乙腈),洗脱液流速300 nL/min),洗脱时间40 min。用Triple TOF 5600对洗脱多肽进行鉴定,检测范围m/z350~1 250,每次全扫描后做30次二级扫描,母离子质荷比宽度为0.7 u,标准碰撞能量35%,动态排除时间15 s。
1.5 数据检索
使用MASCOT(Matrix Science, London, UK, V2.3.02)软件检索MALDI-TOF质谱图,数据库为牛的蛋白质数据库EBI(www. ebi.ac.uk)。检索参数为胰蛋白酶,误切位点为2,母离子质量误差为5×10-5,固定修饰为脲甲基化修饰Carbamidomethy(C),可变修饰为氨基甲酰化修饰Carbamy(N-term)。
使用MASCOT(Matrix Science, London, UK, V2.3.02)软件检索Triple TOF 5600质谱数据,数据库为SwissProt人的蛋白质数据库(www.uniprot.org, 20 227 entries)。搜索条件参数包括:酶为Trypsin,2处误切位点,多肽质量误差范围为5×10-8,脲甲基化修饰(Carbamidomethy)。检索结果用Scafford软件分析,蛋白假阳性率小于1%,特异性多肽数大于2,多肽假阳性率小于1%。非标记定量方法采用Progenesis(Nonlinear Dynamics, Version 4.0)软件分析。
2 实验结果
2.1 BSA超声辅助酶切结果
通过对标准蛋白BSA进行SDS-PAGE分离后,将67 kD处条带分别切下进行不同功率超声辅助胶内酶切及传统过夜胶内酶切。结果显示:200 W超声功率造成胶粒完全碎裂,以12 100 r/min离心30 min后仍呈混悬絮状;20 W超声胶粒碎裂程度明显较轻,离心后可见胶粒沉淀于管底,基本保持了胶粒的完整性;100 W超声对胶粒的碎裂程度介于两者之间,离心后部分胶粒沉淀于管底,结果示于图2。

图2 不同功率超声后胶粒碎裂情况Fig.2 Fracture of colloidal particles using different power ultrasound
分别对不同功率超声酶切和传统过夜酶切法得到的肽段进行MALDI-TOF质谱分析,得到的BSA肽指纹图谱示于图3。结果显示,不同超声功率方法得到的质谱图的主要多肽峰基本一致。用MASCOT软件对质谱图进行数据库检索,结果表明:20 W超声的酶切质谱鉴定结果优于100 W和200 W两种功率,且其MASCOT评分最高;100 W超声酶切方法比传统过夜酶切法高;200 W的MASCOT评分低于传统过夜酶切法;20 W超声酶切方法鉴定的多肽数和肽段覆盖率分别为65±2和(70±6)%,均高于其他两种功率和传统酶切法;传统酶切法的误切率为(37.9±4)%,低于超声酶切法,详细情况列于表2。
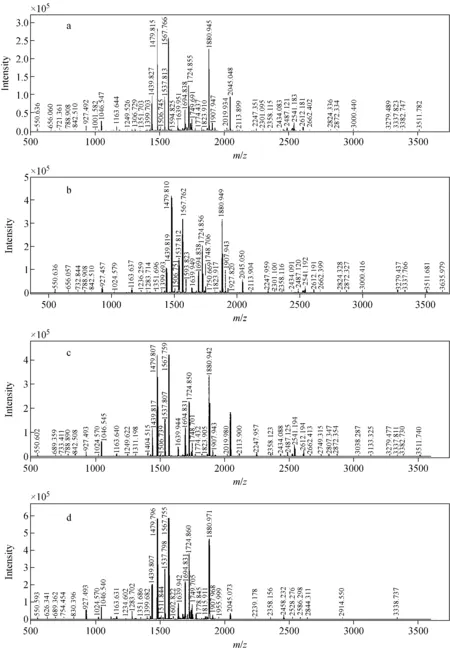
注:a.20 W超声;b.100 W超声;c.200 W;d.传统过夜图3 不同方法酶切BSA后的肽指纹质谱图Fig.3 MALDI fingerprint mass spectrum of BSA peptide from different enzyme digestion methods
2.2 人尿蛋白组超声辅助酶切方法结果
对复杂蛋白样品人尿蛋白组进行SDS-PAGE分离后,随机将两处不同分子质量的条带分别切下,进行不同功率超声辅助胶内酶切及传统过夜胶内酶切分析。结果显示,不同功率造成的2个条带胶粒碎裂情况与BSA一致,20 W时对胶粒的破坏性最小,200 W时最大。
LC-MS/MS质谱数据结果列于表3。可见,超声功率为20 W时在条带1和2中鉴定到的蛋白数、多肽数和鉴定效率最高,分别为168和199、1 610和1 018及13.8%和9.1%;20 W和100 W超声方法鉴定到的蛋白数、多肽数及鉴定效率均高于传统过夜法;但20 W超声酶切方法误切率高于传统酶切方法。

表2 超声辅助酶切法及传统过夜法酶切BSA的质谱鉴定结果Table 2 Mass spectrum identification results of BSA using ultrasound-assisted digestion and traditional overnight digestion

表3 不同酶切方法处理人尿蛋白组条带的质谱鉴定结果Table 3 Mass spectrum identification results of human urinary proteome using different power ultrasound-assisted digestion
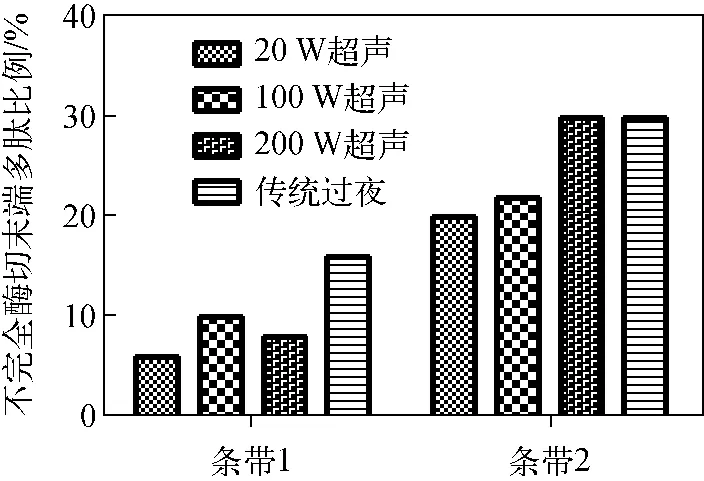
图4 人尿蛋白两条带不完全酶切末端多肽比例Fig.4 Semi-tryptic peptide rate of two different digestion methods of two stripes on human urine protein gel
对不完全酶切多肽率分析表明,传统过夜法在2个蛋白条带中所鉴定到的不完全酶切多肽率分别为15.93%和29.47%,均高于超声酶切方法,示于图4。为进一步说明超声方法的酶切特点,采用非标记定量方法对超声方法和传统过夜方法共同鉴定到的多肽进行分析,结果示于图5。在多肽误切率方面,条带1和2所鉴定到的多肽中,超声辅助酶切的完全酶切多肽的丰度低于传统酶切法,而1个位点和2个位点误切多肽的丰度均高于传统酶切法。在不完全酶切多肽率方面,超声方法的完全酶切多肽丰度高于传统方法,而不完全酶切多肽丰度低于传统方法。
2.3 多肽误切位点分析
根据以往研究[12],胰酶误切位点可分为天冬氨酸/谷氨酸(D/E),脯氨酸(P)和连续赖氨酸或精氨酸(KK/RR/KR)序列几种类型。通过对简单样品BSA和复杂样品人尿蛋白酶切得到的多肽误切位点分析发现,BSA误切类型以D/E为主(38.25±3.03)%,人尿蛋白除D/E类型(32.59±6.20)%外,P和KK/RR/KR也占较高的比例,分别为(23.83±6.03)%和(25.99±13.80)%,结果列于表4。比较复杂样品人尿蛋白的传统过夜法和超声酶切法误切类型发现:在D/E类型中,超声法高于过夜法,分别为(35.76±2.2)%和(23.07±1.76)%;在P类型中,过夜法明显高于超声法,分别为(46.49±11.97)%和(19.16±2.21)%;各种胰酶误切类型在3种功率超声酶切方法中无明显差别。
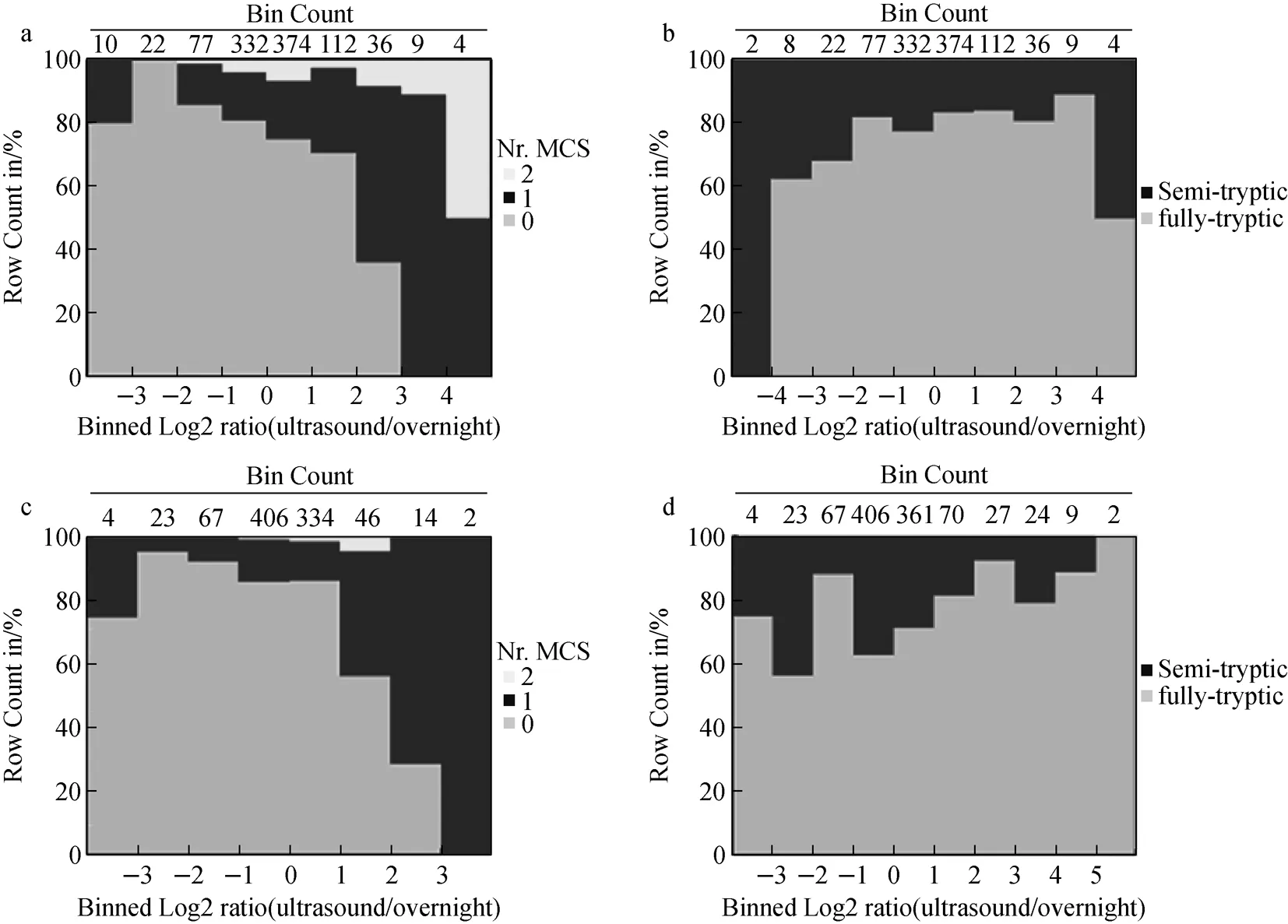
注:a.条带1完全酶切和有误切位点多肽强度分布;b.条带1完全酶切和不完全酶切多肽强度分布;c.条带2完全酶切和有误切位点多肽强度分布;d.条带2完全酶切和不完全酶切多肽强度分布图5 人尿蛋白组条带超声辅助酶切及传统过夜酶切定量分析对比Fig.5 Quantitative comparisons of ultrasound-assisted and overnight in in-gel digestion
表4 不同方法处理人尿蛋白和牛血清白蛋白误切位点
Table 4 Mis-cleavage site of human urinary protein and BSA after different digestion methods
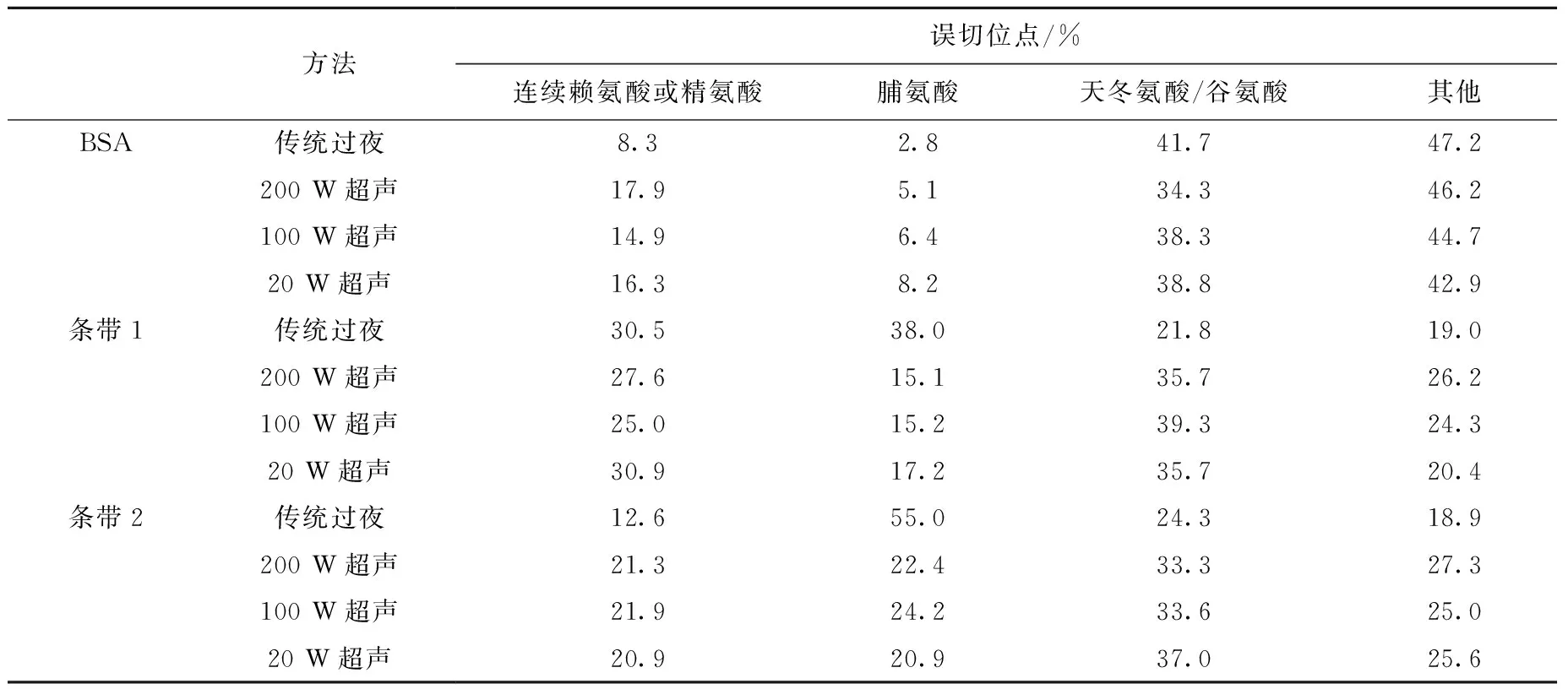
方法误切位点/%连续赖氨酸或精氨酸脯氨酸天冬氨酸/谷氨酸其他BSA传统过夜8.32.841.747.2200W超声17.95.134.346.2100W超声14.96.438.344.720W超声16.38.238.842.9条带1传统过夜30.538.021.819.0200W超声27.615.135.726.2100W超声25.015.239.324.320W超声30.917.235.720.4条带2传统过夜12.655.024.318.9200W超声21.322.433.327.3100W超声21.924.233.625.020W超声20.920.937.025.6
3 讨论
本研究在探索超声辅助酶切功率优化的基础上,阐述了超声辅助酶切方法胶内酶切的特点。通过对简单样品BSA 及复杂样品人尿蛋白进行胶内酶切,表明超声辅助酶切法可以在10 min内完成酶切。质谱分析结果表明,在BSA 及人尿蛋白样品中,采用3种不同超声功率进行胶内酶切后,20 W超声功率对胶粒的破坏最小,得到的蛋白数、多肽数、鉴定效率最高。这可能是由于超声功率越强,造成胶粒碎裂的程度越大,引起胶粒丢失越多,导致鉴定结果降低。
通过对超声辅助酶切法及传统过夜酶切法得到的多肽特点的定性和定量分析表明,无论是简单样品还是复杂样品,超声辅助酶切法的误切率均高于传统过夜酶切法,这可能是由于超声时间过短,降低了酶切准确性。同时,超声酶切法的不完全酶切率低于传统过夜法,这可能是传统酶切时间过长,导致了非特异性酶切。
本实验结果显示,简单样品BSA与复杂样品人尿蛋白的胰酶误切类型特点差别明显,说明胰酶误切类型和蛋白质的属性有明显的相关性。在复杂样品中,过夜酶切法主要误切类型为P,超声辅助酶切法主要误切类型为D/E。这可能是由于传统过夜酶切时间较长,碱性的缓冲液为胰酶反应提供了适宜的酶切环境,能够充分进行酶切,因此D/E误切较少;而超声法酶切时间短,酶切不充分,所以D/E误切较多。在P类型中,超声条件下,蛋白质受能量作用可能更容易使酶切位点结构暴露出来,从而减少P位阻产生的误切,因此超声法产生的P类型误切多肽比过夜法少。3种超声方法之间各种误切类型所占比例均无明显差别,说明超声功率大小对胰酶误切没有影响。
综上所述,20 W超声辅助酶切法效果最好,优于传统酶切方法。同时其误切率较高,但不完全酶切率较低,因此在蛋白质组学研究中,采用超声辅助酶切法不仅可以有效地缩短酶切时间,而且能够提高蛋白、多肽鉴定效果,适用于发现蛋白质组学研究。
[1] HAVLIS J, THOMAS H, SEBELA M, et al. Fast-response proteomics by accelerated in-gel digestion of proteins[J]. Analytical Chemistry, 2003, 75(6): 1 300-1 306.
[2] WISNIEWSKI J R, ZOUGMANA, NAGARAJ N, et al. Universal sample preparation method for proteome analysis[J]. Nature Methods, 2009, 6(5): 359-362.
[3] SUN W, GAO S, GAO Y, et al. Microwave-assisted protein preparation and enzymatic digestion in proteomics[J]. Molecular & Cellular Proteomics, 2006, 5(4): 769-776.
[4] 王鸿丽,刘炳玉,谷苗,等. 改进的质谱兼容的胶内酶切方法[J]. 军事医学科学院院刊,2005,29(2):168-172.
WANG Hongli, LIU Bingyu, GU Miao, et al. Improved method of in-gel digestion compatible for mass spectrometry[J]. Military Medical Sciences, 2005, 29(2): 168-172(in Chinese).
[5] PRAMANIK B N, MIRZA U A, ING Y H, et al. Microwave-enhanced enzyme reaction for protein mapping by mass spectrometry: a new approach to protein digestion in minutes[J]. Protein Science, 2002, 11(11): 2 676-2 687.
[6] ZHONG H, ZHANG Y, WEN Z, et al. Protein sequencing by mass analysis of polypeptide ladders after controlled protein hydrolysis[J]. Nature Biotechnology, 2004, 22(10): 1 291-1 296.
[7] HAVLIS J, THOMAS H, SEBELA M, et al. Fast-response proteomics by accelerated in-gel digestion of proteins[J]. Analytical Chemistry, 2003, 75(6): 1 300-1 306.
[8] 胡炜,付强,朱平川,等. 用于质谱鉴定蛋白质胶内酶解方法的优化[J]. 南方农业学报,2011,42(7):802-805.
HU Wei, FU Qiang, ZHU Pingchuan, et al. Optimization of in-gel protein digestion method for mass spectrometry identification[J]. Guangxi Agricultural Sciences, 2011, 42(7): 802-805(in Chinese).
[9] LOPEZ-FERRER D, CAPELO J L, VAZQUEZ J. Ultra fast trypsin digestion of proteins by high intensity focused ultrasound[J]. Journal of Proteome Research, 2005, 4(5): 1 569-1 574.
[10]KIRK C H, LAUREN K, ORI M, et al. An in-solution ultrasonication-assisted digestion method for improved extra cellular matrix proteome coverage[J]. Mol Cell Proteomics, 2009, 8(7): 1 648-1 657.
[11]LOPEZ-FERRER D, HIXSON K K, SMALLWOOD H, et al. Evaluation of a high-intensity focused ultrasound-immobilized trypsin digestion and18O-labeling method for quantitative proteomics[J]. Analytical Chemistry, 2009, 81(15): 6 272-6 277.
[12]KEIL B. Specificity of proteolysis[M]. New York, 1992.
Optimization of Ultrasound-Assisted In-Gel Digestion Method and Analysis of Peptide Characteristics
XIAO Xiao-ping, GUO Zheng-guang, CHENG Jie, SUN Wei
(CoreFacilityofInstrument,InstituteofBasicMedicalSciences,CAMS&PUMC,Beijing100005,China)
Bovine serum albumin and human urinary protein gel bands of two different molecular weight were digested by 20 W, 100 W and 200 W ultrasound-assisted in-gel digestion method, and the digested peptides were analyzed by high-resolution mass spectrometry. By comparing the number of identified proteins and peptides, the optimal ultrasonic power for ultrasound-assisted in-gel digestion was determined. Meanwhile, the peptide characteristics of ultrasound-assisted in-gel digestion method were analyzed by comparing with traditional overnight digestion method. 20 W ultrasound-assisted in-gel digestion method shows the minimal gel damage and loss for in-gel protein samples, the number of peptides identified in BSA is 65, while the number of identified peptides from 100 W, 200 W and the traditional overnight digestion methods is 57, 51 and 41, respectively, much lower than 20 W ultrasound-assisted in-gel digestion method. The number of proteins identified in two different gel bands of human urinary protein in 20 W ultrasound-assisted in-gel digestion method is 168 and 199, respectively, which is better than 100 W, 200 W and the traditional overnight digestion method. By analyzing the mis-cleavage rate and semi-tryptic rate of peptides based on the qualitative and quantitative analysis, the mis-cleavage rate of ultrasound-assistedin-gel digestion is higher than traditional overnight digestion method, while the semi-tryptic rate of ultrasound-assisted in-gel digestion is lower. The mis-cleavage type analysis of identified peptides indicates that traditional overnight method can generate more Proline (P) type mis-cleavage peptides, and ultrasound-assisted in-gel digestion method produces more aspartate/glutamate (D/E) type mis-cleavage peptides. The mis-cleavage peptide types from three ultrasound powers show no significant differences. Compared with traditional overnight digestion method, ultrasound-assisted in-gel digestion method can significantly shorten in-gel protein digestion time and 20 W ultrasonic power shows the best digestion results compared with 100 W ultrasonic power and 200 W ultrasonic power. Furthermore, ultrasound-assisted in-gel digestion method can obtain more protein/peptide identifications. The peptide mis-cleavage rate in ultrasound-assisted in-gel digestion method is higher than traditional overnight digestion method, while the semi-tryptic rate is lower. Above results will benefit the application of ultrasound-assisted in-gel digestion method for proteomic analysis.
proteome; in-gel digestion; ultrasound-assisted digestion
2016-04-18;
2016-06-28
国家重点基础研究发展计划(2013CB530805、2014CBA02005);中国科技部重点基础研究发展计划(2013FY114100)资助
肖晓萍(1990—),女(汉族),福建人,硕士研究生,药理学专业。E-mail: 18201145501@sina.cn
孙 伟(1973—),男(汉族),吉林人,副研究员,从事临床蛋白质组学研究。E-mail: sunwei1018@sina.com
时间:2016-12-28;
http:∥www.cnki.net/kcms/detail/11.2979.TH.20161228.0927.008.html
O657.63
A
1004-2997(2017)02-0187-08
10.7538/zpxb.youxian.2016.0058
