透视实验方案的设计与评价
2017-03-28朱霞
朱霞


化学实验方案的设计题突出能力立意,考查学生的观察能力、思维能力、实验能力、评价能力和文字表达能力,是近年中考化学常见的试题类型,题材主要源于教材的实验,是实验重组、拓展题,立意具有创新性。
一、实验方案设计的基本要求
1.科学性:实验原理、实验方法和操作过程必须科学。
2.可行性:设计的实验方案要切实可行,所用药品、仪器、装置安全可靠。
3.安全性:实验操作要尽量避免带有危险性的操作,尽量避免与有毒物质接触。
4.简约性:实验方案设计要求操作简便、装置简单、实验现象明显。
二、一般解题思路和方法
1.明确目的原理——明确实验目的,弄清题给信息。
2.选择仪器药品——选择合理的化学仪器和药品。
3.设计装置步骤——设计出合理的实验装置和实验操作步骤。
4.记录现象和数据——全面、及时而又准确地记录实验过程中的现象和数据。
5.分析得到结论——根据实验观察到的现象和记录的数据,通过分析、计算、图表、推理等处理得出正确的结论。
三、实验方案的评价
实验设计的评价包括实验原理及方案的评价、实验装置的评价、实验操作的评价、实验现象的描述与结论分析的评价等。一般从以下几个方面入手:
1.方案在理论上是否科学合理,是否具有严密性。
2.在满足安全性的前提下,操作上是否简便。
3.从经济角度评价,是否节约试剂、降低成本和提高产品质量。
4.从环境角度考虑,是否会给环境造成污染。
四、例题解析
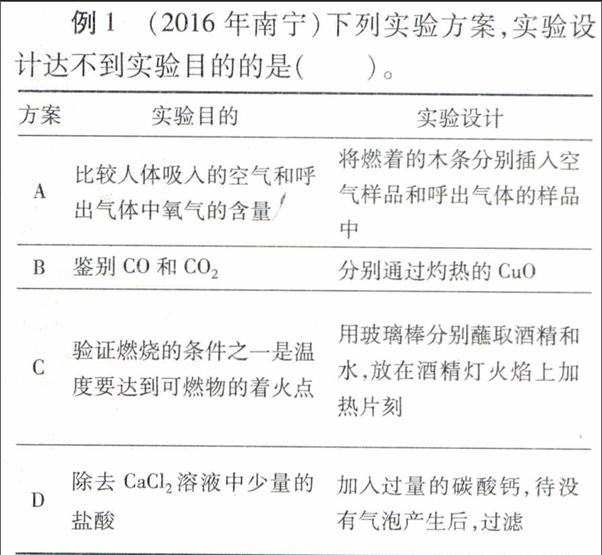
例1 (2016年南宁)下列实验方案,实验设计达不到实验目的的是( )。
方案实验目的实验设计
A比较人体吸入的空气和呼出气体中氧气的含量
将燃着的木条分别插入空气样品和呼出气体的样品中
B鉴别CO和CO2分别通过灼热的CuO
C验证燃烧的条件之一是温度要达到可燃物的着火点用玻璃棒分别蘸取酒精和水,放在酒精灯火焰上加热片刻
D除去CaCl2溶液中少量的盐酸加入过量的碳酸钙,待没有气泡产生后,过滤
解析 将燃着的木条分别插入空气样品和呼出气体的样品中,插入空气的木条正常燃烧,插入呼出气体的木条熄灭,A方案可以比较人体吸入的空气和呼出气体中氧气的含量;一氧化碳具有还原性,能与灼热的氧化铜反应生成铜和二氧化碳,二氧化碳不能,B方案可以鉴别CO和CO2;用玻璃棒分别蘸取酒精和水,放在酒精灯火焰上加热片刻,蘸取酒精的可以燃烧,蘸取水的不能燃烧,因此C方案验证了燃烧的条件之一是可燃物;盐酸能与碳酸钙反应生成氯化钙、水和二氧化碳,再过滤除去过量的碳酸钙,D方案能除去杂质且没有引入新的杂质,符合除杂原则。
答案:C。
例2 (2016年泰安)某同学设计了以下四个实验方案,理论上正确,操作上可行,经济上合理的是( )。
A.Cu稀盐酸CuCl2NaOH溶液Cu(OH)2
B.H2O通电O2MgMgO
C.CaCO3高温CaOH2OCa(OH)2Na2CO3NaOH溶液
D.MgCl2NaOH溶液Mg(OH)2NaMg
解析 铜不与稀盐酸反应,A方案在理论上是错误的;水通电分解生成氢气和氧气,镁与氧气反应生成氧化镁,B方案理论上正确,但水通电分解制取氧气成本较高,经济上不合理;碳酸钙高温下分解生成氧化钙和二氧化碳,氧化钙与水反应可生成氢氧化钙,氢氧化钙与碳酸钠反应生成氢氧化钠和碳酸钙沉淀;C方案理论上正确,操作上较为简便,经济上也合理;氯化镁与氢氧化钠溶液反应生成氢氧化镁沉淀和氯化钠,但钠不与氢氧化镁反应生成镁,D方案在理论上是错误的。
答案:C。
例3 (2016年龙东)某同学在研究硫酸化学性质时,将一定量的稀硫酸放入盛有氧化铜的试管中,观察到固体完全溶解,溶液变蓝色。
反应的化学方程式是。
同学们对于反应后溶液中的溶质成分产生了兴趣,进行了如下探究:
【猜想与假设】猜想一:硫酸铜;猜想二:(化学式)。
【活动与探究】甲同学取少量反应后的溶液于试管中,滴加氯化钡溶液,观察到有白色沉淀产生,认为猜想一成立。
乙同学取少量反应后的溶液于试管中,加入足量的铁粉,观察到有红色固体出现、的现象,认为猜想二成立。
【反思与评价】丙同学进行分析认为同学的方案不合理,理由是。
解析 氧化铜和稀硫酸反应生成硫酸铜和水。【猜想与假设】“固体完全溶解”说明氧化铜完全反应,没有剩余;对于稀硫酸,可能恰好完全反应,也可能有剩余,所以反应后的溶液中的溶质有两种可能,一是硫酸铜;二是硫酸铜和稀硫酸。【活动与探究】由题意认为猜想二成立,即含有硫酸的溶质为硫酸、硫酸铜两种,加入铁粉的现象为有红色固体出现,溶液由蓝色变为浅绿色,且有气泡产生。【反思与评价】氯化钡与硫酸、硫酸铜都能反应,产生白色沉淀,不能判断溶液中是否含有硫酸,甲方案不合理。
答案:CuO+H2SO4CuSO4+H2OCuSO4、H2SO4 产生气泡,溶液由蓝色变为浅绿色 甲 氯化钡与硫酸、硫酸铜都能反应,产生白色沉淀,不能判断溶液中是否有硫酸
例4 (2016年海南)实验室有一瓶敞口放置的过氧化钠(Na2O2)固体,同学们想知道这瓶过氧化钠是否变质,进行如下实验探究:
【查阅资料】2Na2O2+2CO22Na2CO3+O2,2Na2O2+2H2O4NaOH+O2↑。
【提出猜想】①没有变质 ②部分变质 ③全部变质
【实验过程及结论】
(1)取少量样品于试管中,加入足量水,无明显现象,证明猜想正确(填序号)。
(2)取少量(1)中所得溶液于试管中,滴加适量稀盐酸,有无色气体产生,证明原样品中一定含有。
(3)请在原有实验的基础上,进一步设计实验证明原样品中还可能含有什么物質。(简写实验步骤、现象和结论)。
解析 (1)由资料可知,过氧化钠能与水反应生成氧气。而(1)中加入足量的水,无明显现象,说明样品中没有过氧化钠,故是全部变质,猜想③正确。(2)氢氧化钠与盐酸反应无明显现象,碳酸钠与盐酸反应有大量的无色气体产生,则原样品中一定含有碳酸钠。(3)由【查阅资料】可知,过氧化钠变质后的成分可能是碳酸钠或氢氧化钠或二者都有,由步骤(2)可知原样品中含有碳酸钠,因此,设计实验时要排除碳酸钠的干扰,并选取合适的试剂证明是否还含有氢氧化钠,除去碳酸钠可用CaCl2或BaCl2等[不能用Ca(OH)2或Ba(OH)2,因为Ca(OH)2或Ba(OH)2与Na2CO3反应能生成NaOH,从而无法确定NaOH的存在],检验NaOH可用酚酞试液、CuCl2等。
答案:(1)③ (2)碳酸钠 (3)取少量(1)中所得溶液于试管中(或取少量原样品于试管中,加入足量水溶解),加入足量的CaCl2溶液(或BaCl2溶液),充分反应后静置,取上层清液于试管中,滴加酚酞试液,若溶液变红,则原样品中含有氢氧化钠,反之则不含氢氧化钠
