超声辅助萃取-梯度波长高效液相色谱法同时测定金樱子中6 种活性成分
2017-03-27廖安辉周光明陈军华张彩虹
廖安辉,周光明,陈军华,高 意,于 璐,张彩虹
(西南大学化学化工学院,发光与实时分析教育部重点实验室,重庆 400715)
超声辅助萃取-梯度波长高效液相色谱法同时测定金樱子中6 种活性成分
廖安辉,周光明*,陈军华,高 意,于 璐,张彩虹
(西南大学化学化工学院,发光与实时分析教育部重点实验室,重庆 400715)
目的:建立超声辅助萃取高效液相色谱法同时测定金樱子中没食子酸、儿茶素、芦丁、槲皮素、山柰酚和芹菜素6 种活性成分的方法。方法:采用InertSustain C18(150 mm×4.6 mm,5 μm)色谱柱;流动相为甲醇(B)-0.1%乙酸溶液(A);线性梯度洗脱;流速1.0 mL/min;紫外检测梯度波长为280 nm(0~5.00 min)、350 nm(5.00~20.00 min);柱温35 ℃;进样量20 μL。结果:该条件下6 种成分的分离度良好,标准曲线线性范围良好,r不低于0.999 1(n=6),平均加标回收率(n=3)为96.21%~110.39%(相对标准偏差不高于3.14%)。结论:方法简便、快速、准确,可为药用植物金樱子的定量检测和质量控制提供实验依据。
超声辅助萃取;高效液相色谱;金樱子;梯度波长;黄酮类化合物
中药金樱子(Rosae Laevigatae Fructus)为蔷薇科常绿蔓性灌木金樱子的种子,又名刺榆子、金罂子等[1-2]。金樱子作为一种传统中药,其味酸、甘、涩、平;归肾、膀胱、大肠经;果实入药,有利尿、降血脂作用[3-4]。现代医学研究表明,金樱子具有收涩、固精、止泻等功效,具有良好的生物活性和药用功能,是一味很有价值的药食两用中药[5-8]。据文献报道,金樱子中的化学成分主要有甾体、三萜、酚酸、苯丙素和多糖等化合物,还含有维生素、氨基酸、柠檬酸、亚油酸及其衍生物等成分[9-11]。其中黄酮类化合物、有机酸化合物等具有非常好的抗氧化[12-13]、抗炎[14]和抗肿瘤作用[15-16],Zhang Shuai等[17]研究表明黄酮类化合物可以有效地提高缺血性脑卒患者的生存率;Liu Yuetao等[18]研究表明黄酮类化合物可明显降低小白鼠的血脂含量。此外,黄酮类化合物对小鼠肝脏急性损伤还具有保护作用[19-21]。因此很有必要对金樱子中黄酮和有机酸成分进行定性和定量分析。
金樱子中黄酮类化合物提取方法主要有超声波辅助提取[22]、酶法提取[23]、微波技术提取[24]等;检测方法包括紫外光谱检测[25]、双波长薄层扫描法[26]、大孔树脂注层法[27]等。目前,对于金樱子中总黄酮测定的研究较多,如薛梅等[28]报道了金樱子中的总黄酮的提取及含量测定;陈乃富等[29]对金樱子中总黄酮高效液相色谱指纹图谱进行了研究。但是,鲜见金樱子多种黄酮的分离和定量的报道,黄云祥等[30]利用高效液相法仅仅分离了金樱子中的3 种黄酮类化合物。为了更好地评估金樱子的药材质量,有必要进一步研究其中黄酮等成分的含量。因此,本实验利用超声辅助萃取-高效液相色谱法完成了金樱子中没食子酸、儿茶素、芦丁、槲皮素、山柰酚和芹菜素6 种成分的同时分离和定量分析。该方法测定快速、重复性好且检测限低,这为金樱子的质量控制和评估提供新的参考依据。
1 材料与方法
1.1 材料与试剂
金樱子购于重庆市药房。
没食子酸、儿茶素、芦丁、槲皮素、山柰酚和芹菜素对照品(纯度均≥98.5%) 上海晶纯实业有限公司;乙酸(分析纯)、甲醇(色谱纯) 重庆川东化工有限公司化学试剂厂;二次蒸馏水 实验室自制。
1.2 仪器与设备
LC-20A高效液相色谱仪(包括SPD-20A紫外检测器、CTO-10AS柱温箱、LC-20AT泵) 日本岛津公司;KH-3200B型超声波清洗器 昆山禾创超声仪器有限公司;SZ-2自动双重纯化水蒸馏器 上海沪西分析仪器厂有限公司;XY型电热恒温干燥箱 上海精宏实验设备有限公司;FA2004A型分析天平 上海精天电子仪器有限公司。
1.3 方法
1.3.1 对照品溶液的配制
精密称定各对照品适量于10 mL容量瓶中,甲醇稀释至刻度,分别配制成质量浓度500.0 μg/mL没食子酸、760.0 μg/mL儿茶素、500.0 μg/mL芦丁、500.0 μg/mL槲皮素、460.0 μg/mL山柰酚和700.0 μg/mL芹菜素的对照品溶液。分别精密吸取对照品溶液各1.0 mL于10 mL容量瓶中,用甲醇定容至刻度,制成混合对照品溶液,置于冰箱(4 ℃)内避光保存备用。
1.3.2 样品溶液的配制
精密称取去核金樱子果实壳干燥粉末(过60 目筛)0.1 g,置于具塞锥形瓶中,准确加入80%甲醇溶液8 mL,称定质量,超声20 min(120 W,40 kHz),放冷,再称定质量,用80%甲醇溶液补足减失的质量,摇匀,静止,取上清液用0.45 μm微孔滤膜过滤,即得样品溶液。
1.3.3 色谱条件
色谱柱:InertSustain C18(150 mm×4.6 mm,5 μm);流动相:甲醇为流动相B,乙酸(pH 3.0)为流动相A,梯度洗脱(0~5 min,28%~50% B;5~1 5 m i n,5 0%~6 0% B;1 5~2 0 m i n,60%~28% B);流速:1.0 mL/min;进样量:20 μL;检测波长:0~5 min,280 nm;5~20 min,350 nm;柱温:35 ℃。
2 结果与分析
2.1 样品和对照品的色谱图
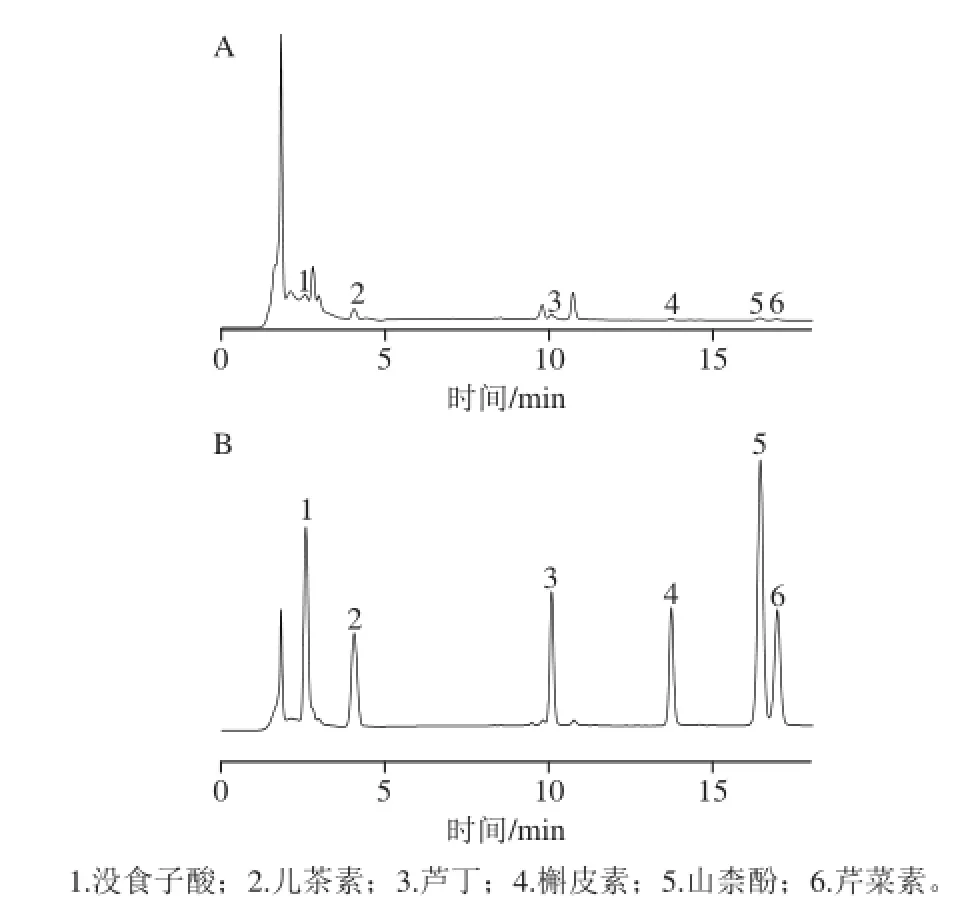
图1 样品(A)和混合对照品(B)色谱图Fig.1 Chromatograms of sample (A) and mixed standards (B)
样品和标准对照品的色谱图见图1。当两相邻峰之间的分离度R(两峰保留时间差与两峰峰底宽平均值之商)大于1.5即为完全分离;经计算得6 个成分与相邻组分的分离度介于1.51~4.8,说明已得到完全分离。图谱选用拖尾因子T(5%峰高处峰宽与峰顶点至前沿的距离比)作为评价峰形的参数,T在0.95~1.05之间则说明峰形良好,经计算得组分1、3和6的T值1.09~1.13,说明存在一定的拖尾现象,这可能是因为样品溶液中含有其他难分离的杂质所致;而组分2、4和5的T值均在0.96~1.03之间,说明峰形良好。
2.2 实验条件考察结果
2.2.1 流动相对分离效果的影响
本实验分别比较了甲醇、乙醇与不同pH值乙酸溶液作为流动相的分离效果。结果表明当pH 3.0时的乙酸溶液作为流动相A时能够有效改善芹菜素色谱峰的拖尾现象。对比甲醇和乙醇作为流动相B时的色谱峰,发现甲醇作为流动相时山柰酚和芹菜素的分离度明显大于乙醇作为流动相的分离度,这可能是由于乙醇的极性弱于甲醇,使得山柰酚和芹菜素的分离效果较差。为了改善色谱峰的峰形和避免样品基质中杂质对分析目标物的干扰,不断调节流动相的比例,最终确定了1.3.3节中的梯度洗脱条件。
2.2.2 波长对检测效果的影响
查阅文献可知没食子酸、儿茶素、芦丁分别在273、280、360 nm波长处有最大吸收,而槲皮素、山柰酚和芹菜素分别在360、360、350 nm波长处有最大吸收。综合考虑后,实验比较了样品在254、280、320、350 nm波长处的吸收强度。结果表明待测成分在280 nm波长条件下均有较强吸收,但在此条件下也有较多杂质吸收峰,且在15 min后出现基线漂移现象;而在350 nm波长条件下,虽然没食子酸和儿茶素无吸收,但芦丁、槲皮素、山柰酚和芹菜素的出峰效果良好,且基线平稳、杂峰较少;所以最终采用1.3.3节中的梯度波长为最佳检测条件。
2.3 单因素试验结果
2.3.1 甲醇溶液体积分数的确定
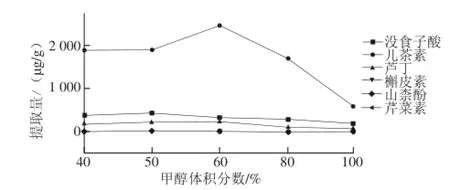
图2 甲醇体积分数对提取量的影响Fig.2 Effect of methanol concentration on the extraction eff i ciency
实验比较了40%、50%、60%、80%和100%甲醇体积分数作为提取溶剂的提取效果,图2表明:6种分析物的提取量随着甲醇体积分数的增大而先增大后减小,最终确定60%甲醇体积分数作为最佳提取溶剂体积分数。
2.3.2 固液比的确定
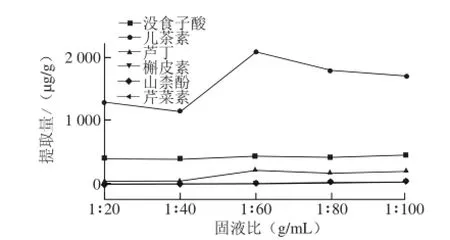
图3 固液比对提取量的影响Fig.3 Effect of solid-to-liquid ratio on the extraction eff i ciency
本实验还比较了固液比分别为1∶20、1∶40、1∶60、1∶80、1∶100(g/mL)的提取效果,结果如图3所示,当固液比为1∶60时,所测组分总提取量最高,故选择1∶60的固液比进行下一步试验。
2.3.3 超声时间的确定
本实验比较了甲醇超声时间分别为10、20、30、40、50 min时所测6 种目标组分含量,结果表明样品超声10、30 min时提取量较低,在20 min得到的所测组分的总含量最高,40、50 min时提取量较30 min有所增加,但增量不明显,故选择20 min为最佳超声时间,超声时间对6 种活性成分提取量的影响见图4。
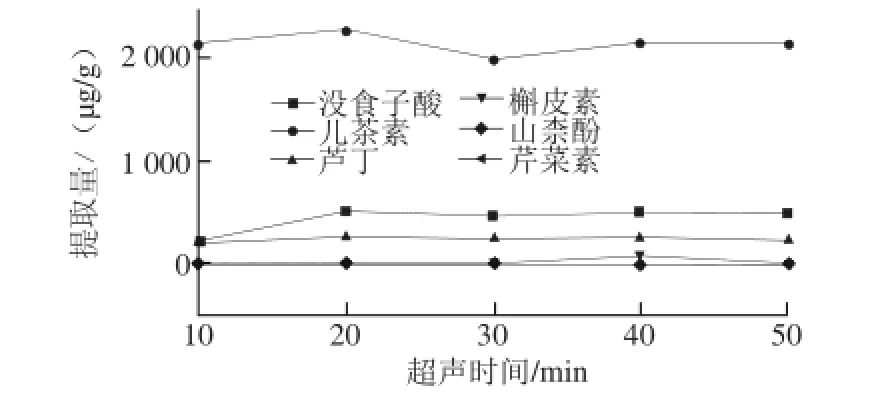
图4 超声时间对提取量的影响Fig.4 Effect of ultrasound treatment time on the extraction eff i ciency
2.3.4 超声功率的确定
实验进一步比较了40%、60%、70%、80%、100%功率条件下所测组分提取量,结果表明在最大功率的60%(120 W)时提取出的6种活性成分量最高,故选择最大功率的60%(120 W)为最佳超声功率,超声功率对6 种活性成分提取量的影响见图5。
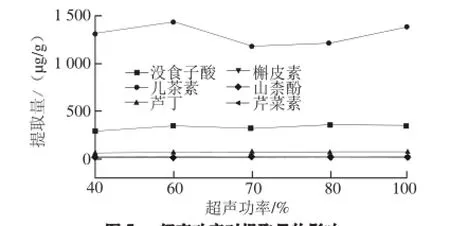
图5 超声功率对提取量的影响Fig.5 Effect of ultrasound power on the extraction eff i ciency
2.4 正交试验结果
为进一步优化提取条件,本实验采用L9(34)正交试验优化各参数,其中主要考察甲醇体积分数、固液比、超声时间和超声功率4 个影响因素,各取3 个水平,试验中利用6 种成分的提取总量来评价提取性能。正交试验设计的结果及直观分析见表1。从表1的极差R可知,各因素对6种成分提取总量的影响程度依次为B>D>C>A,即超声功率和甲醇体积分数是影响6种成分提取总量的主要因素,两因素影响值接近且远大于超声时间的影响值。从直观分析结果(表1)中可得提取6 种成分的最佳条件为A1B3C3D3,即超声时间20 min、超声功率200 W、固液比1∶100、甲醇体积分数60%。
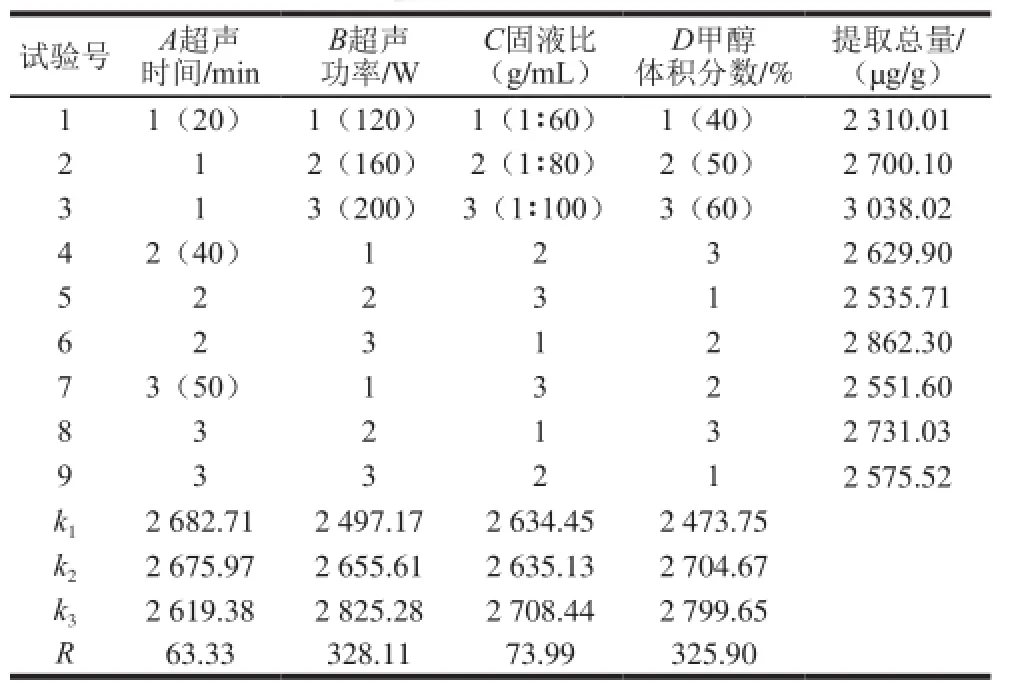
表1 正交试验设计和结果的直观分析Table1 Orthogonal array design with intuitive analysis of experimental results
2.5 实验方法学结果
2.5.1 线性关系考察结果
精确吸取混合对照品溶液(1.3.1节制得),以50%甲醇溶液逐步稀释为8 个不同质量浓度的混合对照品溶液,由低质量浓度到高质量浓度每个质量浓度依次进样3 次,并在1.3.3节色谱条件下进行分析。最后以对照品质量浓度为横坐标X,平均峰面积为纵坐标Y,进行线性回归分析。6 种被测成分的线性关系考察结果见表2。该条件下6 种成分的分离度良好,标准曲线线性范围良好,相关系数r不低于0.999 1(n=6)。
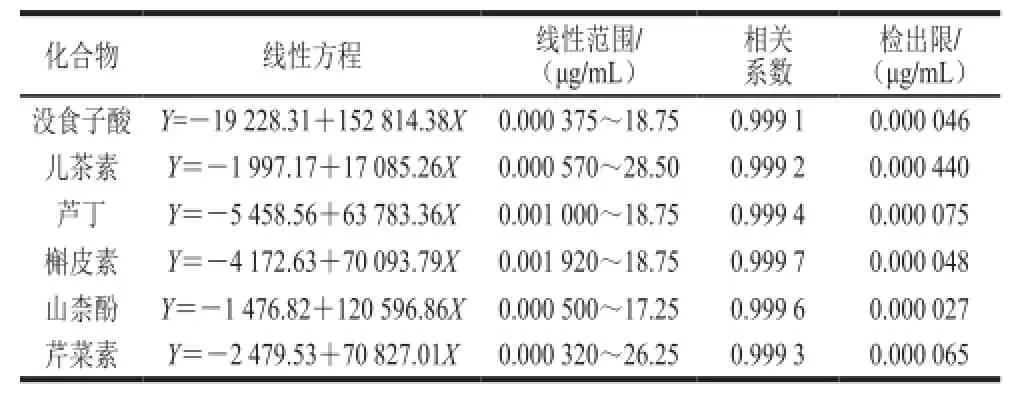
表2 6 种被测成分的线性方程、线性范围和相关系数Table2 Regression equations, linear ranges and correlation coeff i cients of 6 compounds
2.5.2 精密度实验结果
取混合对照品溶液重复进样6 次,测定各个对照品的峰面积,结果没食子酸、儿茶素、芦丁、槲皮素、山柰酚和芹菜素平均峰面积的相对标准偏差分别为1.76%、1.63%、1.45%、1.21%、1.33%、1.26%,表明仪器精确度良好。
2.5.3 稳定性实验和重复性实验结果
吸取同一供试溶液2 d内每隔3 h进样测分析,结果表明没食子酸、儿茶素、芦丁、槲皮素、山柰酚和芹菜素平均峰面积相对标准偏差分别为1.57%、1.34%、1.52%、1.19%、1.27%、1.42%,由此表明该方法具有良好的稳定性。称取同一批样品6份制备供试品溶液(按照1.3.2节方法制备),分别进样分析,结果显示没食子酸、儿茶素、芦丁、槲皮素、山柰酚和芹菜素平均峰面积相对标准偏差(n=6)分别为1.37%、1.37%、1.29%、1.04%、0.95%、0.93%,表明仪器重复性良好。
2.5.4 样品的含量测定及回收率实验结果
取金樱子粉末制备供试品溶液3 份(以1.3.2节中的方法),每份样品进样测定分析,根据表2中的线性方程得出样品中各个成分的含量,结果表明金樱子中含有没食子酸450.1 μg/g、儿茶素2 324.6 μg/g、芦丁182.4 μg/g、槲皮素20.8 μg/g、山柰酚8.2 μg/g、芹菜素12.1 μg/g。称取9 份同一批次粉末各0.1 g,每3 个为一组,每组按照低、中、高分别加入对应含量的对照品溶液,再按照1.3.1节制备供试品溶液,得到3 组9 个样品溶液,从低质量浓度到高质量浓度分别进样2 次测定分析,计算平均回收率,见表3。平均加标回收率(n=3)为96.21%~110.39%(相对标准偏差不高于3.14%)。
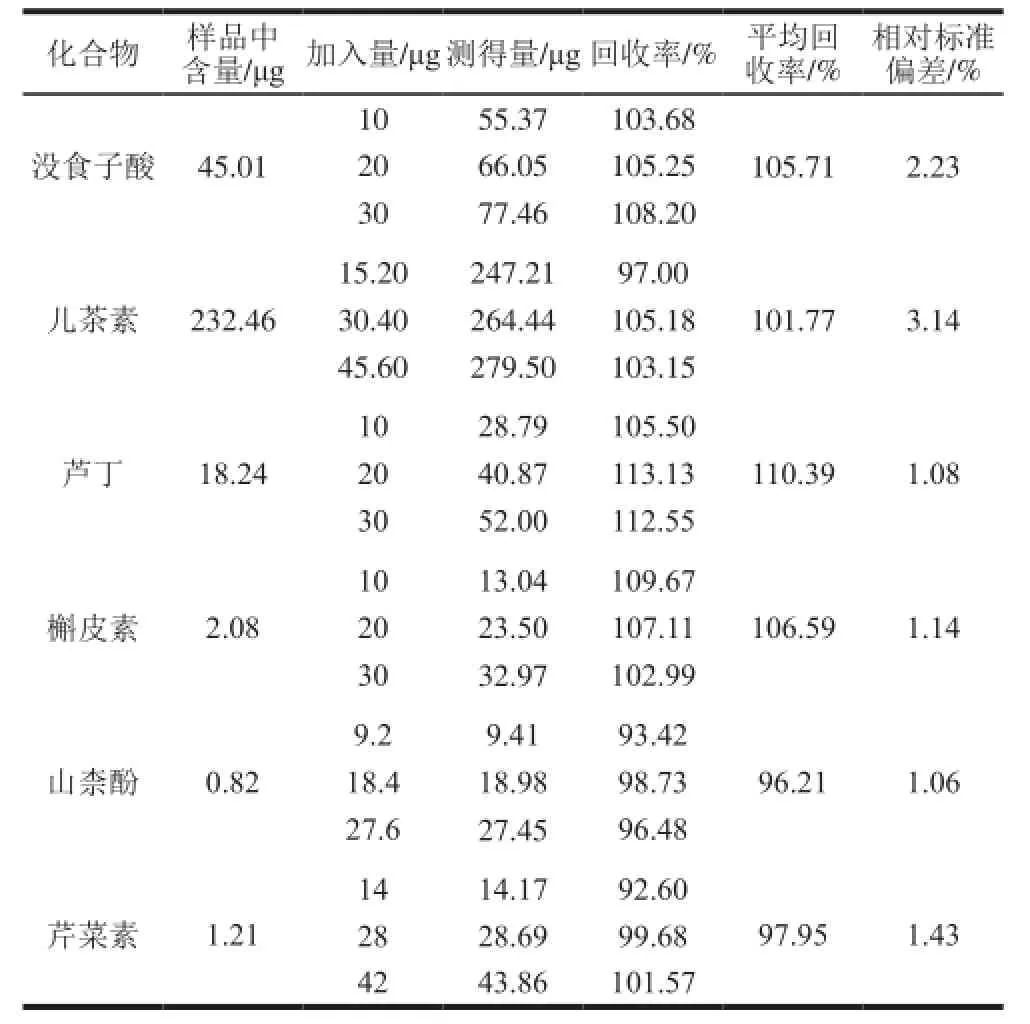
表3 样品含量测定及加标回收率实验(n=3)Table3 Contents and spiked recovery of the analytes in real samples (n= 3)
3 结 论
本实验采用超声辅助萃取的方法,通过单因素试验和正交试验优化了金樱子中没食子酸、儿茶素、芦丁、槲皮素、山柰酚和芹菜素的最佳提取条件,并采用梯度波长同时测定金樱子中的6 种有效成分,确立了最佳检测波长为280 nm(0~5 min)、350 nm(5~20 min),甲醇体积分数60%,固液比1∶60(g/mL),超声时间20 min,超声功率100%,其中对提取结果影响最大的是甲醇体积分数和超声功率;结果表明金樱子中含有没食子酸450.1 μg/g、儿茶素2 324.6 μg/g、芦丁182.4 μg/g、槲皮素20.8 μg/g、山柰酚8.2 μg/g、芹菜素12.1 μg/g;本实验通过高效液相色谱法实现了对金樱子中没食子酸、儿茶素、芦丁、槲皮素、山柰酚和芹菜素的同时分离和定量测定;具有方法稳定性强,检测限低等优点;这给中药金樱子中有效成分的研究提供了新的参考价值,也给测定金樱子中的其他有效成分提供了可行的实验参考条件。
[1] AZIMOVA S S, GLUSHENKOVA A I. Rosa laevigata Michx.[M]. London: Springer, 2012: 764-764.
[2] 国家药典编委会. 中国药典: 一部[M]. 2005年版. 北京: 化学工业出版社, 2005: 153.
[3] 赵德贵. 固精缩尿要药——金樱子[J]. 中国保健食品, 2014(6): 82-82.
[4] DONG D, QI Y, XU L, et al. Total saponins from Rosa laevigata Michx. fruit attenuates hepatic steatosis induced by high-fat diet in rats[J]. Food and Function, 2014, 5(12): 3065-3075. DOI:10.1039/ C4FO00491D.
[5] 周钰娟. 金樱子对实验性糖尿病肾病抗氧化和抗炎作用机制研究[D].长沙: 中南大学, 2012.
[6] 周俊, 何湘珍, 肖启国, 等. 金樱子对大鼠糖尿病性白内障细胞凋亡和氧化应激的影响[J]. 中南医学科学杂志, 2014(3): 241-245. DOI:10.15972/j.cnki.43-1509/r.2014.03.014.
[7] MENG J F, FANG Y L, GAO J S, et al. Phenolics composition and antioxidant activity of wine produced from Spine Grape (Vitis davidii, Foex) and Cherokee Rose (Rosa laevigata Michx.) fruits from South China[J]. Journal of Food Science, 2012, 71(1): C8-C14. DOI:10.1111/ j.1750-3841.2011.02499.
[8] 刘学贵, 李佳骆, 高品一, 等. 药食两用金樱子的研究进展[J]. 食品科学, 2013, 34(11): 392-398. DOI:10.7506/spkx1002-6630-201311081.
[9] GAO P Y, LI L Z, PENG Y, et al. Triterpenes from fruits of Rosa laevigata[J]. Biochemical Systematics and Ecology, 2010, 38(3): 457-459. DOI:10.1016/j.bse.2010.03.014.
[10] YUAN J Q, YANG X Z, MIAO J H, et al. New triterpene glucosides from the roots of Rosa laevigata Michx.[J]. Molecules, 2008, 13(9): 2229-2237. DOI:10.3390/molecules13092229.
[11] 王进义, 张国林, 程东亮, 等. 中药金樱子的化学成分[J].天然产物研究与开发, 2001, 13(1): 21-23. DOI:10.3969/ j.issn.1001-6880.2001.01.006.
[12] LIU Y T, LU B N, XU L N, et al. The antioxidant activity and hypolipidemic activity of the total flavonoids from the fruit of Rosa laevigata Michx.[J]. Natural Science, 2010, 2(3): 175-183. DOI:10.4236/ns.2010.23027.
[13] DIAZ P, SANG C J, LEE S, et al. Antioxidant and anti-inf l ammatory activities of selected medicinal plants and fungi containing phenolic and flavonoid compounds[J]. Chinese Medicine, 2012, 7(1): 1-9. DOI:10.1186/1749-8546-7-26.
[14] TAO X F, SUN X C, XU L N, et al. Total flavonoids from Rosa laevigata Michx. fruit ameliorates hepatic ischemia/reperfusion injury through inhibition of oxidative stress and inflammation in rats[J]. Nutrients, 2016, 8(7): 418-426. DOI:10.3390/nu8070418.
[15] XIAO K J, ZHANG L, LIU X H, et al. In vitro anti-tumor effects of chemically modified polysaccharides from Cherokee rose fruit[J]. International Journal of Food Engineering, 2014, 10(3): 473-479. DOI:10.1515/ijfe-2014-0065.
[16] SAKAGAMI H, SATOH K. Prooxidant action of two antioxidants: ascorbic acid and gallic acid[J]. Anticancer Research, 1997, 17(1A): 221-224.
[17] ZHANG S, QI Y, XU Y W, et al. Protective effect of fl avonoid-rich extract from Rosa laevigata Michx. on cerebral ischemia-reperfusion injury through suppression of apoptosis and inflammation[J]. Neurochemistry International, 2013, 63(5): 522-532. DOI:10.1016/ j.neuint.2013.08.008.
[18] LIU Y T, LU B N, PENG J Y. Hepatoprotective activity of the total flavonoids from Rosa laevigata, Michx. fruit in mice treated by paracetamol[J]. Food Chemistry, 2011, 125(2): 719-725. DOI:10.1016/ j.foodchem.2010.09.080.
[19] ZHANG S, ZHENG L L, DONG D S, et al. Effects of fl avonoids from Rosa laevigata Michx fruit against high-fat diet-induced non-alcoholic fatty liver disease in rats[J]. Food Chemistry, 2013, 141(3): 2108-2116. DOI:10.1016/j.foodchem.2010.09.080.
[20] HE R R, YAO X S, YAO N, et al. Protective effects of Radix Rosa laevigata against Propionibacterium acnes and lipopolysaccharideinduced liver injury[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(5): 1129-1136. DOI:10.1271/bbb.80897.
[21] SHUAI Z, LU B N, XU H, et al. Protection of the fl avonoid fraction from Rosa laevigata Michx. fruit against carbon tetrachloride-induced acute liver injury in mice[J]. Food and Chemical Toxicology, 2013, 55(3): 60-69. DOI:10.1016/j.fct.2012.12.041.
[22] 刘焱, 张延鲁, 覃克凤. 金樱子中总黄酮的超声提取及抗氧化活性分析[J]. 湖北农业科学, 2016(5): 1256-1258. DOI:10.14088/j.cnki. issn0439-8114.2016.05.042.
[23] 林宣贤. 酶法提取金樱子总黄酮的研究[J]. 中国食品添加剂, 2009(4): 117-121.
[24] 王慧竹, 陈帅, 朱岩, 等. 纤维素酶-微波辅助法提取金樱子总皂苷的工艺研究[J]. 中国酿造, 2016, 35(3): 84-88. DOI:10.11882/ j.issn.0254-5071.2016.03.019.
[25] 安冬琴, 晏建新, 王晓丽. 紫外测定不同产地不同采收期金樱子中总黄酮的含量[J]. 安徽农业科学, 2015(14): 79-80. DOI:10.13989/ j.cnki.0517-6611.
[26] 卢静华, 于玲. 双波长薄层扫描法测定金樱子中总黄酮的含量[J].中国药房, 2008, 19(21): 1636-1637.
[27] 陈乃富, 陈科, 张莉, 等. 大孔树脂柱层析法纯化金樱子总黄酮的初步研究[J]. 中药材, 2007, 30(8): 1013-1016. DOI:10.13863/ j.issn1001-4454.
[28] 薛梅, 王鲁石, 杜华, 等. 金樱子中总黄酮的提取及含量测定[J].现代中药研究与实践, 2003, 17(5): 16-17. DOI:10.13386/ j.issn1002-0306.2005.10.036.
[29] 陈乃富, 韩邦兴, 张莉, 等. 金樱子总黄酮的HPLC指纹图谱的初步研究[J]. 安徽农学通报, 2007, 13(3): 34-35. DOI:10.16377/j.cnki. issn1007-7731.2007.03.016.
[30] 黄云祥, 王锦军, 张秀梅. 高效液相色谱法同时测定金樱子中槲皮素、山萘酚、芹菜素的含量[J]. 现代中药研究与实践, 2009(1): 33-36. DOI:10.13728/j.1673-6427.2009.01.020.
Simultaneous Determination of Six Active Compounds in Rosae Laevigatae Fructus by Ultrasonic-Assisted Extraction and HPLC with Gradient Wavelength Detection
LIAO Anhui, ZHOU Guangming*, CHEN Junhua, GAO Yi, YU Lu, ZHANG Caihong
(Key Laboratory on Luminescence and Real-Time Analysis, Ministry of Education, School of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China)
Objective: To establish a method for and the simultaneous determination of gallic acid, catechin, rutin, quercetin, kaempferol and apigenin in Rosae Laevigatae Fructus by ultrasonic-assisted extraction combined with high performance liquid chromatography (HPLC). Methods: The analytes in Rosae Laevigatae Fructus were separated on an InertSustain C18column (150 mm × 4.6 mm, 5 μm). The mobile phase consisted of methanol and 0.1% acetic acid (pH 3.0) for gradient elution at a fl ow rate of 1.0 mL/min. The UV gradient wavelength for detection was set at 280 nm (0–5.00 min) and 350 nm (5.00–20.00 min). The column temperature was kept at 35 ℃. Results: The complete separation of 6 active ingredients was achieved under the above conditions. The calibration curves of the analytes showed a good linear relationship (r ≥ 0.999 1, n = 6). The average recoveries were in the range of 96.21%–110.39% with relative standard deviation (RSD) ≤ 3.14%. Conclusion: The method is simple, rapid and accurate and can provide a basis for the quantitative detection and quality control of Rosae Laevigatae Fructus.
ultrasonic-assisted extraction; HPLC; Rosae Laevigatae Fructus; gradient wavelength; fl avonoid compounds
10.7506/spkx1002-6630-201704023
O657.72
A
1002-6630(2017)04-0141-05
廖安辉, 周光明, 陈军华, 等. 超声辅助萃取-梯度波长高效液相色谱法同时测定金樱子中6 种活性成分[J]. 食品科学, 2017, 38(4): 141-145. DOI:10.7506/spkx1002-6630-201704023. http://www.spkx.net.cn
LIAO Anhui, ZHOU Guangming, CHEN Junhua, et al. Simultaneous determination of six active compounds in Rosae Laevigatae Fructus by ultrasonic-assisted extraction and HPLC with gradient wavelength detection[J]. Food Science, 2017, 38(4): 141-145. (in Chinese with English abstract)
10.7506/spkx1002-6630-201704023. http://www.spkx.net.cn
2016-05-26
国家自然科学基金面上项目(21277110);中央高校基本科研业务费专项(100030-2120130993)
廖安辉(1992—),女,硕士研究生,研究方向为离子色谱。E-mail:lah166@email.swu.edu.cn
*通信作者:周光明(1964—),男,教授,博士,研究方向为色谱及其联用技术。E-mail:gmzhou@swu.edu.cn
