人参果自然发酵醪中酵母菌种筛选及其发酵性能
2017-03-27苏凤贤郑晓杰
苏凤贤,张 井,郑晓杰
(温州科技职业学院农业与生物技术学院,浙江 温州 325006)
人参果自然发酵醪中酵母菌种筛选及其发酵性能
苏凤贤,张 井,郑晓杰*
(温州科技职业学院农业与生物技术学院,浙江 温州 325006)
为筛选适合甘肃河西走廊特产人参果酒精发酵的优良酵母菌株,以人参果自然发酵醪为原料,通过镜检等方法从分离纯化的20 株酵母菌中进一步筛选得到11 株发酵性能良好的酵母菌,分别命名为TY8、TY5、TY6、Y3、Y4、Y5、LY3、LY1、Y1、Y2、TY2。以葡萄酒活性干酵母作为对照菌株,通过酵母发酵力比较、耐乙醇能力、耐SO2能力、理化指标分析及感官评价,筛选出1 株适于人参果果酒发酵的酿酒酵母TY8。以此菌株发酵生产的人参果果酒香气特征明显,酒体澄清透明,具有人参果果酒典型风味。
酿酒酵母;筛选;发酵性能;耐SO2;耐乙醇
人参果(Solanum muricatum Ait.)又名香瓜茄、艳果,原产于南美洲安第斯山脉北麓[1]。人参果果实有淡雅的清香,果肉清爽多汁,风味独特[2],具有高蛋白、低糖、低脂,富含多种人体必需的微量元素,尤其是硒、钙含量大大高于其他园艺产品等特点[3-4],有抗癌、抗衰老、降血压、降血糖、美容等功效。因此,人参果常用来加工成各种产品,具有很大的市场开发价值[5]。
近年来,酿酒酵母作为生产乙醇和高级醇的常用菌种备受瞩目,微生物发酵为可持续的生物燃料生产提供了前途无量的替代物[6-7]。Nieuwoudt等[8]采用主成分分析和傅里叶变换红外光谱仪法创造了一种在酿酒酵母主要发酵产品中进行快速筛选和评价酵母菌的方法。据报道,在影响葡萄酒品质的诸多因素中,酿酒微生物是其质量和感官风格的决定性因素,尤其是葡萄酒微生物(酵母菌和乳酸菌)的酿酒适应性和酿造学特性在生产中的作用十分突出[9]。而目前食品发酵工业最重要的菌群,除酿酒酵母属酵母以外,对传统食品发酵工业增香方面有良好应用前景的其他酵母菌种研究甚少,尤其是多种野生菌在葡萄酒和啤酒发酵工业上对芳香物质的生成具有重要的作用。某些非酿酒酵母属酵母比众所周知的酿酒酵母更容易产生一些重要的芳香族化合物,诸如品质更佳的乙酸乙酯和乙醇乙酯等[10]。资料表明,在酱油发酵过程中,主要应用于酱油生产的耐盐生香酵母,由于能够生产酯类、醇类等风味物质,对酱油的品质有很大影响[11]。果酒发酵过程中,不同酵母菌株的起酵、产酒、产香、耐性等特性不同,在发酵过程中发挥的作用也相差较大,且不同原料本身成分差距较大,选育发酵性能优良、适合特定原料发酵的专用酵母已成为目前果酒酿造的研究热点[12-13]。Ocón等[14]在葡萄酒厂空气样品和被污染葡萄酒样品中进行酵母筛选,得到了367 株菌株,经鉴定,基本是酒香酵母和德克氏酵母等非酵母属酵母。目前,分离筛选得到的发酵酵母主要应用于白酒、葡萄酒、果酒等酒类产品的发酵过程,从而改善产品的风味、增加其营养[15]。
甘肃河西走廊地区是人参果的适栽区,人参果栽培面积较大,然而目前相关加工技术相对落后,课题组在甘肃河西地区工作期间曾长期进行人参果相关加工研究,制得了一种色泽金黄、口感清爽、果香浓郁、酒体醇厚的酒精保健饮品[16-19],但是缺少人参果发酵相关的专用酿酒酵母,而使用葡萄酒酿酒酵母,不仅专一性不强,且无法适应人参果酒的产业化推广。鉴于微生物对底物利用具有选择性[20],本研究从河西走廊具有优势资源的人参果自然发酵酒的不同发酵阶段,分离筛选适宜人参果发酵的优良酵母菌株,从中分离筛选具有专一性强、起酵速率快、发酵活力强、酒精耐受力高、抗SO2能力强、不产生异味物质、絮凝性好、酒精转化率高和风味独特的优良酿酒酵母作为专用的人参果果酒酵母,以期为实现人参果果酒产业化提供高效优质的酿酒酵母品种。
1 材料与方法
1.1 材料与试剂
葡萄酒高活性酿酒干酵母(对照菌株CK)购自安琪酵母股份有限公司。人参果产自甘肃武威张义镇,成熟,无腐烂变质,可溶性固形物含量(soluble solids content,SSC)6.8%。豆芽汁培养基参考文献[21]配制。
NaOH、HCl、无水乙醇、冰乙酸 南京化学试剂股份有限公司;琼脂 常州通诚化工有限公司;CuSO4•5H2O 苏州亚太化工玻璃仪器有限公司;亚甲蓝大田县灿成化玻仪器有限公司;酒石酸钾钠、乳糖 常州海拓实验仪器有限公司;乙酸锌、亚铁氰化钾 天津致远化学试剂有限公司;葡萄糖 济宁宏明化学试剂有限公司;果糖 无锡亚泰联合化工有限公司;蔗糖 天津科密欧化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
JB-HS-1300/1300U型无菌工作台 苏州佳宝净化工程设备有限公司;DHP-9272型电热恒温培养箱 上海柏欣仪器设备厂;YXQ-LS-100G型高压灭菌锅 上海道基科学仪器有限公司;722型分光光度计 上海凤凰光学科仪有限公司;HHW-420.600型三用恒温水浴箱 江苏金坛市国瑞实验仪器厂;PHS-3C型酸度计 常州金坛市精达仪器制造厂;FA2004型电子天平 上海方瑞仪器有限公司;WYT-Ⅱ型手持糖量计 上海华光仪器仪表厂;JYZ-B550型榨汁机 九阳股份有限公司;酒精计石家庄百亨通用仪器仪表制造有限公司。
1.3 方法
1.3.1 人参果酿酒酵母的筛选流程
新鲜成熟的人参果→分选→打浆→过滤→发酵→初筛→分离→纯化→杜氏管复筛→发酵性能测试→优良人参果果酒酿酒酵母。
1.3.1.1 人参果酿酒酵母的初筛
挑选新鲜人参果,不清洗,直接打浆,装入已灭菌的250 mL锥形瓶中,装液量60 mL,塞好棉塞于25 ℃恒温培养箱中培养7~10 d,分别在发酵前、中、后期(分别为第2、4、7天)取发酵液进行梯度稀释平板涂布[22],每一梯度做3 个平行。按姜加良[15]的方法筛选红色菌落作为入选菌,根据菌落的颜色判定酵母产酒精能力。将筛选得到的菌株反复纯化3~4 次,斜面试管保藏备用。
1.3.1.2 杜氏管发酵复筛
采用杜氏管发酵法[23-24],将1.3.1节活化的酵母菌接入内置杜氏小管的豆芽汁液体培养基试管中,根据酵母菌株产气泡的速率及在规定时间内产气泡量,比较各株酵母菌的起酵能力和发酵能力,实验平行重复3 次。综合评价各株酵母的起酵能力和发酵能力。
1.3.2 发酵性能测定
1.3.2.1 酵母菌发酵力测定
采用CO2失重法[25]。
1.3.2.2 酵母菌的耐乙醇、耐SO2实验
采用杜氏管发酵法[26],将初筛得到的酵母菌株分别接入含不同体积分数乙醇(8%、9.5%、11%、12.5%和14%)和不同质量浓度SO2(50、100、150、200 mg/L和250 mg/L)的人参果果汁中,于25 ℃恒温培养箱培养,观察杜氏管产气泡情况,比较各菌株对乙醇和SO2的耐受程度,进一步确定适合人参果果酒酿造的优良菌株。实验平行重复3 次。综合评价各酵母菌株的乙醇耐受能力和耐SO2能力。
1.3.2.3 酒精发酵实验
调整人参果原汁含糖量,使其达到20%,pH 4.0,SO2质量浓度80 mg/L,将入选菌接入容量为250 mL的三角瓶(装液量为150 mL)中,对照菌置于25 ℃恒温培养箱发酵7 d,期间每天定时测定发酵液的SSC、A600nm、还原糖和总酸含量,发酵结束后测定酒精度(乙醇体积分数)。
1.3.3 指标测定
SSC测定采用手持折光仪法[27];参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》[28],总酸(以酒石酸计)测定采用酸碱滴定法,还原糖测定采用斐林法,酒精度测定采用酒精计法;酵母生长曲线采用分光光度法[29]。
2 结果与分析
2.1 初筛酵母菌的特征
酒精发酵的主要产物是乙醇,在2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)实验中,通过TTC显色剂可以对酵母产物进行显色处理,TTC显色剂遇乙醇会显红色,酒精含量高的培养基会显深红色,酒精含量低的培养基显浅红色。据此,可以选择红色较深的酵母菌落进行纯化。通过TTC培养基实验筛选得到的酵母菌生长旺盛、发酵力强、有较好的同步性,接种后迅速进入主发酵期,有利于发酵作用,有利于提高产品的产量和口感[15]。

图1 TTC平板显色筛选Fig.1 Primary screening of yeasts by TTC color development
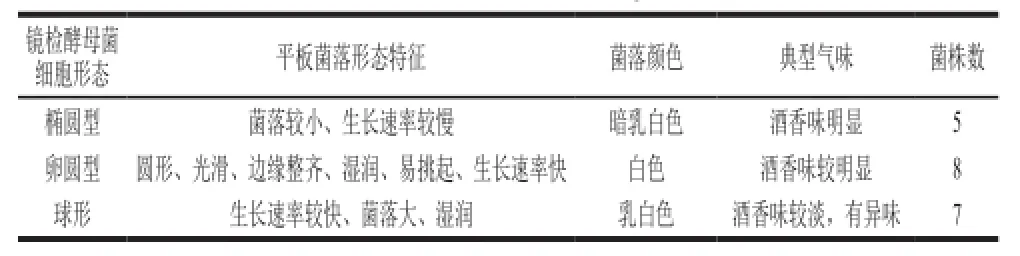
表1 酵母菌种的分离结果Table1 Characterization of yeast strains
如图1所示,纯化得到的20 株酵母菌具有酵母菌典型的菌落特征,将其划线接种于豆芽汁琼脂斜面培养基上。根据不同酵母菌的菌落形态特征、菌落颜色、镜检形态以及典型气味可分为3 大类(表1)。
2.2 酵母菌复筛实验结果
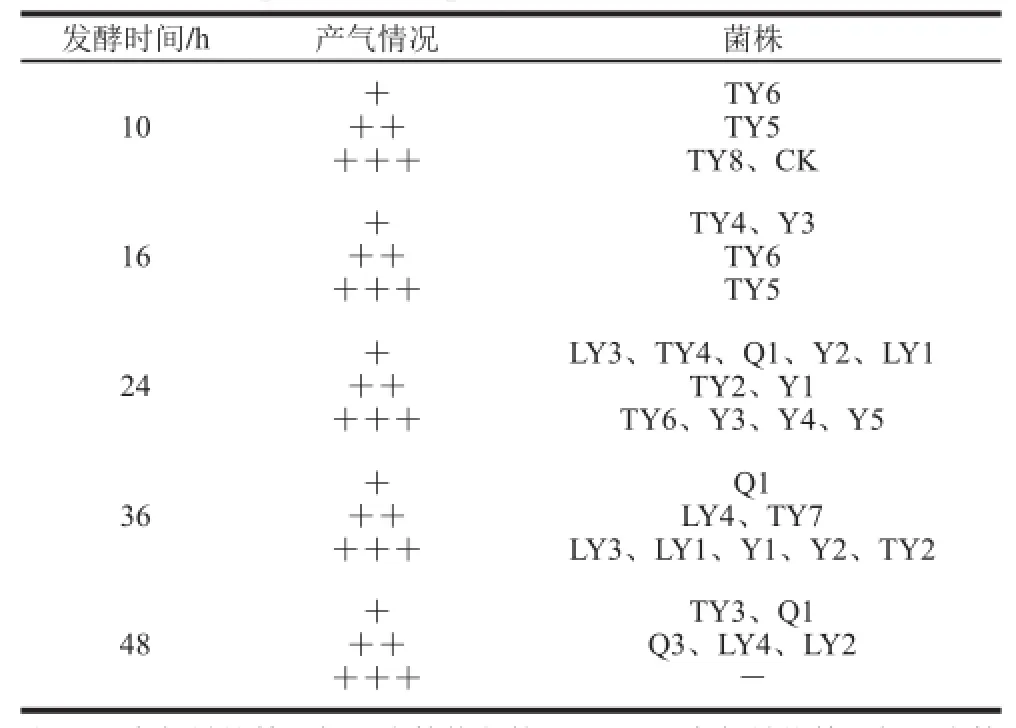
表2 酵母菌复筛实验杜氏小管产气情况Table2 Gas production capacity of yeast strains in Durham tubes
发酵的产物之一是CO2,所以杜氏试管实验中产生的气泡数量越多,气泡体积越大,酵母的发酵能力越强,酵母的发酵速率越快,酵母的发酵程度越高[15]。将初次分离得到的20 株酵母菌作为出发菌株进行杜氏管发酵复筛实验,实验结果见表2,酵母菌于25 ℃条件下发酵48 h,产气量约等于杜氏小管体积的酵母菌有11 株(不包括CK),这说明其起酵能力较强,可能有较高的发酵度和发酵效率。其中TY8和CK起酵速率最快,10 h产气量即达到杜氏小管满体积;TY5起酵速度较快,16 h产气量达到杜氏小管满体积;TY6、Y3、Y4和Y5起酵速度稍慢于对照CK,24 h产气量可达到杜氏小管满体积;LY3、LY1、Y1、Y2和TY2起酵速度最慢,36 h产气量才达到杜氏小管满体积。资料表明,2 d内产气量未达到杜氏管满体积的酵母菌的发酵度一般不能满足果酒的酿造要求,筛选过程中应将其舍弃[25]。将这11 株酵母菌作为出发菌株进行下一级筛选。
2.3 酵母菌株发酵力测定结果
发酵力是衡量酵母菌株质量最重要的一个指标[30]。酵母发酵产生乙醇的同时还伴有CO2的生成,这部分CO2从发酵液中逸出,使整个发酵体系质量减轻,据此可测定酵母菌株发酵力的强弱[31]。采用CO2失重法,以CO2损失质量为纵坐标,发酵时间为横坐标,绘制发酵力曲线[32],以此得到待选菌株对原料果汁的适应性、发酵峰值周期、发酵强度和发酵过程的动态变化[31]。
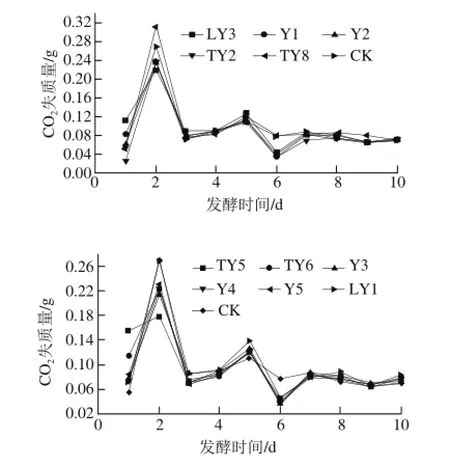
图2 不同酵母菌发酵速率曲线图Fig.2 Time courses of CO2loss during the fermentation of yeast strains
由图2可知,TY8的发酵力最强,明显高于CK,发酵过程相对平稳,发酵峰值高;LY1的发酵力与CK相当,发酵峰高于CK;但是在4 d后出现了波动,发酵过程不平稳,稳定性较弱;TY2、Y1、Y2、LY3、TY5、TY6、Y3、Y4和Y5菌株发酵峰值低于CK,相继在4 d后出现了波动,发酵过程不平稳,稳定性明显弱于TY8和CK,说明它们的发酵能力弱于TY8和对照菌株;TY5的发酵峰值明显低于其他菌株,且发酵稳定性最弱。实验筛选得到的11 株人参果果酒酵母发酵速率有一个共同趋势:即前2 d发酵速度呈线性增长,待稍平稳后再缓慢下降,7 d后发酵速度降至最低,之后下降幅度变化不大。
2.4 酵母菌耐SO2、耐乙醇实验结果
SO2是果酒酿造过程中一种必需的食品添加剂[33],果酒中添加适量的SO2不仅具有抑菌、抗氧化和增酸作用,还可明显改善果酒的风味[34];乙醇是果酒质量的重要组成成分,一般果酒的酒精度在8%~14%之间,因此一株优良酿酒酵母必须兼具一定的耐SO2和耐乙醇能力。
由表3可知,实验菌株TY8、Y1、Y5和CK对SO2有很好的耐受性,即使在SO2质量浓度达到250 mg/L时,起酵时间和产气速率也并未受到明显的影响,10 h内产气量便可达到杜氏小管满体积;TY6耐SO2能力最差,在SO2质量浓度为100 mg/L时已经被完全抑制,在2 d之内没有产气现象;而SO2质量浓度为50 mg/L时也是48 h产气量才达到杜氏管满体积;菌株TY5、Y3、Y4、LY3、LY1、Y2和TY2的耐SO2性能介于以上两类菌株之间,且TY6、TY5和LY1在发酵结束后有令人不愉快的气味产生,因此不作为发酵菌考虑。基于国标中对果酒酿造要求的SO2添加量一般为50~250 mg/L的规定,同时考虑菌株对SO2的耐受性,TY8、Y1、Y5和CK都符合酿造要求。

表3 酵母菌的SO2耐性实验结果Table3 SO2tolerance of yeast strains

表4 酵母菌的乙醇耐性实验结果Table4 Ethanol tolerance of yeast strains
由表4可知,TY8和CK对乙醇有很好的耐受力,在不高于12.5%酒精度的人参果发酵液中1 d内产气量便可达到杜氏小管满体积;14%酒精度条件下3 d之内也可以使产气达到杜氏小管满体积。Y2、TY2和LY3对乙醇有较好的耐性,在低于酒精度11%的人参果发酵液中达到杜氏小管满体积需要3 d,而酒精度12.5%时产气达到杜氏小管满体积则需要4 d;Y2和TY2在14%酒精度条件下5 d产气才达到杜氏小管满体积。Y1和Y5在较低酒精度(不高于9.5%)的人参果发酵液中2 d内产气量可达到杜氏小管满体积;但Y1和Y5不耐高酒精度,其中Y5在酒精度11%的人参果发酵液中即已被抑制,而Y1在酒精度12.5%的人参果发酵液中也被抑制。由于工业化生产一般是浓醪发酵,而在浓醪发酵时高浓度底物相应也会生成较高浓度的酒精,过高的酒精度对酵母有毒性,甚至可能是致死性的,会抑制细胞的生长及发酵活性。所以酵母的发酵能力在很大程度上取决于它们自身酒精耐受力的大小[35]。据此原理,TY8菌株和Y2、TY2以及LY3菌株可能有较高的发酵度。另外,由表4可知,随着酒精度的增加,产气酵母逐渐减少,在14%酒精度的人参果发酵液中TY8和CK菌株到第3天产气量才达到杜氏小管满体积,可能是由于较高的酒精度对细胞膜的通透性产生了致死性的损伤,因此,随着酒精度增加,产气酵母逐渐减少,这也验证了前人的结论[31]。根据国际葡萄酒协会规定葡萄酒的酒精度一般在8.5%之上,所以从耐酒精性能上讲,菌株TY8基本满足人参果果酒的酿造要求。
综上测试结果,选定TY8、Y1、Y5和对照CK 4 株菌进行进一步酒精发酵实验。
2.5 酒精发酵实验结果
2.5.1 不同菌种在人参果果酒发酵过程中酵母生长曲线的变化

图3 不同菌种在人参果果酒发酵过程中酵母生长曲线Fig.3 Growth curve of selected yeast strains during the fermentation of pepino fruit wine
如图3所示,随着人参果果酒发酵的进行,酵母菌开始增殖。其中TY8和CK在第1天即进入生长对数期,菌体量达到最大,在供试的4 株菌种中,TY8在整个发酵过程中生长量最大,且高于对照组CK;之后酵母菌的生长速度下降,酒液开始变得澄清、透明、稳定;而Y1和Y5酵母发酵前期生长缓慢,Y5菌和Y1菌分别于发酵的第3、4天达到最大生长量,之后随着发酵的进行生长速度放慢。在刚开始的24 h内TY8生长速度最快,其次是CK,再次是Y1和Y5。在第1天以后Y1和Y5开始呈现旺盛生长态势,Y1缓慢上升;Y5迅速上升到最高点。而此时TY8和CK生长则出现下降趋势,二者开始进入衰亡期,并于第4天后进入稳定期;Y1和Y5在第6天进入稳定期。这4株菌在主发酵后期存在不同程度的下降趋势,这可能是由于随着主酵的进行,人参果果酒醪液中乙醇含量逐渐增加,达到一定程度后,对4 种酵母菌株产生抑制作用的缘故。由图4可以进一步看出,供试的4 株菌株,TY8和CK菌起酵速度较快,发酵1 d即达到最大生长量;而Y1和Y5起酵速度较慢,分别在发酵第3、4天才达到较大生长量;但纵观4 株菌株在发酵后期的表现,TY8和CK菌达到最大生长量后即迅速下降,不能在整个发酵周期维持相对较快的生长态势;而Y5和Y1菌虽起酵较慢,最大生长量不如TY8和CK菌,但发酵后期能始终维持相对较快的生长态势,说明此二株菌对乙醇的耐受力应强于TY8和CK。
2.5.2 不同酵母发酵过程中SSC的变化
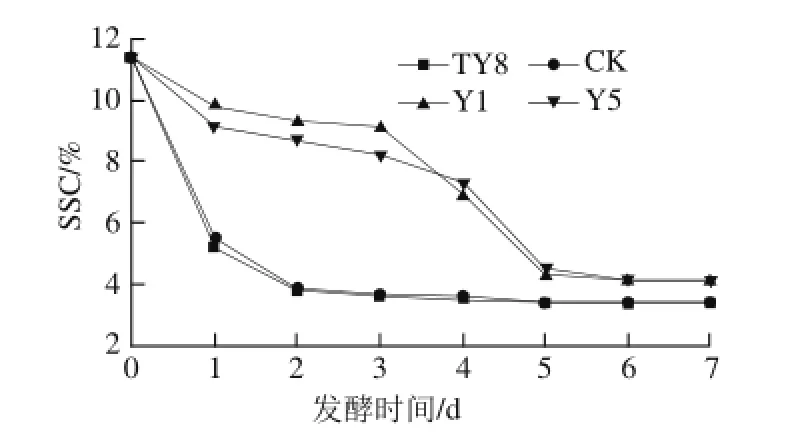
图4 不同酵母发酵过程中SSC的变化Fig.4 Changes in SSC during the fermentation of selected yeast strains
如图4所示,人参果酒发酵前期,TY8和CK发酵的人参果发酵液的SSC下降迅速,2 d后即渐趋稳定;而Y1菌和Y5菌3 d内下降趋势较缓慢。由发酵结束时人参果果酒酒精度测试结果可知:Y1菌和Y5菌发酵结束后酒精度小于10%,因此,两株酵母在整个发酵期间需耐酒精度较低从而能保持较高的生长量;而TY8和CK菌发酵的人参果果酒酒精度较高(高于10%),所以高体积分数乙醇对酵母抑制率较强,因而TY8和CK菌在达到最大生长量后迅速下降,很快进入了衰亡期。
SSC变化验证了生长曲线结论,TY8和CK菌在发酵1 d达到最大生长量,此时菌体生长繁殖依靠人参果果汁中可溶性糖类作为碳源进行自身生长,SSC下降速度极快;之后SSC下降趋势趋于稳定;而Y1和Y5菌分别于发酵的第3、4天生长量达到最大,在此期间,利用糖类作为碳源进行自身生长繁殖和乙醇转化力较强;之后两株酵母进入衰亡期,利用碳源进行自身生长和乙醇转化力大大降低;发酵后期,Y1和Y5菌维持一个短暂的稳定期,在此期间,人参果发酵液中Y1和Y5菌菌体浓度达到最大,需要更多的糖源供给和用于乙醇转化,所以SSC下降趋势加快;之后Y1和Y5菌的发酵液乙醇体积分数上升,酵母开始衰亡,菌株利用糖源和乙醇转化力有限。故发酵液中SSC趋于稳定。
2.5.3 不同酵母发酵过程中还原糖质量浓度的变化
在发酵过程中,每天测定不同酵母发酵人参果酒的还原糖,绘制发酵过程变化曲线。人参果果汁中的还原糖有两部分,一部分是人参果果汁中原有的还原糖,另一部分来源于人参果营养成分氧化分解和外加糖源而来。随着主发酵的进行,人参果汁中的非还原糖分解成还原糖,同时酵母利用人参果中的还原糖,把还原糖转化为酒精。
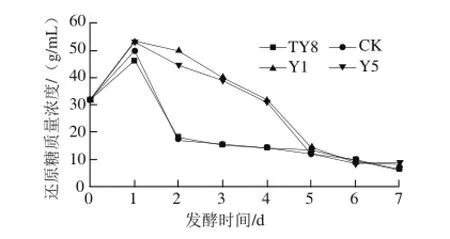
图5 不同酵母发酵过程中还原糖质量浓度的变化Fig.5 Changes in reducing sugar during the fermentation of selected yeast strains
如图5所示,随着主发酵的进行,4 组处理均于发酵第1天还原糖质量浓度出现大幅度增加现象,此时人参果发酵液中的淀粉等多糖降解为单糖和寡糖,还原糖质量浓度增加,所以测定的人参果发酵液中还原糖质量浓度高于初始还原糖质量浓度;之后,大量增殖的酵母菌开始利用还原糖转化为酒精,还原糖质量浓度又大幅度下降,直至趋于稳定。其中TY8和CK组第2天还原糖开始迅速下降,发酵2 d后趋于稳定;而Y1和Y5则较比下降缓慢,到发酵第5天时才趋于稳定。这是因为发酵伊始,人参果发酵液中多糖等物质水解,而酵母此时虽利用发酵液中糖源进行自身生长,但菌数尚未达到最大值,故发酵液中还原糖质量浓度出现不降反增的现象;随后,发酵液中菌数达到最大并进入稳定期和衰亡期,此时,4 种酵母菌开始利用发酵液中的糖源进行乙醇转化,且发酵液中日益增高的酒精度又抑制了酵母菌的生长繁殖和乙醇的转化力,故还原糖质量浓度在大量下降后又趋于稳定。
2.5.4 不同酵母发酵过程中总酸含量的变化
果酒中的可滴定酸对酒的酿造与感官质量有重要意义,它直接影响发酵液的pH值,继而影响到酵母的繁殖能力、细胞活性、营养物质的吸收以及产物的代谢与分泌[36]。在酿造过程中,许多生化反应也与可滴定酸有关。Na2S2O3·5H2O本身显弱酸性,加入果汁中能增加其酸度,同时,酒精发酵过程中会伴随一些细菌参与的苹果酸-乳酸发酵,使果汁中酸味明显,发酵后转化成口感柔和的乳酸,果酒口味柔和、细腻、圆润[37]。

图6 不同酵母发酵过程中总酸含量的变化Fig.6 Changes in total acid during the fermentation of selected yeast strains
如图6所示,随着主发酵的进行,由Y1和Y5菌接种的人参果发酵液总酸含量迅速上升,发酵4~5 d后达到最大值,之后趋于稳定。由TY8和CK接种的人参果发酵液总酸含量在整个发酵期间变化幅度不大,两者最高达到3.188 g/L;而Y1和Y5发酵液中总酸含量的变化远高于TY8和CK,在前2 d 4 株菌接种的发酵液总酸含量变化趋于一致,2 d以后Y1和Y5菌总酸含量开始迅速上升,原因可能是Y1和Y5本身能够产酸且产酸能力大于TY8和CK。结合图3可知,前2 d Y1和Y5生长缓慢产酸相应的比较少,2 d后Y1和Y5菌快速生长,产酸量也随之迅速上升;而随着酒精度和总酸的升高,酵母菌活力开始被抑制,产酸量也开始趋于稳定。
2.5.5 不同酵母发酵产人参果果酒的酒精度
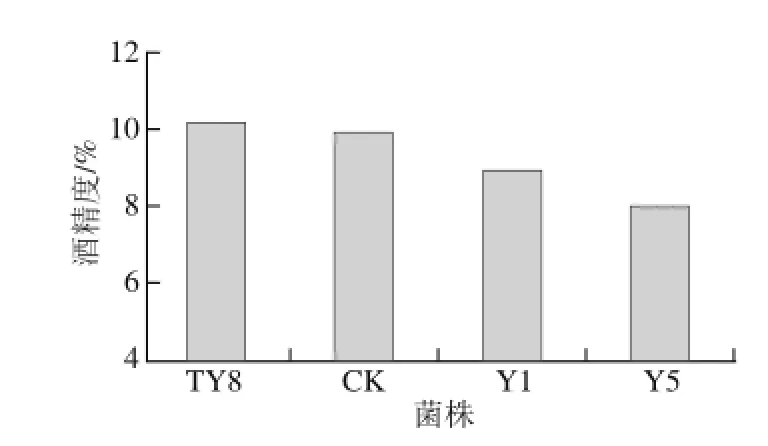
图7 不同酵母发酵产人参果果酒的酒精度Fig.7 Alcohol contents produced by selected yeast strains
如图7所示,4 株菌中,以TY8和CK接种发酵的人参果果酒酒精度最高,可以达到10.2%和9.9%。其次是Y1,酒精度为8.9%,酒精度最低的是Y5,酒精度为8%。符合GB/T 15038—2006对果酒酒精度的规定。
2.5.6 感官评价

表5 不同酵母菌酿制人参果果酒的感官评价Table5 Sensory evaluation of pepino fruit wine produced by different yeast strains
由表5可知,由酵母TY8发酵的人参果果酒色泽金黄,酒体丰满,富有酒香的典型性和人参果固有的果香,酒体醇厚、透明,可以与对照酵母CK发酵的人参果果酒相媲美。而其他2 株实验酵母Y1和Y5发酵的原酒残糖量高,口感风味弱于对照组CK,且酒体组织略显浑浊。且因Y1发酵的人参果果酒有异味物质生成,故不能满足成品人参果果酒的要求;而Y5菌虽发酵后酒精度不足,略有涩味,但总体基本满足人参果果酒酵母筛选要求;兼顾其发酵后期对乙醇耐受力较强,可长期在发酵液中保持旺盛生长,故可考虑与TY8和CK菌混合发酵,从而丰富人参果果酒口感。
3 结 论
以安琪牌葡萄酒活性干酵母CK作为对照菌株,通过对11 株自筛酵母菌发酵力比较、耐SO2、耐乙醇能力筛选,初步筛选出3 株发酵性能好的菌株。通过综合比较、理化指标分析及感官评价,结果表明:酵母TY8是一株酿造人参果果酒的良好菌株,具有较高的发酵力,且起酵时间只有10 h,可以耐受12.5%乙醇和250 mg/L SO2,用其发酵的人参果果酒酒精度高达10.2%,酒体澄清透明,具有人参果果酒的典型风味。而Y5菌虽发酵后酒精度较低,酒香不足,略有涩味,但考虑其在人参果果酒发酵中能始终维持较高的生长量,对乙醇耐受力较高,故可考虑用它与CK菌、TY8菌进行混菌发酵以丰富人参果果酒口感。本研究筛选得到的菌株未进行分类鉴定和毒理学实验,有待后续实验验证完善。
[1] 范甲朋. 人参果简介[J]. 生物学通报, 2006, 41(7): 23.
[2] 苏凤贤, 曹旭峰, 汪峰, 等. 人参果酒酿造中酿酒酵母的选择[J].食品与发酵工业, 2010, 36(4): 130-135.
[3] 任雪峰, 巩维忠, 吴冬青, 等. 火焰原子吸收光谱法测定不同产地人参果中11 种微量元素含量[J]. 兰州大学学报(自然科学版), 2009, 45(3): 73-76. DOI:10.3321/j.issn:0455-2059.2009.03.014.
[4] 徐敏, 占扎君, 章小永. 人参果的化学成分研究[J]. 中草药, 2007, 38(5): 667-669. DOI:10.3321/j.issn:0253-2670.2007.05.009.
[5] 铁桂春, 刘红献. 人参果的特性及应用价值[J]. 现代农业科技, 2007(10): 43-45. DOI:10.3969/j.issn.1007-5739.2007.10.029.
[6] BUIJS N A, SIEWERS V, NIELSEN J. Advanced biofuel production by the yeast Saccharomyces cerevisiae[J]. Current Opinion in Chemical Biology, 2013, 17(3): 480-488. DOI:10.1016/j.cbpa.2013.03.036.
[7] DUBEY R, JAKEER S, GAUR N A. Screening of natural yeast isolates under the effects of stresses associated with second-generation biofuel production[J]. Journal of Bioscience and Bioengineering, 2016, 121(5): 509-516. DOI:10.1016/j.jbiosc.2015.09.006.
[8] NIEUWOUDT H H, PRETORIUS I S, BAUER F F, et al. Rapid screening of the fermentation profiles of wine yeasts by Fourier transform infrared spectroscopy[J]. Journal of Microbiological Methods, 2006, 67: 248-256. DOI:10.1016/ j.mimet.2006.03.019.
[9] 张春晖, 李华. 葡萄酒微生物学[M]. 西安: 陕西人民出版社, 2003: 9.
[10] GAMERO A, QUINTILLA R, GROENEWALD M, et al. Highthroughput screening of a large collection of non-conventional yeasts reveals their potential for aroma formation in food fermentation[J]. Food Microbiology, 2016, 60: 147-159. DOI:10.1016/ j.fm.2016.07.006.
[11] 谭才邓, 王文文, 朱美娟, 等. 1 株耐高温高盐生香酵母的选育及特性分析[J]. 食品与发酵工业, 2016, 42(3): 92-96.
[12] 罗佳丽, 王雪莹, 王孝荣, 等. 甜橙果酒酵母筛选及发酵性能[J].食品科学, 2013, 34(11): 222-227. DOI:10.7506/spkx1002-6630-201311048.
[13] 李丹, 严红光, 袁亮. 蓝莓果酒专用酵母的筛选、鉴定与性能研究[J].食品与发酵科技, 2015, 51(5): 75-79. DOI:10.3969/j.issn.1674-506X.2015.05-018.
[14] OCÓN E, GARIJO P, SANZ S, et al. Screening of yeast mycoflora in winery air samples and their risk of wine contamination[J]. Food Control, 2013, 34: 261-267. DOI:10.1016/j.foodcont.2013.04.044.
[15] 姜加良. 传统酿造糯米酒中酵母菌的筛选及发酵特性研究[J]. 黑龙江科学, 2016, 7(1): 24-25. DOI:10.3969/j.issn.1674-8646.2016.01.012.
[16] 苏凤贤, 张百刚, 苟亚峰, 等. 响应面分析人参果酒酿造中果胶酶对色泽的影响[J]. 食品科学, 2011, 32(16): 49-57.
[17] 苏凤贤, 苟亚峰, 王玉芳, 等. 人参果酶法提汁工艺优化[J]. 食品与发酵工业, 2010, 36(8): 198-203.
[18] 苏凤贤, 王仁军, 张芬琴, 等. 不同澄清方式对人参果果酒澄清作用的研究[J]. 食品工业科技, 2012, 33(8): 333-338.
[19] 杜琨, 苏凤贤. 武威天梯山人参果果酒发酵工艺研究[J]. 天然产物研究与开发, 2012, 24(11): 1646-1650. DOI:10.3969/ j.issn.1001-6880.2012.11.032.
[20] 陆薇帏, 汪立平. 纯化功能性大豆低聚糖酵母菌的筛选及发酵特性初步应用[J]. 食品与发酵工业, 2016, 42(3): 168-171. DOI:10.13995/ j.cnki.11-1802/ts.201603029.
[21] 袁丽, 张伟, 王颉, 等. 鸭梨酒酵母菌的筛选[J]. 酿酒, 2004, 31(1): 90-92. DOI:10.3969/j.issn.1002-8110.2004.01.041.
[22] 崔铁忠. 柿子果酒酵母菌的分离、筛选及应用研究[D]. 北京: 中国农业大学, 2005: 11-13.
[23] 王英, 周剑忠, 朱佳娜, 等. 蓝莓自然发酵酒中优良酵母菌的筛选及鉴定[J]. 中国食品学报, 2013, 13(4): 202-206.
[24] 单艺, 张兰威, 崔宏斌. 传统法酿造糯米酒中酵母菌的筛选及发酵特性研究[J]. 食品工业科技, 2007, 28(8): 88-92. DOI:10.3969/ j.issn.1002-0306.2007.08.023.
[25] 张陈云, 刘金福, 王娜, 等. 冬枣果酒酿造酵母的分离筛选研究[J]. 中国酿造, 2010, 29(8): 43-47. DOI:10.3969/ j.issn.0254-5071.2010.08.013.
[26] 刘树文, 王玉霞, 陶怀泉, 等. SO2和酒精处理对葡萄酒自然发酵酵母菌群的影响[J]. 西北农林科技大学学报, 2008, 36(5): 196-205. DOI:10.3321/j.issn:1671-9387.2008.05.035.
[27] 季冉, 袁兴中, 增光明, 等. 外加肌醇和氯化钠对嗜鞣管囊酵母生长和产酒精能力及耐酒精能力的影响[J]. 农业环境科学学报, 2008, 27(5): 2080-2085. DOI:10.3321/j.issn:1672-2043.2008.05.071.
[28] 国家质量监督检验检疫总局. 葡萄酒、果酒通用实验方法: GB/T 15038—2006[S]. 北京: 中国标准出版社, 2006: 12.
[29] 王福荣. 酿酒分析与检测[M]. 北京: 化学工业出版社, 2005: 97-99; 102-103; 111-112.
[30] 李长文, 肖冬光, 李志勇. 面包酵母发酵力测定方法的探讨[J].食品与发酵工业, 2002, 28(11): 25-27. DOI:10.3321/j.issn:0253-990X.2002.11.007.
[31] 杨晓英, 丁立孝, 梁美霞, 等. 苹果酒优良酵母菌株的筛选[J]. 青岛农业大学学报(自然科学版), 2008, 25(1): 28-33. DOI:10.3969/ j.issn.1674-148X.2008.01.008.
[32] 牛广财, 朱丹, 王军, 等. 沙棘果酒优良酵母菌的筛选及分子生物学鉴定[J]. 中国食品学报, 2009, 9(6): 60-65. DOI:10.3969/ j.issn.1009-7848.2009.06.010.
[33] 张丹. 减少梨酒中SO2用量的方法及酿造工艺的研究[D]. 西安: 陕西科技大学, 2012: 5.
[34] 方强, 籍保平, 乔勇进, 等. 果酒中二氧化硫及其控制技术的研究进展[J]. 农业工程技术(农产品加工), 2008(2): 12-17. DOI:10.3969/ j.issn.1673-5404.2008.02.005.
[35] 吴帅, 肖冬光, 原通磊, 等. 高耐性酿酒酵母菌种的筛选[J]. 酿酒科技, 2006(9): 37-40. DOI:10.3969/j.issn.1001-9286.2006.09.007.
[36] 吴连军, 于玲, 杜金华, 等. SO2对石榴酒发酵的影响研究[J]. 酿酒, 2007, 34(2): 72-74. DOI:10.3969/j.issn.1002-8110.2007.02.029.
[37] 沈颖, 刘晓燕, 白卫东, 等. 果酒中有机酸及其对果酒作用的研究[J]. 中国酿造, 2012, 31(2): 29-31. DOI:10.3969/ j.issn.0254-5071.2012.02.008.
Screening and Fermentation Characteristics of Indigenous Yeast Strains from Spontaneously Fermented Pepino Fruit (Solanum muricatum Ait.)
SU Fengxian, ZHANG Jing, ZHENG Xiaojie*
(Department of Agricultural and Biological Technology, Wenzhou Vocational College of Science and Technology, Wenzhou 325006, China)
This study aimed to obtain a yeast strain suitable for the alcoholic fermentation of pepino fruit (Solanum muricatum Ait.) from the Hexi Corridor in Gansu. A total of 20 indigenous yeast strains were isolated from spontaneously fermented pepino juice. Out of these, 11 isolates were screened for their good fermentation performance as examined by microscopy, which were named TY8, TY5, TY6, Y3, Y4, Y5, LY3, LY1, Y1, Y2 and TY2, respectively. By comparing fermentation capacity, alcohol tolerance, SO2tolerance, physicochemical properties and sensory evaluation with active dry wine yeast, TY8 was found to be suitable for the fermentation of pepino fruit wine. The wine fermented by this strain had distinct aroma characteristics and developed a typical flavor, being clear and transparent.
Saccharomyces cerevisiae; screening; fermentation characteristics; SO2tolerance; alcohol tolerance
10.7506/spkx1002-6630-201704017
TS262.7;Q935
A
1002-6630(2017)04-0100-07
苏凤贤, 张井, 郑晓杰. 人参果自然发酵醪中酵母菌种筛选及其发酵性能[J]. 食品科学, 2017, 38(4): 100-106.
DOI:10.7506/spkx1002-6630-201704017. http://www.spkx.net.cn
SU Fengxian, ZHANG Jing, ZHENG Xiaojie. Screening and fermentation characteristics of indigenous yeast strains from spontaneously fermented pepino fruit (Solanum muricatum Ait.)[J]. Food Science, 2017, 38(4): 100-106. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201704017. http://www.spkx.net.cn
2016-06-28
浙江省教育厅访问工程师校企合作项目(FG2014198);温州市公益性科技计划项目(N20140043;N20140042;N20150031);浙江省课堂教学改革项目(KG2015975);温州市科技特派员专项(X20150007)
苏凤贤(1974—),女,副教授,硕士,研究方向为食品生物技术。E-mail:supeiecho@sina.com
*通信作者:郑晓杰(1975—),女,教授,硕士,研究方向为农特产品加工与综合利用。E-mail:zxj75719@163.com
