血清肿瘤标记物对肺部结节的诊断价值
2017-03-27王一北陈宽冰张洪岩石文君
王一北 陈宽冰 张洪岩 石文君
血清肿瘤标记物对肺部结节的诊断价值
王一北 陈宽冰 张洪岩 石文君
目的 本文通过回顾性分析肺癌患者治疗前血清CEA、CYFRA21-1和NSE水平,旨在评估肿瘤标记物对肺部结节(≤3cm)的诊断价值。方法 回顾性分析行肺叶切除术或肺楔形切除术,术后病理证实患者肿瘤直径≤3cm的临床资料。对纳入研究的患者血清肿瘤标记物水平进行ROC曲线分析,计算曲线下面积、P值、灵敏度和特异性指标、约登指数及相应界值。结果 血清CEA、CYFRA21-1及NSE对于肺部恶性结节的诊断均具有重要意义,P<0.05。其中,CEA对于诊断肺腺癌结节的灵敏度为0.241,特异性为0.890;CYFRA21-1对于肺鳞癌结节灵敏度为0.350,特异性为0.854;而NSE对于肺小细胞肺癌结节的诊断灵敏度为0.667,特异性为0.724。结论 血清CEA、CYFRA21-1及NSE对于肺部恶性结节的诊断均具有重要意义。CEA、CYFRA21-1及NSE分别对肺腺癌、肺鳞癌及小细胞肺癌结节更具诊断意义。
肿瘤标记物;肺癌;诊断;ROC曲线;回顾性分析
肺癌是世界范围内肿瘤相关死亡的重要原因[1-2]。如何早期发现并诊断肺癌,对于肺癌患者至关重要。近年来,人们对于体检越来越重视,肺部结节的检出率也大大提升。但并非所有结节都是恶性的,不同性质的结节治疗方式也大不相同[3-4]。血清肿瘤标记物是肿瘤细胞产生并释放到血清中的物质,它能帮助临床医生早期发现肺癌并对病变程度进行粗略的评估,甚至对判断肿瘤的分型也有一定帮助[5]。肺癌的肿瘤标记物可分为几大类型,主要包括癌胚蛋白、结构蛋白、酶类、细胞膜成分、分泌肽、激素和其他肿瘤相关抗原。在非小细胞肺癌中,角蛋白19片段(CYFRA21-1)和癌胚抗原(CEA)是最有帮助而且被广泛使用的肿瘤标记物,而神经特异性烯醇(NSE)是小细胞肺癌最重要的标记物。本文通过回顾性分析肺癌患者治疗前血清CEA、CYFRA21-1和NSE水平,旨在评估肿瘤标记物对肺部结节(≤3cm)的诊断价值,为临床医生选择下一步治疗方案提供循证医学证据。
资料与方法
一、一般资料
回顾性分析2014年6月至2016年3月在中国医科大学附属盛京医院胸外科住院治疗,胸部CT发现肺部结节,行肺叶切除术或肺楔形切除术,术后病理证实患者肿瘤直径≤3cm的临床资料。分别统计了患者的年龄、性别、吸烟史、肿瘤直径、术前血清CEA、CYFRA21-1、NSE水平、术后病理分型等情况。
二、血清肿瘤标记物
抽取空腹静脉血约5mL,室温放置30min后离心提取血清,应用酶联免疫吸附实验(ELISA)对标本进行检测。肿瘤标记物的正常值分表为CEA 0-5ng/mL,CYFRA21-1 0-3.3ng/mL,NSE 0-16.3ng/mL。检测值超出正常值高限为阳性。
三、方法
对纳入研究的患者血清肿瘤标记物水平进行ROC曲线分析,计算曲 线下面积、P值、灵敏度和特异性指标。分别统计不同组别的不同标记物的约登指数,取约登指数最大值时所对应的血清肿瘤标记物水平为该组标记物界值。
四、统计分析
结 果
一、基本资料
经过筛选共431例患者纳入本文研究,其中恶性结节306例(71.00%),良性结节125例(29.00%);男性患者214例(49.65%),女性患者217例(50.35%);年龄27-88岁,平均年龄60.00岁;吸烟患者165例(38.28%),不吸烟患者266例(61.72%)。具体(见表1)。
二、ROC曲线
三种肿瘤标记物对于肺部恶性结节的诊断均具有统计学意义,P<0.05,(见图1)。其中CEA对于肺腺癌的诊断更有意义,灵敏度为0.241,特异性为0.890;CYFRA21-1对于肺鳞癌的诊断更有意义,灵敏度为0.350,特异性为0.854;NSE对于肺小细胞肺癌的诊断更有意义,灵敏度为0.667,特异性为0.724。结果(见表2)。
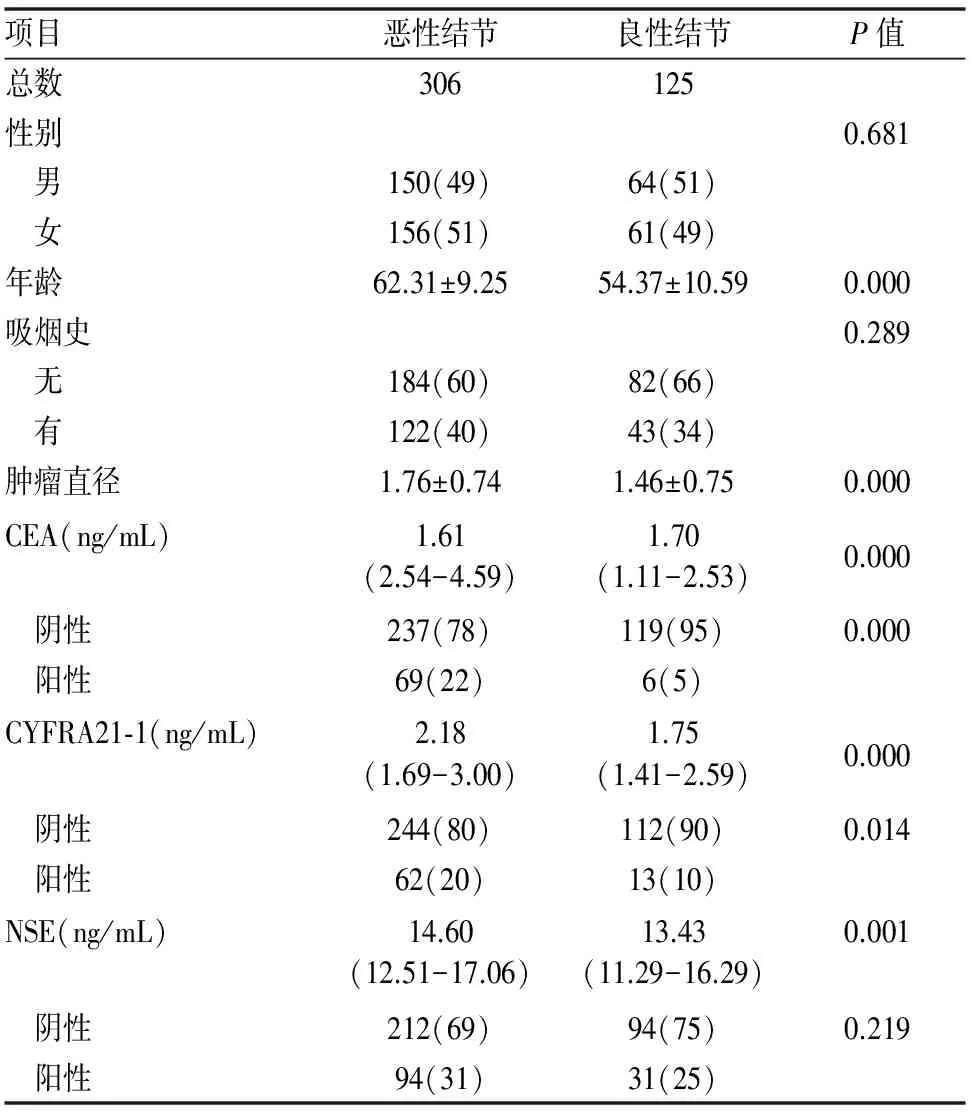
表1 纳入患者的一般资料
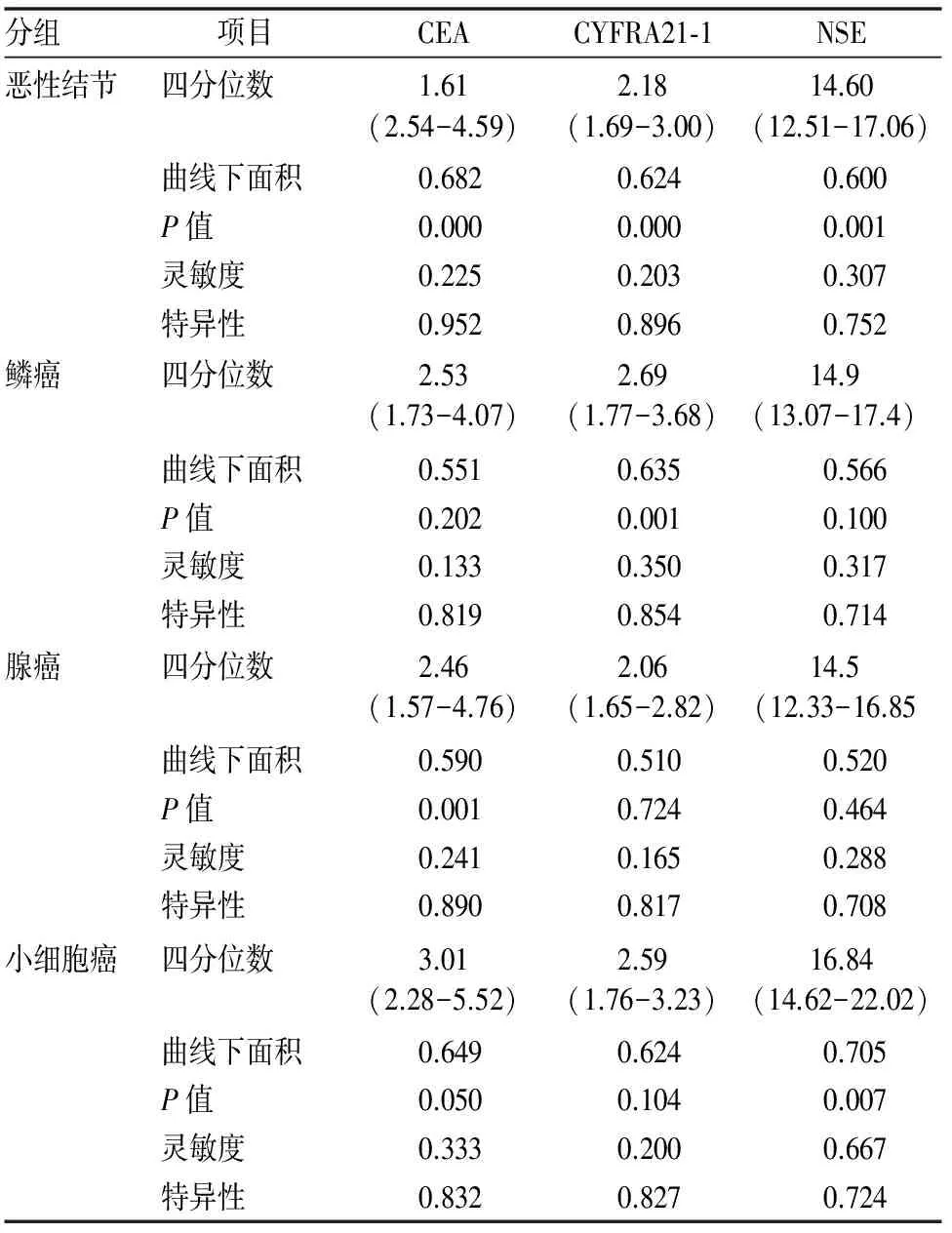
表2 血清肿瘤标记物的ROC曲线分析
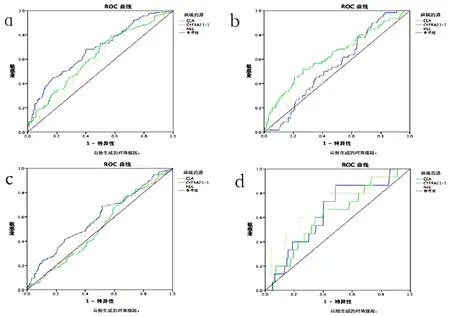
图1 a血清肿瘤标记物对恶性结节诊断的ROC曲线;b血清肿瘤标记物对鳞癌结节诊断的ROC曲线;c血清肿瘤标记物对腺癌结节诊断的ROC曲线;d血清肿瘤标记物对小细胞肺癌结节诊断的ROC曲线
三、约登指数及界值
根据ROC曲线计算不同组别的肿瘤标记物的约登指数,取约登指数最大时所对应的血清肿瘤标记物水平为界值,并计算此时肿瘤标记物的灵敏度及特异性。对于肺鳞癌CYFRA21-1的界值为2.675ng/mL,此时灵敏度为0.517,特异性为0.733;肺腺癌CEA的界值为1.880ng/mL,此时灵敏度为0.689,特异性为0.484;肺小细胞肺癌NSE的界值为16.340ng/mL,此时灵敏度为0.667,特异性为0.728。(见表3)。
讨 论
CEA是1965年由Gold和Freedman在结肠腺癌研究中发现的一种癌胚蛋白[6]。血清CEA水平升高可见于吸烟者、患良性肿瘤者和约15%-20%的炎症性病变例如溃疡性结肠炎、胰腺炎、肝脏疾病和肺部炎症[7]。约有30%-70%的肺癌患者会有血清CEA浓度异常升高,尤其在肺腺癌患者中[8-9]。与文献报道相仿,本研究中CEA对于肺部恶性结节的诊断灵敏度为0.225,特异性为0.952,ROC曲线下面积为0.682,P<0.05,当CEA水平大于等于1.44ng/mL时约登指数达到最大,提示此时CEA水平对肺部恶性结节的诊断更有意义。而对于术后病例证实为肺腺癌的肺部结节诊断灵敏度为0.241,特异性为0.890,ROC曲线下面积为0.590,P<0.05,约登指数最大为0.173,此时血清CEA水平为1.880 ng/mL。而在鳞癌及小细胞肺癌组中,也有CEA阳性患者但不具有统计学意义。
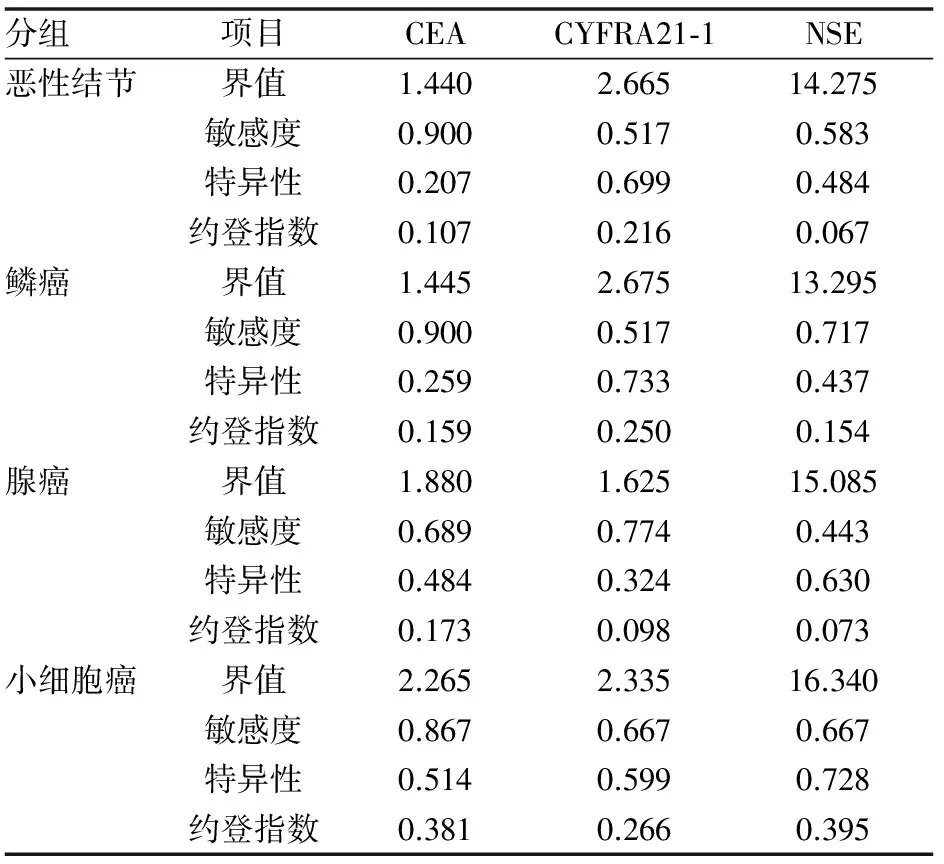
表3 约登指数与界值
CYFRA21-1不仅是一种对于诊断非小细胞肺癌有效的肿瘤标记物[9-10],而且也常常用于评估肺癌术后及放化疗治疗后患者的预后[11-12]。此外,CYFRA21-1也能够增加CEA诊断非小细胞肺癌的灵敏度[13]。有文献报道CYFRA21-1诊断肺癌的灵敏度为60%,而对于鳞癌的灵敏度高达79.6%[14]。本研究中,CYFRA21-1对于诊断肺部恶性结节及肺鳞癌结节的灵敏度分别为0.203和0.350,特异度分别为0.896和0.854,ROC曲线下面积分别为0.624及0.635。研究结果低于文献报道可能是由于本研究入选的肺部结节≤3cm,而不是所有肺癌患者;而且所有患者均为术后病理证实,未包括支气管镜及介入穿刺病理证实为肺癌的患者。当约登指数最大时,CYFRA21-1诊断肺部恶性结节及鳞癌结节的界值分别为2.665ng/mL及2.675ng/mL。
NSE是一种参与细胞能量产生的胞内酶,因此血清NSE水平能够反应细胞的死亡率。血清NSE被证实是肺小细胞肺癌的重要肿瘤标记物,在局限性小细胞肺癌病变中有40-70%的患者有治疗前的NSE水平升高,而在进展性病变中有高达83-98%的患者血清NSE水平升高[13, 15]。与文献报道相仿,本研究中NSE对小细胞结节的灵敏度为0.667,特异性为0.724,ROC曲线下面积为0.705。对恶性结节的灵敏度、特异性和曲线下面积分别为0.307、0.752和0.600。当约登指数最大时,NSE对肺部恶性结节及小细胞结节的诊断界值分别为14.275ng/mL及16.340ng/mL。
综上所述,血清CEA、CYFRA21-1及NSE对于肺部恶性结节的诊断均具有重要意义。其中,CEA对于诊断肺腺癌结节更有意义,此时建议CEA界值为1.880ng/mL;CYFRA21-1对于肺鳞癌结节更有优势,建议界值为2.675ng/mL;而NSE对于肺小细胞肺癌结节的诊断具有统计学意义,建议界值为16.340ng/mL。
[1] Filosso PL, Ruffini E, Asioli S, et al. Adenosquamous lung carcinomas: a histologic subtype with poor prognosis[J]. Lung Cancer,2011, 74(1):25-29.
[2] Jemal A, Thun MJ, Ries LA, et al. Annual report to the nation on the status of cancer, 1975-2005, featuring trends in lung cancer, tobacco use, and tobacco control[J]. J Natl Cancer Inst, 2008, 100(23):1672-1694.
[3] Dhara AK, Mukhopadhyay S, Dutta A, et al. Content-Based Image Retrieval System for Pulmonary Nodules: Assisting Radiologists in Self-Learning and Diagnosis of Lung Cancer[J]. J Digit Imaging, 2016,1-15.
[4] Farjah F, Halgrim S, Buist DS, et al. An Automated Method for Identifying Individuals with a Lung Nodule Can Be Feasibly Implemented Across Health Systems[J]. EGEMS (Wash DC),2016, 4(1):1254.
[5] Ren J, Zhang D, Liu Y,et al: Simultaneous Quantification of Serum Nonesterified and Esterified Fatty Acids as Potential Biomarkers to Differentiate Benign Lung Diseases from Lung Cancer[J]. Sci Rep,2016, 6:34201.
[6] Mountain CF. Revisions in the International System for Staging Lung Cancer[J]. Chest 1997, 111(6):1710-1717.
[7] Grunnet M, Sorensen JB. Carcinoembryonic antigen (CEA) as tumor marker in lung cancer[J]. Lung Cancer,2012, 76(2):138-143.
[8] Duan X, Cui Y, Li H, et al. High preoperative and postoperative levels of carcinoembryonic antigen and CYFRA 21-1 indicate poor prognosis in patients with pathological Stage I nonsmall cell lung cancer[J]. Indian J Cancer, 2015, 52(Suppl 3): E158-E163.
[9] Tomita M, Shimizu T, Ayabe T, et al. Prognostic significance of tumour marker index based on preoperative CEA and CYFRA 21-1 in non-small cell lung cancer[J]. Anticancer Res,2010, 30(7):3099-3102.
[10] Farlow EC, Vercillo MS, Coon JS,et al. A multi-analyte serum test for the detection of non-small cell lung cancer[J]. Br J Cancer,2010, 103(8):1221-1228.
[11] Muley T, Dienemann H, Ebert W. Increased CYFRA 21-1 and CEA levels are negative predictors of outcome in p-stage I NSCLC[J]. Anticancer Res,2003, 23(5b):4085-4093.
[12] Wang J, Yi Y, Li B, et al. CYFRA21-1 can predict the sensitivity to chemoradiotherapy of non-small-cell lung carcinoma[J]. Biomarkers,2010, 15(7):594-601.
[13] Pujol JL, Boher JM, Grenier J, et al. Cyfra 21-1, neuron specific enolase and prognosis of non-small cell lung cancer: prospective study in 621 patients[J]. Lung Cancer, 2001, 31(2-3):221-231.
[14] Hirose T, Okuda K, Yamaoka T, et al. Are levels of pro-gastrin-releasing peptide or neuron-specific enolase at relapse prognostic factors after relapse in patients with small-cell lung cancer[J]. Lung Cancer, 2011, 71(2):224-228.
[15] Wei T, Luo RC, Zuo Q, et al. Role of the cut-off value of serum neuron-specific enolase in differentiating small cell lung cancer from non-small cell lung cancer[J]. Journal of Southern Medical University, 2006, 26(6): 858-859.
Value of serum tumor markers in diagnosis of pulmonary nodules
WANGYi-bei,CHENKuan-bing,ZHANGHong-yan,SHIWen-jun.
DepartmentofThoracicSurgery,ShengjingHospitalofChinaMedicalUniversity,Shenyang,Liaoning110022,China
Objective To review the serum concentrations of CEA, CYFRA21-1 and NSE in patients with lung cancer, so as to assess the diagnostic value of tumor markers of lung nodules (≤3cm). Methods The clinical data of patients with postoperative tumor diameter less than 3cm after lobectomy or wedge resection was retrospectively analyzed. ROC curve analysis was carried out on the level of serum tumor markers in the patients and the area under the curve, the value of P, sensitivity, specificity, Youden's index and threshold value were calculated. Results The serum CEA, CYFRA21-1 and NSE had great significance in the diagnosis of pulmonary malignant nodules (P<0.05). CEA was more meaningful for the diagnosis of adenocarcinoma nodules, with the sensitivity of 0.241 and specificity of 0.890. CYFRA21-1 had the advantage for squamous cell carcinoma nodules, and its sensitivity was 0.350 and specificity was 0.854. NSE had statistical significance for the diagnosis of small cell lung cancer nodules, and its sensitivity was 0.667 and specificity was 0.724. Conclusion Serum CEA, CYFRA21-1 and NSE have statistical significance in the diagnosis of pulmonary malignant nodules. CEA, CYFRA21-1 and NSE are more significant in the diagnosis of lung adenocarcinoma, lung squamous cell carcinoma and small cell lung cancer respectively.
tumor marker; lung cancer; diagnosis; ROC curve; retrospective analysis
10.3969/j.issn.1009-6663.2017.04.005
110022 辽宁 沈阳,中国医科大学附属盛京医院胸外科
石文君,E-mail:757511877@qq.com
2016-11-15]
