降钙素基因相关肽参与调节Th17和Treg细胞分化
2017-03-27刘文宣刘文聪姚智燕
刘文宣,杨 磊,刘文聪,姚智燕,李 涛,苏 鹏
(1.河北医科大学公共卫生学院流行病与卫生统计学教研室,河北 石家庄 050017;2.河北医科大学第一医院超声科,河北 石家庄 050031;3.河北医科大学基础医学院免疫学教研室,河北 石家庄 050017;4.辽宁省辽阳市中心医院胸外科,辽宁 辽阳 111000)
·论 著·
降钙素基因相关肽参与调节Th17和Treg细胞分化
刘文宣1,杨 磊1,刘文聪2,姚智燕3,李 涛1,苏 鹏4*
(1.河北医科大学公共卫生学院流行病与卫生统计学教研室,河北 石家庄 050017;2.河北医科大学第一医院超声科,河北 石家庄 050031;3.河北医科大学基础医学院免疫学教研室,河北 石家庄 050017;4.辽宁省辽阳市中心医院胸外科,辽宁 辽阳 111000)
目的研究降钙素基因相关肽(calcitonin gene related peptide, CGRP)对人外周血中Th17(IL-17 producing T cell)和Treg(regulatory T cell)细胞分化的调节作用。方法采用免疫磁珠法(magnetic activated cell sorting,MACS)分离人外周血中CD4+CD45RA+T细胞,即初始CD4+T细胞,在一定条件下分别体外诱导其向Th17细胞和Treg细胞分化,之后用流式细胞术测定Th17和Treg细胞所占比例;用实时定量RT-PCR方法检测Th17和Treg细胞分化的特异性转录因子维甲酸相关核孤儿受体γt(orphan nuclear receptor γt,RORγt)和转录因子FoxP3 (foxhead box protein 3)mRNA的表达水平;用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测Th17细胞上清中IL-17A的含量,进而从多个方面探讨CGRP对Th17和Treg细胞分化的影响。结果CGRP可剂量依赖性增加Th17细胞所占的比例和RORγt mRNA的表达水平(P<0.05);另外,CGRP也促进了IL-17A的分泌(P<0.05)。同时,CGRP能剂量依赖性抑制Treg细胞所占的比例和FoxP3 mRNA的表达(P<0.05)。结论CGRP可促进人外周血中初始CD4+T细胞向Th17细胞分化,而抑制其向Treg细胞分化。
降钙素;Th17细胞;T淋巴细胞,调节性
Th17(IL-17 producing T cell)细胞表达特异性转录因子维甲酸相关核孤儿受体γt(orphan nuclear receptor γt,RORγt)因其可分泌白细胞介素(interleukin,IL)17而命名,该细胞通过促进炎症反应的发生,参与多种自身免疫性疾病的免疫应答[1]。Treg细胞(regulatory T cell)双表达CD25和转录因子FoxP3(foxhead box protein 3),主要作用表现为抑制抗原呈递细胞的功能、抑制T细胞增殖及促炎性细胞因子分泌[2]。可见,Th17和Treg细胞在功能上表现出互相抑制的特点,分化发育方面亦是如此。但研究表明,二者的分化平衡在多种疾病,如自身免疫性疾病及炎症性疾病的发病中发挥重要作用[3]。降钙素基因相关肽(calcitonin gene related peptide,CGRP)是Rosenfeld等1983年在神经组织内发现的一种由37个氨基酸残基组成的多功能生物活性多肽,广泛分布于机体中枢、外周神经系统以及淋巴器官的神经末梢中,对机体多个脏器和系统的功能具有重要的调节作用,如CGRP作为一种免疫调节肽,在免疫调节方面发挥重要作用。最近的研究结果显示,CGRP通过抑制抗原提呈细胞的功能进而抑制Th1细胞分化及γ干扰素分泌,同时促进Th2细胞分化及IL-4分泌[4-5]。为了对CGRP的免疫调节功能有更全面的了解,本研究拟探索CGRP对Th17和Treg细胞分化是否具有调节作用。
1 材料与方法
1.1 实验材料 LEAFTM-purified anti-human CD3(OKT3)和LEAFTM-purified anti-human CD28(CD28.2)购于Biolegend(San Diego,CA)公司;人重组TGF- β1、人重组IL-2、人重组IL-6、人重组IL-1 β和人重组IL-23购于 R&D(Lille,France)公司;CGRP购于Cayman Chemical(Ann Arbor,MI)公司;PCR引物购于上海生工生物科技公司;反转录及实时定量PCR试剂盒(SYBR®PrimeScript®RT-PCR Kit)购于TaKaLa公司;FITC anti-human CD4、FITC anti-human CD25(2A3)、PE anti-human FoxP3(259D/C7)、PE anti-human IL-17A(N49-653)等抗体及流式细胞检测所需细胞破膜剂、固定剂等试剂均购于 BD(San Diego,CA)公司。
1.2 细胞的制备 Ficoll密度梯度离心法制备外周血单个核细胞,使用CD4+CD45RA+磁珠分离试剂盒分选初始 CD4+T细胞,流式细胞术鉴定纯度>95%。
1.3 T细胞培养及诱导分化方案 收集分选初始 CD4+T细胞,用RPMI 1640培养基(含10%热灭活胎牛血清,青霉素/链霉素100 U/ mL)重悬,调整细胞浓度为1×105个/mL,接种于用anti-CD3抗体(浓度为5 mg/L)预先包被的24孔U形板中,之后使用不同方法诱导培养Th17和Treg细胞:加入CD28抗体(终浓度为2 mg/L)、转化生长因子β1(transforming growth factor-β1,TGF-β1)(终浓度为5 μg/L)、IL-6(终浓度为20 μg/L)、IL-1β(终浓度为20 mg/L)及IL-23(终浓度为25 μg/L)刺激培养Th17细胞;加入CD28抗体(终浓度为2 mg/L)、TGF-β1(终浓度为5 μg/L)、IL-2(终浓度为500 U/mL)刺激培养Treg细胞,37 ℃、5%CO2培养7 d。以上述诱导方案培养的细胞为单纯诱导组,即对照组;以在单纯诱导方案的基础上加入不同浓度CGRP(终浓度分别为10-9、10-8、10-7、10-6mol)的细胞作为实验组,通过比较检测不同浓度的CGRP对Th17和Treg细胞分化是否具有调节作用。
1.4 胞内染色和流式检测方法 Th17细胞的胞内染色方法:磁珠分选的初始 CD4+T细胞,采用上述分组方式,按照上述Th17细胞诱导分化方法培养细胞,7 d后收集各组细胞,加入CD4抗体37℃避光孵育30 min,之后加入佛波酯(PMA,终浓度为50 μg/L)、离子霉素 (ionomycin,终浓度为1 μmol)和0.7 μL蛋白转运抑制剂(BD GolgistopTM)继续37 ℃避光孵育4 h。使用固定剂、破膜剂处理细胞之后,加入IL-17A抗体室温避光孵育45 min。最后,流式细胞仪上机检测各组细胞中CD4+IL-17+T细胞,即Th17细胞所占比例。Treg细胞的胞内染色方法:磁珠分选的初始 CD4+T细胞,采用上述分组方式,按照上述Treg细胞诱导分化方法培养细胞,7 d后收集各组细胞,加入CD25抗体室温避光孵育30 min,用固定剂、破膜剂处理细胞之后,加入FoxP3抗体并室温避光孵育45 min。最后,流式细胞仪上机检测各组细胞中CD25+FoxP3+T细胞,即Treg细胞所占比例。
1.5 RNA提取和实时定量RT-PCR 磁珠分选的初始 CD4+T细胞,采用上述分组方式,按照上述Th17和Treg细胞诱导分化方法培养细胞,7 d后收集各组细胞,提取细胞的全基因组RNA,经逆转录合成cDNA,取2 μL cDNA为模板,使用SYBR Green PCR Master Mix进行目的片段扩增,引物序列如下。RORγt F:5′-CTCAAAGCAGGAGCAA-TGGAAGT-3′,RORγt R:5′-GGAGTGGGAGAA-GTCAAAGATGGA-3′; FoxP3 F:5′-CATCCGCC-ACAACCTGAGTCTGC-3′,FoxP3 R:5′-CCTG-TTCGTCCATCCTCCTTTCCT-3′;β-actin F:5′-GTCACCTTCACCGTTCCAGTTTT-3′,β-actin R:5′-CTTAGTTGCG -TTACACCCTTTCTT-3′。采用实时定量RT-PCR方法检测各组细胞中RORγt mRNA和 FoxP3 mRNA的相对表达水平,结果以待测基因/β-actin的Ct比值表示。
1.6 酶联免疫吸附测定法检测IL-17A水平 磁珠分选的初始 CD4+T细胞,采用上述分组方式,按照上述Th17细胞诱导分化方法培养细胞,7 d后收集各组细胞上清,用酶联免疫吸附测定法试剂盒检测上清液中IL-17A蛋白水平,具体操作参照试剂说明书。
1.7 统计学方法 应用SPSS 16.0软件进行分析,计量资料比较分别采用t检验、单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 诱导前后Th17和Treg细胞比较 诱导分化后细胞中含Th17细胞和Treg细胞较诱导分化前明显升高,差异有统计学意义(P<0.05),见表1。
2.2 不同时点间RORγt和FoxP3的表达 随着培养时间的延长,RORγt和FoxP3 mRNA的表达逐渐升高,在第7天时表达量达高峰,诱导后第3天、第5天、第7天与诱导前比较差异有统计学意义(P<0.01),见表2。
表1 诱导初始CD4+T 细胞向Th17和Treg细胞分化
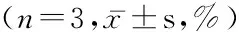
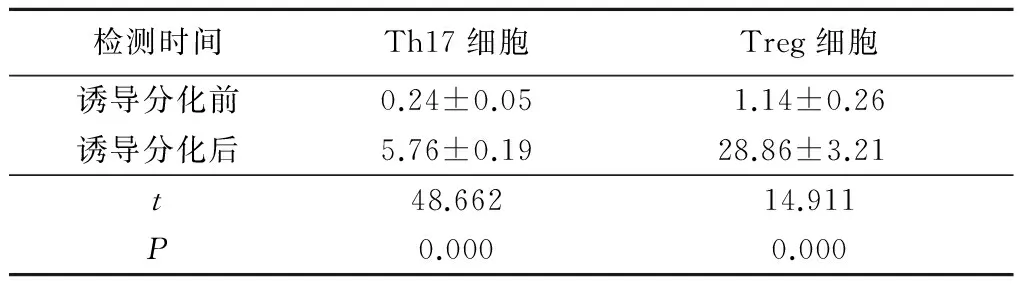
检测时间Th17细胞Treg细胞诱导分化前0.24±0.051.14±0.26诱导分化后5.76±0.1928.86±3.21t48.66214.911P0.0000.000
表2 RORγt和FoxP3 mRNA表达具时间依从性
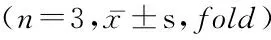
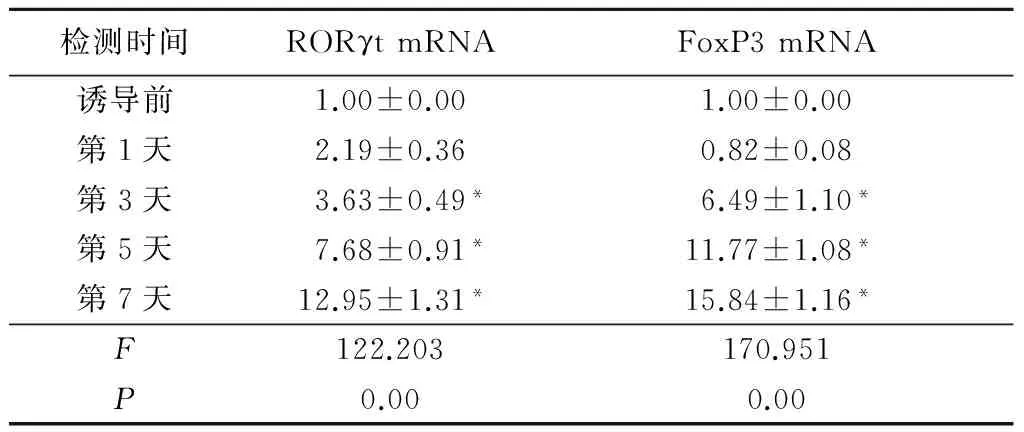
检测时间RORγtmRNAFoxP3mRNA诱导前1.00±0.001.00±0.00第1天2.19±0.360.82±0.08第3天3.63±0.49*6.49±1.10*第5天7.68±0.91*11.77±1.08*第7天12.95±1.31*15.84±1.16*F122.203170.951P0.000.00
*P<0.05与诱导前比较(SNK-q检验)
2.3 不同浓度CGRP对Th17细胞、RORγt mRNA和IL-17A的影响 诱导培养7 d后结果显示,随着CGRP浓度的增加,Th17细胞、RORγt RNA和IL-17A均呈逐渐升高,Th17细胞在CGRP10-7mol和CGRP-6mol、RORγt mRNA和IL-17A在CGRP10-8mol、CGRP-7mol、CGRP-6mol时内表达与对照组比较差异均有统计学意义(P<0.01),见表3。
2.4 不同浓度CGRP对Treg细胞和FoxP3的影响 随着CGRP浓度的增加,Treg细胞和FoxP3 mRNA的表达逐渐降低,在CGRP10-8mol、CGRP-7mol和CGRP10-6mol浓度时的表达与对照组比较差异均有统计学意义(P<0.01),见表4。
表3 CGRP对Th17细胞分化的影响
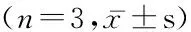

组别 Th17细胞(%)RORγtmRNA(fold)IL-17A(ng/L)对照组 5.76±0.191.00±0.00125.55±7.63CGRP(10-9mol)6.65±0.321.09±0.08159.45±8.12CGRP(10-8mol)7.96±0.391.30±0.03*188.17±10.12*CGRP(10-7mol)8.46±0.48*1.46±0.05*209.91±11.55*CGRP(10-6mol)9.54±0.89*1.54±0.07*246.45±15.10*F 25.40254.45154.782P 0.0000.0000.000
*P<0.05与对照组比较(SNK-q检验)
表4 CGRP对Treg细胞分化的影响
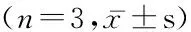
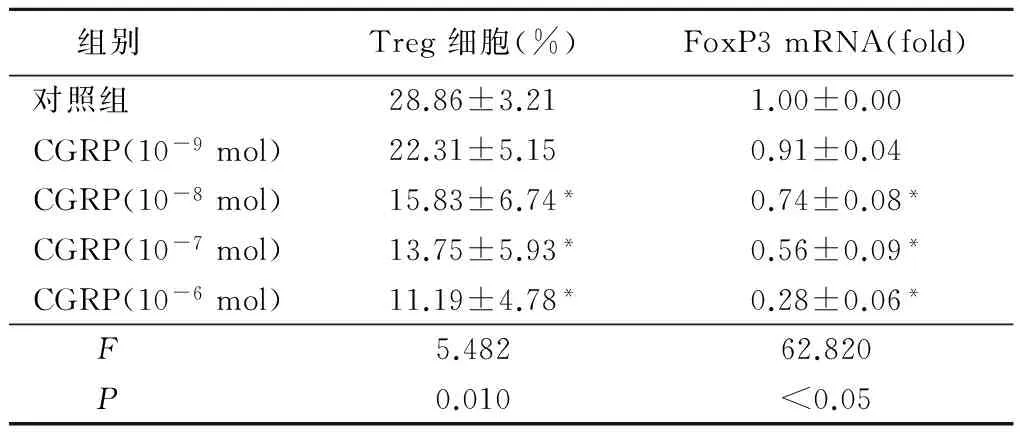
组别 Treg细胞(%)FoxP3mRNA(fold)对照组 28.86±3.211.00±0.00CGRP(10-9mol)22.31±5.150.91±0.04CGRP(10-8mol)15.83±6.74*0.74±0.08*CGRP(10-7mol)13.75±5.93*0.56±0.09*CGRP(10-6mol)11.19±4.78*0.28±0.06*F 5.48262.820P 0.010<0.05
*P<0.05与对照组比较(SNK-q检验)
3 讨 论
Th17 和 Treg细胞的分化平衡在自身免疫性疾病及炎症相关疾病,如在类风湿性关节炎的发生发展中起重要作用[6]。Th17 和 Treg细胞都是由Th0细胞分化而来的,Th17 细胞具有明显的促炎作用,而 Treg细胞具抗炎性能,二者在功能上互相拮抗,在分化过程上互相抑制,但有一定的相关性:当机体处在稳定状态下,抗原提呈细胞分泌的TGF-β促进Th0向Treg细胞分化,同时IL-2的存在可促进Treg细胞的进一步增殖;而机体在感染或炎症状态时,体内大量分泌IL-6和IL-1β,二者与抗原提呈细胞分泌的TGF-β一起共同诱导Th0向Th17细胞分化,同时IL-23的存在可促进Th17细胞的进一步增殖。本研究应用免疫磁珠法分选初始 CD4+T细胞,使用anti-CD3、anti-CD28抗体、TGF-β1、IL-6、IL-1β及IL-23培养7 d, 成功诱导了Th17细胞的分化;使用anti-CD3、anti-CD28抗体、TGF-β1及IL-2培养7 d, 成功诱导了Treg细胞的分化。此方法与文献报道一致[7-8]。同时还研究了在诱导过程中,Th17和Treg细胞的特异性转录因子RORγt和FoxP3 在mRNA水平的表达情况,结果表明RORγt mRNA和FoxP3 mRNA的表达量均随诱导培养时间的延长而表达量逐渐增加,在7 d时表达量达高峰。与文献报道一致[7-8]。Th17和Treg细胞诱导模式的成功为本研究提供了基础平台。
CGRP作为免疫调节肽,具有多种免疫调节作用。如CGRP可以抑制T细胞增殖、存活及IL-2的分泌[9];CGRP可抑制脂多糖诱导的树突状细胞分泌TNF-ɑ、 IL-12等促炎性细胞因子[4];CGRP可抑制树突细胞成熟、抑制树突状细胞和巨噬细胞迁移、抗原呈递及其活化T细胞的功能[10],并通过抑制树突状细胞的功能进而抑制Th1细胞分化及INF-γ分泌,而促进Th2细胞分化及IL-4分泌[4-5];另外,CGRP还可促进Th9细胞分化及IL-9分泌[11]。可见,CGRP作为一种重要的调节介质参与了T细胞分化。本研究结果显示,CGRP增加了人外周血CD4+T细胞中RORγt mRNA的表达及Th17细胞所占的比例,可见CGRP可促进初始CD4+T细胞向Th17细胞分化。另外,本研究又测定了各组Th17细胞培养上清中的IL-17A含量,结果表明CGRP也显著促进了IL-17A分泌。说明CGRP不仅促进了Th17细胞的分化,其对Th17细胞的功能也具有调节作用。同时,CGRP下调了人外周血来源的CD4+T细胞中FoxP3 mRNA的表达及Treg细胞所占的比例,也就是说,CGRP可抑制初始CD4+T细胞向Treg细胞分化。CGRP可与一些炎性细胞、免疫细胞等相互作用,参与调节机体炎症反应。有研究表明,在体内,CGRP通过调节树突状细胞、T细胞的功能参与接触性皮炎[5]、卵白蛋白诱导的超敏反应[12]、过敏性支气管哮喘[13]等一系列免疫性炎症过程;CGRP还可通过影响免疫细胞分泌IL-1β、TNF-α和 IL-6,而在类风湿性关节炎的发病中发挥重要作用[14]。令我们感兴趣的是,最近有研究发现CGRP可以通过调节IL-17的表达而促进Th17细胞介导的实验性自身免疫性脑脊髓炎发生[15]。看来,CGRP作为免疫调节肽,参与了多种疾病的发生发展。
综上所述,CGRP对人外周血中Th17和Treg细胞分化均有调节作用,接下来的研究中,将建立胶原诱导的关节炎小鼠模型,进一步确定CGRP是否可以通过调节Th17和Treg细胞分化平衡参与类风湿性关节炎的发生,从而为类风湿性关节炎发病机制的研究提供新的思路。
[1] Arezoo GS,Ebrahim F,Fatemeh ZS. Interleukin-17 in human inflammatory diseases[J]. Postepy Dermatol Alergol,2014,31(4):256-261.
[2] Ellis JS,Wan X,Braley-Mullen H. Transient depletion of CD4+CD25+regulatory T cells results in multiple autoimmune diseases in wild-type and B-cell-deficient NOD mice[J]. Immunology,2013,139 (2):179-186.
[3] Noack M,Miossec P. Th17 and regulatory T cell balance in autoimmune and inflammatory diseases[J]. Autoimmun Rev,2014,13(6):668-677.
[4] Mikami N,Sueda K,Ogitani Y,et al. Calcitonin gene-related peptide regulates type Ⅳ hypersensitivity through dendritic cell functions[J]. PLoS ONE,2014,9(1):e86367.
[5] Mikami N,Matsushita H,Kato T,et al. Calcitonin gene-related peptide is an important regulator of cutaneous immunity:effect on dendritic cell and T cell functions[J]. J Immunol,2011,186(12):6886-6893.
[6] 张莹,周小莉.Th17/Treg平衡在类风湿关节炎发病和治疗中的意义[J]. 中国医药导报,2015,12(24):48-52.
[7] Li JN,Li JX,Huang HL,et al. Influence of sirolimus-induced TGF-β secretion on mouse Treg cell proliferation[J]. Genet Mol Res,2015,14(4):18569-18579.
[8] Ghaedi M,Namdari H,Rahimzadeh P,et al. Different Doses of Transforming growth factor-β on In vitro Differentiation of Human Naive CD4+T Cells to T Helper 17[J]. Iran J Allergy Asthma Immunol,2015,14(6):633-637.
[9] Granstein RD,Wagner JA,Stohl LL,et al. Calcitonin gene-related peptide:key regulator of cutaneous immunity[J]. Acta Physiol (Oxf),2015,213(3):586-594.
[10] Rochlitzer S,Veres TZ,Kuhne K,et al. The neuropeptide calcitonin gene-related peptide affects allergic airway inflammation by modulating dendritic cell function[J]. Clin Exp Allergy,2011,41(11):1609-1621.
[11] Mikami N,Miyagi Y,Sueda K,et al. Calcitonin Gene-Related Peptide and Cyclic Adenosine 5′-Monophosphate/Protein Kinase A Pathway Promote IL-9 Production in Th9 Differentiation Process[J]. J Immunol,2013,190(8):4046-4055.
[12] Yoshikawa R,Mikami N,Otani I,et al. Suppression of ovalbumin-induced allergic diarrhea by diminished intestinal peristalsis in RAMP1-deficient mice[J]. Biochem Biophys Res Commun,2011,410(3):389-393.
[13] Xu CW,Guo SC,Zheng ZW,et al. Effect of gamma-aminobutyric acid treatment on plasma substance P and calcitonin gene-related peptide levels in children with asthma[J]. Zhongguo Dang Dai Er Ke Za Zhi,2013,15(2):102-104.
[14] Nieto FR,Clark AK,Grist J,et al. Calcitonin gene-related peptide-expressing sensory neurons and spinal microglial reactivity contribute to pain states in collagen-induced arthritis[J]. Arthritis Rheumatol,2015,67(6):1668-1677.
[15] Mikami N,Watanabe K,Hashimoto N,et al. Calcitonin gene-related peptide enhances experimental autoimmune encephalomyelitis by promoting Th17 cell functions[J]. Int Immunol,2012,24(11):681-691.
(本文编辑:刘斯静)
Calcitonin gene related peptide participate in the regulation of Th17 and Treg differentiation
LIU Wen-xuan1, YANG Lei1, LIU Wen-cong2, YAO Zhi-yan3, LI Tao1, SU Peng4*
(1.DepartmentofEpidemiologyandStatistics,SchoolofPublicHealth,HebeiMedicalUniversity,Shijiazhuang050017,China;2.DepartmentofUlstrasound,theFirstHospitalofHebeiMedicalUniversity,Shijiazhuang050031,China;3.DepartmentofImmunology,InstituteofBasicMedicine,HebeiMedicalUniversity,Shijiazhuang050017,China; 4.DepartmentofThoracicSurgery,theCentralHospitalofLiaoyangCity,Liaoyang111000,China)
Objective To dissect the role of calcitonin gene related peptide(CGRP) on IL-17 producing T cell(Th17) and regulatory T cell(Treg) differentiation. Methods Naive CD4+T cells were isolated from human peripheral blood by magnetic activated cell sorting(MACS) selection, and cultured under Th17-polarizing and Treg-polarizing condition, The proportion of Th17 cells and Treg cells were detected by flow cytometry, the relative expression levels of retionid-related orphan nuclear receptor γt(RORγt) mRNA and foxhead box protein 3(FoxP3) mRNA were measured by real-time RT-PCR. In addition, we detected the production of IL-17A by enzyme-linked immunosorbent assay, we explored the effects of CGRP on the differentiation of Th17 and Treg cells form Several aspects. Results CGRP increased the proportion of Th17 cells and the expression of RORγt mRNA(P<0.05). Additionally, CGRP also increased the production of IL-17A(P<0.05), these effects of CGRP were in dose-dependent manner. Meanwhile, CGRP inhibited the percentage of Treg cells and the expression of FoxP3 mRNA also in dose-dependent way(P<0.05), peaking at 10-6M. Conclusion These results demonstrate that CGRP facilitates naive CD4+T cells from human peripheral blood differentiate to Th17 cells, but suppresses them differentiate to Treg cells.
calcitonin; Th17 cells ;T-lymphocytes, regulatory
2016-11-18;
2017-01-04
河北省高等学校科学研究计划(QN2015006);河北省医学科学研究重点课题(20150626,20150631)
刘文宣(1983-),女,河北栾城人,河北医科大学公共卫生学院副教授,医学博士,从事类风湿性关节炎免疫机制研究。
*通讯作者。E-mail:76654228@qq.com
R392.9
A
1007-3205(2017)03-0326-05
10.3969/j.issn.1007-3205.2017.03.019
