HPV-16 URR突变对病毒早期启动子活性影响的研究
2017-03-27侯向前玛依努尔尼亚孜马正海
宋 丹,史 茜,侯向前,玛依努尔·尼亚孜,马正海
HPV-16 URR突变对病毒早期启动子活性影响的研究
宋 丹1,史 茜1,侯向前1,玛依努尔·尼亚孜2,马正海1
1.新疆大学生命科学与技术学院,新疆 乌鲁木齐 830046;2.新疆维吾尔自治区人民医院妇产科,新疆 乌鲁木齐 830001
背景与目的:新疆是宫颈癌高发区,该地区宫颈癌高发与人乳头瘤病毒16型(human papillomavirus type 16,HPV-16)感染密切相关。该研究旨在分析新疆地区妇女宫颈病样组织中HPV-16上游调控区(upstream regulatory region,URR)的突变及其功能。方法:以新疆妇女子宫颈上皮非典型增生(cervical intraepithelial neoplasia,CIN)和宫颈癌病样组织标本DNA为模板,PCR扩增HPV-16 URR片段,PCR产物经测序比对,筛选代表性的URR突变体构建至pGL3-Basic载体,将其转染Vero细胞,48 h后检测荧光素酶活性,分析URR突变体启动子活性。结果:采用聚合酶链反应(polymerase chain reaction,PCR)获得了55个HPV-16 URR DNA片段,测序及序列分析发现44个突变位点,其中nt7192(G→T)、nt7433(-→T)、nt7435(C→G)和nt7863(A→-)4个位点的突变为所有序列共有,nt7520(G→A)位点的突变存在于54个样品中,剩余39个位点的突变存在于不同样品中。根据突变的位置、频率和程度,筛选出9个URR突变体分别克隆至pGL3-Basic中荧光素酶基因前并转染Vero细胞。荧光素酶活性分析表明,不同URR突变体的启动子活性差异较大,来源于宫颈癌的URR突变体启动子活性显著高于来源于CIN的URR突变体(P<0.01),部分宫颈癌URR突变体的启动子活性显著高于SiHa和Caski细胞来源的URR参照序列的启动子活性。结论:新疆地区分离的HPV-16 URR发生多位点突变,其中部分突变增强了URR内部启动子的活性,导致HPV-16致癌活性增强。
人乳头瘤病毒16型;上游调控区;突变;启动子
人乳头瘤病毒16型(human papillomavirus type 16,HPV-16)为无囊膜的小型双链环状DNA病毒,可引起皮肤和黏膜的良性或恶性肿瘤。HPV的基因组全长约7 900 bp,分为早期区(E区)、晚期区(L区)和上游调控区(upstream regulatory region,URR),E区编码具有转化活性的E6、E7蛋白以及调控病毒复制和基因表达的E1和E2蛋白,L区编码病毒衣壳蛋白,URR区包含病毒DNA复制起点(origin of replication,Ori)、E区启动子P97和调控病毒基因转录的多个顺式作用元件。
新疆南部维吾尔族聚居区是宫颈癌高发区,在前期研究中发现新疆妇女宫颈癌活检组织标本中分离的HPV-16 E6[1]、L1[2]、L2[3]基因以及URR[4]均发生突变,其中URR的突变最为频繁。本研究扩大宫颈癌病样数进一步分析新疆地区HPV-16 URR突变,并分析URR突变体内的启动子活性,以探讨新疆地区HPV-16 URR突变与宫颈癌高发间的内在联系。
1 材料和方法
1.1 宫颈病变组织
收集宫颈上皮内瘤样病变Ⅰ(cervical intraepithelial neoplasiaⅠ,CINⅠ)10例、宫颈上皮内瘤样病变Ⅱ(cervical intraepithelial neoplasiaⅡ,CINⅡ)10例、宫颈上皮内瘤样病变Ⅲ(cervical intraepithelial neoplasia Ⅲ,CIN Ⅲ)27例和宫颈癌(cervical cancer,CC)组织标本51例。组织样本都来自新疆维吾尔自治区人民医院妇产科,均经病理学诊断。
1.2 质粒及细胞
非洲绿猴肾细胞Vero为永生化细胞,大肠杆菌DH5α和载体pGL3-Basic均为本实验室保存;SiHa和Caski均为整合了HPV-16基因组的宫颈癌细胞系,其URR作为阳性对照。
1.3 主要试剂
Ex Taq DNA聚合酶、DNA marker、T4DNA连接酶和限制性内切酶均购自宝生物工程(大连)有限公司;DNA切胶回收试剂盒购自天根生化科技(北京)有限公司;荧光素酶检测试剂盒购自美国Promega公司;细胞转染试剂盒LipofectamineTM2000 Reagent购自美国 Invitrogen公司;引物合成与测序由生工生物工程(上海)股份有限公司完成。
1.4 HPV-16 URR基因扩增
分别以新疆妇女宫颈病样组织基因组以及SiHa和Caski细胞基因组为模板,用HPV-16 URR特异性引物扩增URR片段,上游引物序列为:5’-GCTTGTGTAACTATTG TGTCA-3’,下游引物序列为:5’-GTCCTGA AACATTGCAGTTCTCT-3’,聚合酶链反应(polymerase chain reaction,PCR)扩增参数为:95 ℃ 5 min;94 ℃ 45 s,55 ℃ 30 s,72 ℃1 min,35个循环;72 ℃ 7 min;4 ℃终止。PCR产物回收后测序。
1.5 递归式PCR扩增W12 URR基因
永生化上皮细胞W12源自人类宫颈CINⅠ病变组织,W12 URR序列P97启动子活性较弱[5],因此作为阴性对照组。根据GenBank报道的W12序列(GenBank accession no.AF125673)设计引物,递归式PCR扩增得到W12 URR片段。
1.6 HPV-16 URR基因筛选及构建重组质粒
测序后对HPV-16 URR序列进行分析,根据突变位点及频率筛选出具有代表性的突变株,将其构建至pMD18-T,同时将W12 URR片段构建至pMD18-T,重组质粒经Hind Ⅲ与KpnⅠ双酶切获得URR片段和W12 URR片段,与同样酶切的pGL3-basic载体在T4连接酶作用下于16 ℃过夜连接,连接产物转化至大肠杆菌DH5α菌株中,在含Amp+琼脂平板上挑选单菌落,增菌培养后以碱裂解法小量提取重组质粒,经Hind Ⅲ与KpnⅠ双酶切鉴定重组质粒,并对酶切鉴定正确的质粒进行DNA测序鉴定。
1.7 荧光素酶检测分析
Vero细胞铺入12孔板,细胞长至约80%时,pGL3-URR转染Vero细胞,pGL3-basic空载体作为空白对照,SiHa和Caski URR重组质粒为阳性对照,W12 URR重组质粒为阴性对照,每组6个复孔,转染48 h后收集细胞,检测荧光素酶的活性。
1.8 统计学处理
采用SPSS 19.0软件对数据进行处理。求每组平均值和方差,对实验组与对照组进行两组数据的成组t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 宫颈病样URR突变基因分析
以宫颈病样DNA为模板进行PCR扩增,共得到55个大小约为750 bp的URR片段,其中CIN来源的URR片段13个,宫颈癌来源的URR片段42个,测序后与公布的德国标准株URR序列(GI:333031)进行比对,发现44个位点发生突变,其中nt7192(G→T)、nt7433(-→T)、nt7435(C→G)和nt7863(A→-)4个位点的突变为所有序列共有,nt7520(G→A)位点的突变存在于54份样品中,这5个位点的突变在新疆地区趋于恒定;其余39个位点的突变在部分样品中存在,分析结果见表1。
2.2 筛选URR突变体并构建pGL3-URR重组质粒
根据上述URR序列突变的位置、频率和程度,筛选出9个URR突变体并克隆入pGL3-Basic载体,获得重组质粒pGL3-URR-CINⅠ、pGL3-URR-CINⅡ、pGL3-URR-CINⅢ、pGL3-URRCC1、pGL3-URR-CC2、pGL3-URR-CC3、pGL3-URR-CC4、pGL3-URR-CC5和pGL3-URR-CC6,筛选的9个URR片段突变情况见表2。上述重组质粒经KpnⅠ和Hind Ⅲ酶切产生约5 400 bp的质粒片段和约750 bp的URR片段,与预期结果相符,说明重组质粒pGL3-URR构建正确(图1)。

表1 宫颈癌和子宫上皮非典型增生组织中HPV-16 URR基因序列的变异Tab. 1 Variation of HPV-16 URR from cervical cancer and cervical intraepithelial neoplasia

表2 代表性URR突变体的变异Tab. 2 The variation of the typical URR mutants

图1 重组质粒pGL3-URR的酶切分析Fig. 1 Restriction endonuclease analysis of recombinant plasmid pGL3-URR
2.3 荧光素酶活性分析
将不同URR突变体的pGL3-basic/URR重组质粒转染到Vero细胞,荧光素酶检测结果表明,不同URR突变体启动子活性存在较大差异,来源于宫颈癌的URR突变体启动子活性显著高于来源于CIN的URR突变体(P<0.01)。CIN(CINⅠ、CIN Ⅱ、CIN Ⅲ)URR序列平均启动子活性是W12 URR启动子活性2.75倍,宫颈癌(CC1、CC2、CC3、CC4、CC5和CC6)URR序列平均启动子活性是W12 URR启动子活性12.62倍,其中CC2 URR启动子活性是W12 URR启动子活性的26倍,差异有统计学意义(P<0.01),是对照细胞SiHa和Caski URR启动子活性的1.26和 1.9倍,差异有统计学意义(P<0.01,图2)。
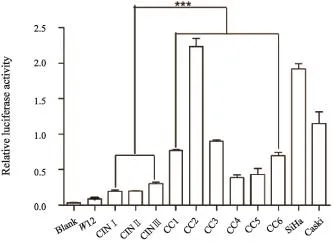
图2 CIN和CC中HPV-16 URR片段启动子活性Fig. 2 The promoters activity of HPV-16 URR fragments from CIN and CC
3 讨 论
HPV-16早期基因的表达由URR上的P97早期启动子启动,启动子的活性受病毒早期蛋白和转录因子等调控,URR的突变可增强或减弱URR内部启动子的活性。HPV-16 URR以两个E2蛋白结合位点为界分成3个区域:5’区、3’区和中央区。5’区包含晚期转录产物的转录终止位点、多聚腺苷酸化位点[6]和转录调控蛋白E2结合位点[7]。3’区包含病毒的Ori,该元件在病毒DNA的复制过程中发挥重要作用,Ori长度约100 bp,是一个相对保守的区域,含E1和E2蛋白结合位点,以及其他复制必需元件。E1蛋白和E2蛋白与Ori结合形成前起始复合物并起始病毒DNA的复制[8-9]。中央区为增强子区域,全长约400 bp,两端分别是E2蛋白的结合位点,包含了多种转录因子结合位点,如特异蛋白1(specificity protein 1,SP1)[10]、细胞核因子1(nuclaer factor-1,NF-1)[11]及阴阳因子1(yin-yang factor 1,YY1)等[12],这些转录因子通过与URR结合调节P97启动子的活性,从而影响致癌基因E6、E7的表达。
核酸杂交和HPV-16核苷酸序列分析表明,不同地区、不同种族及不同人群HPV-16阳性标本中的HPV-16核苷酸序列存在大量变异,且变异谱系分布有着明显的地域性[13-16]。前期研究表明新疆地区HPV-16的各基因均有突变,其中URR也发生多位点的突变,本研究扩大样本后对HPV-16 URR突变进行分析,结果表明,nt7192(G→T)、nt7433(-→T)、nt7435(C→G)和nt7863(A→-)4个位点的突变为所有URR序列共有,除了CIN Ⅲ样品外,nt7520(G→A)位点的突变存在于其他54份样品中。本研究发现的一些突变现已报道,7192位(C→T)和7729(A→C)在亚裔美洲型(AA)中普遍存在[4,17],nt7449(T→C)[4]、nt7843(A→G)[17]及nt7792(A→G)[18]的突变可显著提高URR启动子活性,其余的突变位点尚未见报道。
W12为来自人类宫颈CIN Ⅰ病变组织的永生化上皮细胞,W12 URR序列P97启动子活性较弱[10],SiHa和Caski均为整合了HPV-16基因组的宫颈癌细胞系,其URR启动子活性较高,可作为URR启动子活性研究的阳性对照[19]。有研究发现,来源于宫颈癌的URR突变体启动子活性显著高于来源于CIN的URR突变体,其中CC2的URR启动子活性明显高于SiHa、Caski和其他病样的URR启动子活性,该URR突变体除普遍存在的5个位点的突变外,还存在nt7820-7868间的48个碱基缺失,且缺失片段中包括E2蛋白结合位点E2BS2, nt7820-7868间一些碱基的突变能增强URR启动子活性[18-21]。本研究中CC2的URR启动子活性是W12 URR启动子活性的26倍,推测nt7820-7868间的48个碱基的缺失也会增强URR启动子活性。
CC1、CC3和CC5样品除普遍存在的5个位点的突变外,还存在nt7841(G→A)位点的突变,Dong等[21-22]报道,HPV-16 URR序列中YY1蛋白结合位点(nt7840-nt7848)和SP1结合位点(nt7842-nt7847)重叠,SP1与YY1竞争性结合该位点,本研究中CC1、CC3和CC5样品URR启动子活性较W12 URR启动子活性提高了7、12和8倍,推测与nt7841(G→A)突变有关,该位点的突变可能改变了YY1、SP1转录因子的结合位点,从而使得URR启动子活性提高。有研究报道,位于3’-URR末端的nt7660-nt7890片段的突变是使亚裔美洲型(AA)URR序列启动子活性增强的主要原因[21]。本研究发现,所有URR序列在nt7660-nt7890位点都存在突变,如nt7729(A→C)、nt7841(G→A)和nt7863(A→-)等,且宫颈癌URR序列的突变位点多于CIN URR序列。
本研究中除了CINⅢ样品外,nt7520(G→A)位点的突变存在于其他54份样品中,该位点的突变在亚裔美洲型(AA)中普遍存在,其启动子活性较W12 URR启动子活性提高了3.3倍[23-24],Schmidt等[25]也发现,该位点的突变改变了YY1、SP1和AP-1等转录因子的结合位点,从而增强了HPV-16的致癌活性。另有一些突变位点已被证实可增强URR启动子活性,如nt7792(C→T)位的YY1结合位点突变可显著提高启动子的转录活性[18]。此外,还有一些转录因子结合位点的突变尚未见报道,如nt7729(A→C)和nt7826(T→C),据文献报道,这两个位点分别位于NF-1和1-Oct结合位点[19],其突变也可能影响URR启动子活性。
上述结果表明,新疆妇女宫颈病变组织中分离的URR存在多个位点突变,其中一些突变增强了URR内部启动子活性,从而可能促进病毒致癌基因的复制,并最终促进其致癌活性。
[1] 马正海, 钱 东, 马 纪, 等. 中国新疆维吾尔族妇女宫颈癌组织中乳头状瘤病毒16型E6基因的克隆和序列分析[J]. 生物化学与生物物理进展, 2001, 28(3): 400-404.
[2] 马正海, 张富春, 梅新娣, 等. 新疆南部地区维吾尔族妇女宫颈癌组织中人乳头状瘤病毒16型L1基因突变谱分析[J]. 中华医学杂志, 2004, 84(12): 987-991.
[3] 马正海, 梅新娣, 张富春. 新疆南部地区维吾尔族妇女宫颈癌组织中HPV-16型L2基因多态性突变谱分析[J]. 中华微生物学和免疫学杂志, 2004, 24(12): 968-972.
[4] 余 猛, 马正海, 王艳萍, 等. 新疆维吾尔族妇女宫颈癌组织中人乳头状瘤16型上游调控区DNA多态性分析[J].中华微生物学和免疫学杂志, 2006, 26(11): 1000-1004.
[5] SCARPINI C G, GROVES I J, PETT M R, et al. Virus transcript levels and cell growth rates after naturally occurring HPV-16 integration events in basal cervical keratinocytes[J]. J Pathol, 2014, 233(3): 281-293.
[6] ARANY I, GRATTENDICK K G, TYRING S K. Interleukin-10 induces transcription of the early promoter of human papillomavirus type 16 (HPV-16) through the 5’-segment of the upstream regulatory region (URR)[J]. Antiviral Res, 2002, 55(2): 331-340.
[7] GENTHER S M, STERLING S, DUENSING S, et al. Quantitative role of the human papillomavirus type 16 E5 gene during the productive stage of the viral life cycle[J]. J Virol, 2003, 77(5): 2832-2842.
[8] CARSON A, KHAN S A. Characterization of transcription factor binding to human papillomavirus type 16 DNA during cellular differentiation [J]. J Virol, 2006, 80(9): 4356-4362.
[9] SIDDIPA A, LEON K C, JAMES C D, et al. The human papillomavirus type 16 L1 protein directly interacts with E2 and enhances E2-dependent replicationand transcription activation[J]. J Gen Virol, 2015, 96(8): 2274-2285.
[10] SHIRATSUCHI I, AKAGI Y, KAWAHARA A, et al. Expression of IGF-1 and IGF-1R and their relation to clinicopathological factors in colorectal cancer[J]. Anticancer Res, 2011, 31(7): 2541-2545.
[11] LUCIANA B F, CHEN Z G , ELAINE F M, et al. Human papillomavirus 16 non-european variants are pereferentially associated with high-grade cervical lesions[J]. PLoS One, 2014, 9(7): e100746.
[12] LACE M J, ISACSON C, ANSON J R, et al. Upstream regulatory region alterations found in human papillomavirus type16 (HPV-16) isolates from cervical carcinomas increase transcription, ori function, and HPV immortalization capacity in culture [J]. J Virol, 2009, 83(15): 7457-7466.
[13] XI L F, KOUTSKY L A, HILDESHEIM A, et al. Risk for high-grade cervical intraepithelial neoplasia associated with variants of human papillomavirus types 16 and 18[J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(1): 4-10.
[14] PIENTONG C, WONGWARISSARA P, EKALAKSANANAN T, et al. Association of human papillomavirus type 16 long control region mutation and cervical cancer[J]. Virol J, 2013, 10(1): 491-500.
[15] KAHLA S, KOCHBATI L, HAMMAMI S, et al. Sequence variation in the E2-binding domain of HPV-16 and biological function evaluation in Tunisian cervical cancers[J]. Biomed Res Int, 2013, 2014(6): 751-759.
[16] XI L F, KIVAT N B, HILDESHEIM A, et al. Human papillomavirus type 16 and 18 variants: race-related distribution and persistence [J]. J Natl Cancer Inst, 2006, 98(15): 1045-1052.
[17] KAMMER C, WARTHORST U, TORREZ M N, et al. Sequence analysis of the long control region of human papillomavirus type 16 variants and functional consequences for P97 promoter activity[J]. J Gen Virol, 2000, 81(8):1975-1981.
[18] WATTS K J, THOMPSON C H, COSSART Y E, et al. Variable oncogene promoter activity of human papillomavirus type 16 cervical cancer isolates from Australia[J]. J Clin Microbiol, 2001, 39(5): 2009-2014.
[19] DIPANJANA M, RATNESH K S, SRABONI M, et al. Genetic and epigenetic changes of HPV-16 in cervical cancer differentially regulate E6/E7 expression and associate with disease progression[J]. Gynecol Oncol, 2011, 123(3): 597-604.
[20] SUN Z R, LU Z T, LIU J H, et al. Genetic variations of E6 and long control region of human papillomavirus type 16 from patients with cervical lesion in Liaoning China[J]. BMC Cancer, 2013, 13(41): 4989-4994.
[21] DONG X P, PFISTER H. Overlapping YY1- and aberrant SP1-binding sites proximal to the early promoter of human papillomavirus type 16[J]. J Gen Virol, 1999, 80(8): 2097-2101.
[22] LACE M J, YAMAKAWA Y, USHIKAI M, et al. Cellular factor YY1 downregulates the human papillomavirus 16 E6/ E7 promoter, P97, in vivo and in vitro from a negative element overlapping the transcription-initiation site[J]. J Gen Virol, 2009, 90(10): 2402-2012.
[23] PICCONI M A, ALONIO L V, SICHERO L, et al. Human papillomavirus type-16 variants in Quechua aboriginals from Argentina[J]. J Med Virol, 2003, 69(4): 546-552.
[24] LUIGI M, ANNA G, JOHN V, et al. Human papillomavirus type 16 long control region and E6 variants stratified by cervical disease stage[J]. Infect Genet Evol, 2014, 26(100):8-13.
[25] SCHMIDT M, KEDZIA W, GOZDZICKA J A. Intratype HPV-16 sequence variation within LCR of isolates from asymptomatic carriers and cervical cancers[J]. J Clin Virol, 2001, 23(1-2): 65-77.
The ef f ect of mutations in the upstream regulatory region of HPV-16 on the activity of virus early promoter
SONG Dan1, SHI Qian1, HOU Xiangqian1, MAYINEUR·Niyazi2, MA Zhenghai1(1. College of
Life Science and Technology, Xinjiang University, Urumqi 830046, Xinjiang Uyghur Autonomous Region, China; 2. Gynecology and obstetrics Xinjiang Uyghur Autonomous Region People’s Hospital, Urumqi 830001, Xinjiang Uygur Autonomous Region, China)
Background and purpose: The incidence of cervical cancer is rather high in Xinjiang, which is closely associated with the infection of human papilloma virus type 16 (HPV-16). The purpose of this study was to analyze the variants and function of HPV-16 upstream regulatory region (URR) in the tissues of cervical cancer biopsies from Xinjiang. Methods: The DNAs were extracted from the tissues of cervical epithelial atypical hyperplasia (CIN) and cervical cancer biopsies. HPV-16 URR segments were amplif i ed by PCR. Based on the sequence analysis of the URR, the representative URR variants were selected and cloned into pGL3-Basic. The recombinant plasmids were transfected into Vero cell lines respetively. Luciferase activity of transfected cells was detected 48 h after transfection. Results: Fifty-f i ve HPV-16 URR DNA fragments were obtained through PCR, and 44 mutations were found from the URR fragments. 4 of these mutations, including nt7192(G→T) , nt7433(- →T), nt7435 (C→G) and nt7863 (A→-) occurred in all sequences. The mutation at nt7520 (G→A) occurred in 54 URR sequences, and the 39 other mutations were present in dif f erent samples. Based on the location and frequency of the mutations in the URR fragments, 9 URRvariants were selected and cloned into pGL3-Basic. Then the luciferase activity of the cells transfected with pGL3-URR plasmids was detected respectively. Promoter activity of URR mutants from cervical cancer are significantly higher than that of URR mutants from CIN (P<0.01). Promoter activity of URR fragments from some cervical cancer was signif i cantly higher than that of the URR fragments from SiHa and Caski cells. Conclusion: Multiple mutations occurred in HPV-16 URR of cervical cancer patients from Xinjiang. The promoter activity and carcinogenicity of some URR mutants have been enhanced.
Human papillomavirus type 16; Upstream regulatory region; Mutation; Promoter
MA Zhenghai E-mail: mzhxju@126.com
10.19401/j.cnki.1007-3639.2017.02.005
R737.33
A
1007-3639(2017)02-0109-06
2016-03-15
2016-09-10)
国家自然科学基金项目(31060025)。
马正海 E-mail:mzhxju@126.com
