外周血中炎症指标(中性粒细胞与淋巴细胞比值、血小板与淋巴细胞比值以及淋巴细胞与单核细胞比值)评估中晚期非小细胞肺癌预后的价值
2017-03-27魏海波孙雅丽张明晖马艳青杨春洁
魏海波 孙雅丽 张明晖 杨 艳 马艳青 赵 妍 杨春洁
(内蒙古医科大学赤峰临床医院肿瘤内科,内蒙古 赤峰 024000)
外周血中炎症指标(中性粒细胞与淋巴细胞比值、血小板与淋巴细胞比值以及淋巴细胞与单核细胞比值)评估中晚期非小细胞肺癌预后的价值
魏海波 孙雅丽 张明晖 杨 艳 马艳青 赵 妍 杨春洁
(内蒙古医科大学赤峰临床医院肿瘤内科,内蒙古 赤峰 024000)
目的 探讨中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)以及淋巴细胞与单核细胞比值LMR与中晚期非小细胞肺癌患者预后的关系。方法 收集79例非小细胞肺癌患者的资料,利用Kaplan-Meier法计算生存率,Log rank检验比较不同组间的差异。采用Cox回归分析预后因素。结果 低NLR组1、3年生存率为79.5%和18.2%,高NLR组为68.6%和2.9%,差异有统计学意义(P<0.05);低PLR组1、3年生存率为75.6%和20%,高PLR组61.8%和2.9%,差异有统计学意义(P<0.05);低LMR组1、3年生存率分别为64.9%和2.7%,高LMR组73.8%和14.3%,无显著性差异(P<0.05)。单因素分析结果显示,肿瘤组织呈低分化、区域淋巴结转移、远处转移、NLR>3.16、PLR>197、LMR<3.6是影响肺癌患者生存情况的危险因素(P<0.05)。多因素回归分析显示,肿瘤低分化、远处转移、NLR>3.16、PLR>197是影响预后的独立因素(P<0.05)。结论 NLR及PLR为影响肺癌预后的独立因素。
非小细胞肺癌;中性粒细胞与淋巴细胞比值;血小板与淋巴细胞比值;淋巴细胞与单核细胞比值;预后
非小细胞肺癌(NSCLC)约占全部肺癌的80%,约70%的患者在诊断时已处于局部晚期或有远处转移,丧失了根治性手术机会,总体5年生存率不超过15%。现有研究已证实某些全身炎症指标可综合反映多种恶性肿瘤患者体内炎症和免疫状态[1-2],外周血炎性指标对恶性肿瘤预后的预测价值为目前的热点研究议题。外周血中评价全身系统性炎性反应(systemic inflammatory response,SIR)的指标包括格拉斯哥预后评分(glasgow prognostic score,GSP)、CPR、中性粒细胞与淋巴细胞比值(neutrophil-o-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、淋巴细胞与单核细胞比值(lymphocyte-to-monocyte ratio,LMR)等,其中GPS评分、CRP的预后价值最为明确[3],研究也较为成熟,而中晚期非小细胞肺癌中NLR、PLR、LMR是否同样具有预后价值目前仍存在争议,本研究旨在分析NLR、PLR及LMR对中晚期非小细胞肺癌患者预后中的预测作用。
1 资料与方法
1.1 临床资料:选取2009年1月至2012年1月于赤峰市医院确诊的晚期非小细胞肺癌患者,入选标准:病理学及细胞学证实的NSCLC患者,并依据美国癌症联合委员会(AJCC)第7版肺癌分期标准进行分期;ⅢB-Ⅳ期NSCLC,包括未适合手术的ⅢA期患者;至少完成2个疗程化疗;美国东部肿瘤协作组(ECOG)评分<2分;排除标准:SCLC或非原发的NSCLC患者;1个月内有外科手术、放射治疗、肺栓塞、急性心梗、脑血管意外患者;靶向治疗或单药化疗患者;临床资料不全患者。共纳入患者79例,年龄34~77岁,男41例,女38例,腺癌53例,鳞癌24例,大细胞癌两例,Ⅲ期34,Ⅳ期45例。
1.2 信息采集:通过病案管理系统收集患者资料,包括性别、年龄、病理类型、发病部位、组织分化程度、影像学信息、肿瘤大小、淋巴结转移、远处转移。收集患者首次化疗前两周内血常规指标,包括中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数,计算NLR、PLR及LMR。
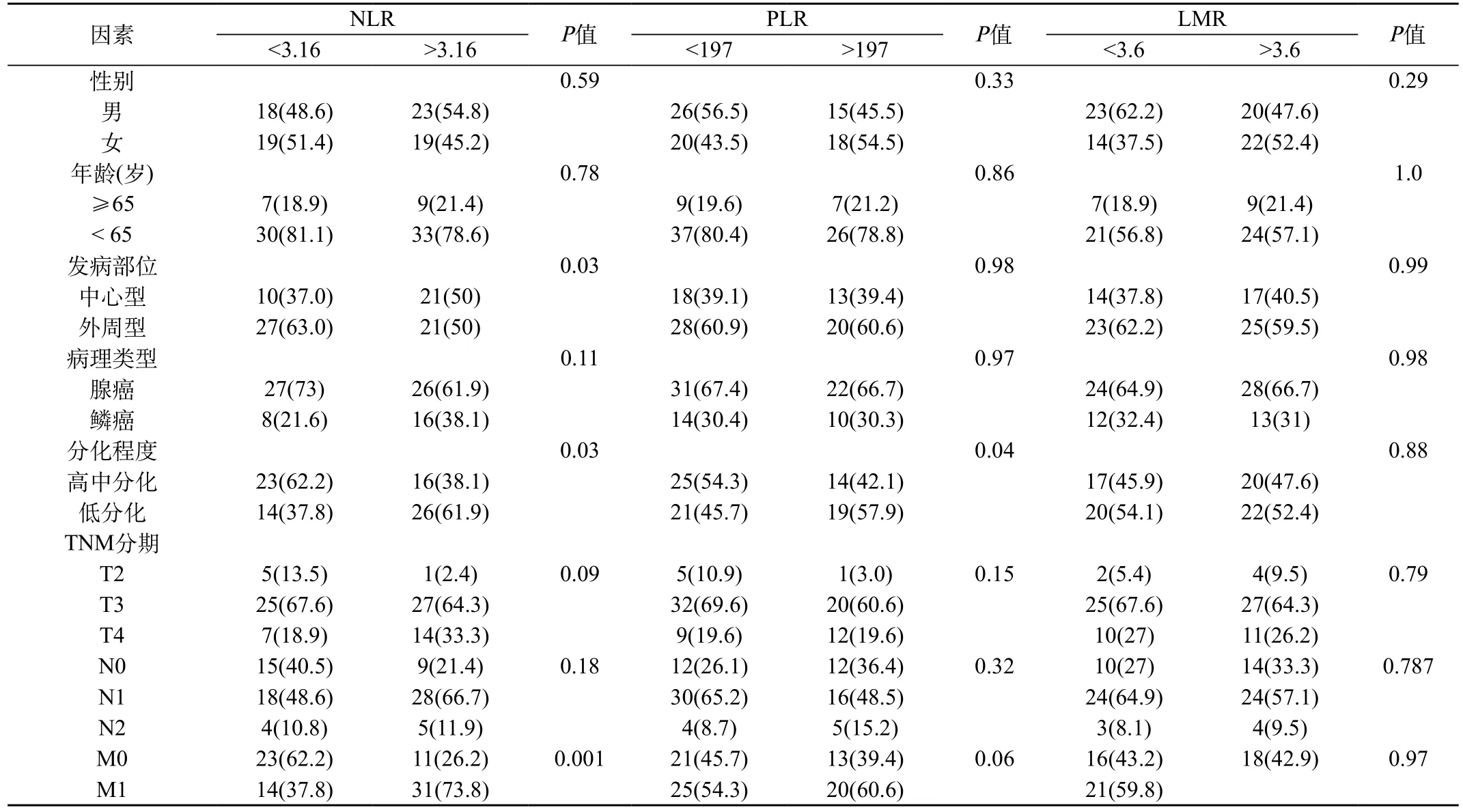
表1 不同NLR、PLR、LMR分层的临床病理特征[n(%)]
1.3 随访:利用病案记录,以首次治疗作为观察起点,对治疗后出院的患者采用电话、通信等方式每3个月随访1次,末次随访日期为2015年1月1日。生存时间为入院日期至死亡日期或者至随访结束。
1.4 统计学方法:采用SPSS 17.0软件进行统计分析。NLR、LMR及PLR与患者临床病理资料(性别、年龄、发病部位、病理类型、分化程度、肿瘤分期)的关系采用χ2检验。采用Kaplan-Meier法计算生存率,不同分组患者生存率的比较采用Log rank检验。采用多因素Cox模型分析预后的独立影响因素。检验水准为α=0.05,P<0.05具有统计学差异。
2 结 果
2.1 中晚期非小细胞肺癌患者NLR、PLR及LMR与临床病理因素的关系:本组研究以NLR、PLR及LMR中位数作为截点,通过SPSS17.0软件对全组患者进行描述性分析,统计得出NLR的均值为3.16,PLR的均值为197,LMR均值为3.6。将NLR≥3.16定义为NLR升高,将PLR≥197定义为PLR升高,LMR均值≥3.6定义为LMR升高。对不同NLR组、PLR组和LMR组患者的性别、年龄、发病部位、病理类型、组织分化程度、T、N、M分期进行比较,结果显示,高NLR组和低NLR组患者在肿瘤发病部位(P=0.031)、组织分化程度(P=0.033)、远处转移状况(P=0.001)的差异有统计学意义;高PLR组和低PLR组患者在组织分化程度(P=0.043)的差异有统计学意义;而LMR在各组临床病理因素中均无显著性差异。见表1。
2.2 外周血NLR、PLR及LMR组中NSCLC患者的生存情况:NLR预测NSCLC患者预后的价值,低NLR组1、3年生存率分别为79.5%和18.2%,高NLR组分别为68.6%和2.9%,差异有统计学意义(P<0.001);PLR预测NSCLC患者预后的价值,低PLR组1、3年生存率分别为75.6%和20%,高PLR组分别为61.8%和2.9%,差异有统计学意义(P=0.007);LMR预测NSCLC患者预后的价值,低LMR组1、3年生存率分别为64.9%和2.7%,高LMR组分别为73.8%和14.3%,无显著性差异(P=0.06)。
2.3 影响NSCLC患者预后的因素:单因素分析结果显示,肿瘤组织呈低分化、区域淋巴结转移、远处转移、NLR>3.16、PLR>197是影响肺癌患者生存情况的危险因素(P<0.05,表2)。对影响肺癌患者预后的变量进行Cox多因素回归分析,结果显示,肿瘤组织呈低分化、远处转移、NLR>3.16、PLR>197是影响中晚期非小细胞肺癌患者预后的独立因素(均P<0.05,表3)。
3 讨 论
1863年Virchow首次提出了肿瘤可能是由慢性炎症引起的假设,目前慢性炎症可以增加罹患肿瘤的危险性的理论已被普遍接受。肿瘤免疫编辑学说(cancer immunoediting)指出炎性反应的各个阶段均有助于肿瘤的产生[4-6],同时肿瘤的发生及发展又可促进血液中的炎性细胞数目发生相应改变。炎症可促进中性粒细胞迁移到肿瘤细胞周围,释放诱导细胞DNA损伤的活性氧,为肿瘤创造适宜的微环境[7]。中性粒细胞促进肿瘤血管内皮生长因子(VEGF)的产生[8],加快远处转移进程。淋巴细胞可分化为肿瘤微环境中的肿瘤浸润淋巴细胞(TILs),参与机体适应性的免疫应答[9],抑制体内的恶性增殖细胞;单核细胞可以分化为肿瘤微环境中的巨噬细胞,有试验表明巨噬细胞促进肿瘤组织中血管的生成,加速肿瘤的迁移及转移[10-12]。血小板的激活可促进肿瘤血管生成、细胞外基质降解、释放黏附分子和生长因子,促进肿瘤的生长和转移[13-16]。
有学者提出外周血炎症指标与结直肠癌[17]、膀胱癌[18]、胃癌[19]、卵巢癌[20]、乳腺癌[21]、甲状腺[22]等多种恶性肿瘤的预后存在关联,在本研究中NLR、PLR、远处转移及肿瘤低分化病理分型可作为预测中晚期非小细胞肺癌的预后的分子标志物,而LMR不能作为进展期非小细胞肺癌独立的预后指标。
本试验联合检测外周血NLR、PLR、LMR对于中晚期非小细胞肺癌预后的预测价值,取材方便,简便经济,可重复检验,有利于我们更加精确的对恶性肿瘤的生物学特性及预后进行评价,可指导临床工作者中进一步优化治疗策略,本研究尚存在一定的局限性,样本量相对少,样本选择可能存在一定选择偏倚,因此需要多中心、前瞻性的大样本研究来阐明。
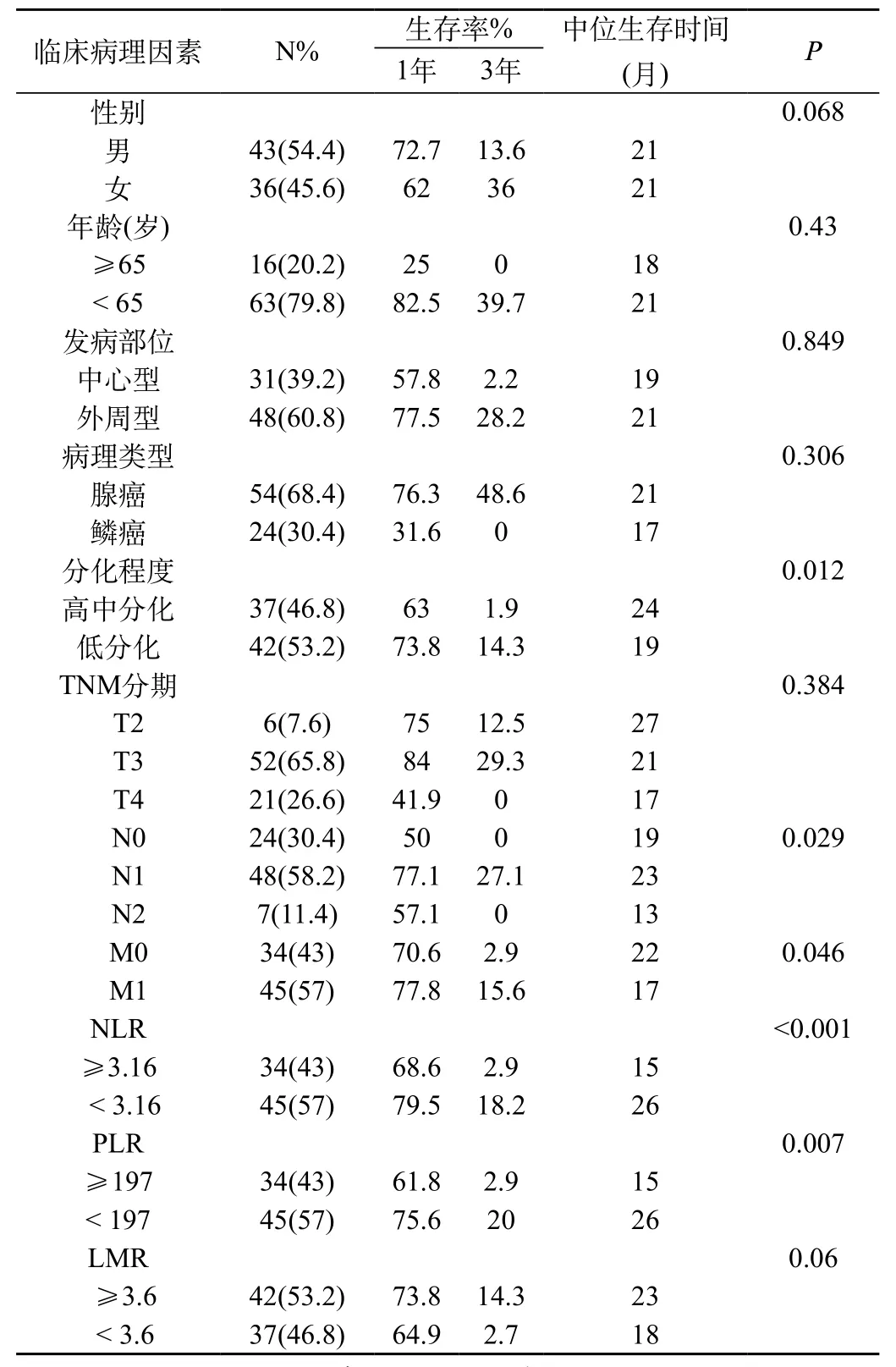
表2 影响本组患者预后的单因素分析结果

表3 影响患者预后的多因素COX回归分析
[1] Kumar R,Geuna E,Michalarea V,et al.The neutrophil-lymphocyte ratio and its utilisation for the management of cancer patients in early clinical trials[J].Br J Cancer 2015,112(7):1157-1165.
[2] Roxburgh CS,McMillan DC.Role of systemic inflammatory response in predicting survival in patients with primary operable cancer[J].Future Oncol 2010,6(1):149-163.
[3] Proctor MJ,Morrison DS,Talwar D,et al.A comparison of inflammation-based prognostic scores in patients with cancer.A Glasgow Inflammation Outcome Study[J].Eur J Cancer,2011,47(17):2633-2641.
[4] Bui JD,Schreiber RD.Cancer immunosurveillance,immuno editing and inflammation:independent and interdependent processes[J].Curr Opin Immunol,2007,19(2):203-208.
[5] Coussens LM,Werb Z.Inf l ammation and cancer[J].Nature,2002,4 20(6917):860-867.
[6] Balkwill F,Mantovani A.Inflammation and cancer:back to Virchow[J].Lancet,2001,357(9255):539-545.
[7] Shacter E1,Weitzman SA.Chronic Inf l ammation and Cancer [J]. Oncology,2002, ; 16(2) :217-2326229.
[8] Kusumanto YH,Dam WA,Hospers GA,et al.Platelets and granulocytes,in particular the neutrophils,form important compartments for circulating vascular endothelial growth factor[J].Anticancer Res,2004,24(6):4237-4241.
[9] Colotta F,Allavena P,Sica A,et al.Cancer related inflammation,the seventh hallmark of cancer: links to genetic instability [J].Carcinogenesis,2009,30(7):1073–1081.
[10] Lin EY,Gouon Evans V,Nguyen AV,et al.The macrophage growth factor,CSF 1,in mammary gland development and tumor progression[J].J Mammary Gland Biol Neoplasia,2002,7(2):147–162.
[11] Lin EY,Li JF,Gnatovskiy L,et al.Macrophages regulate the angiogenic switch in a mouse model of breast cancer[J].Cancer Res,2006,66(23):11238–11246.
[12] Lee Y,Kim SH,Han JY,et al.Early neutrophil to lym phocyte ratio reduction as a surrogate marker of prognosis in never smokers with advanced lung adenocarcinoma receiving gef i tinib or standard chemotherapy as fi rst line therapy[J].J Cancer Res Clin Oncol,2012,138(12): 2009–2016.
[13] Kono SA,Heasley LE,Doebele RC,et al.Adding to the mix: fibroblast growth factor and platelet - derived growth factor receptor pathways as targets in non - small cell lung cancer[J]. Curr Cancer Drug Targets,2012,12(2):107 -123.
[14] Egan K,Crowley D,Smyth P,et al.Platelet adhesion and degranulation induce pro - survival and pro-angiogenic signalling in ovarian cancer cells[J].PLoS One,2011,6(10):e26125.
[15] Shao B,Wahrenbrock MG,Yao L,et al.Carcinoma mucins trigger reciprocal activation of platelets and neutrophils in a murine model of Trousseau syndrome[J].Blood,2011,118(15):4015-4023.
[16] 闻永,黄祖斌 .肿瘤标志物联合检测在肺癌诊断中的临床应用[J].实用心脑肺血管病杂志,2012,20(1):42-44.
[17] 李坚,贾英斌,蔡潮农,等.中性/淋巴细胞比例动态变化对结肠癌术后及化疗后患者无复发生存的预测价值[J].中华胃肠外科杂志,2012,15(11):1171-1174.
[18] Lee SM,Russell A,Hellawell G.Predictive value of pretreatment inflammationbased prognostic scores (neutrophil-tolymphocyte ratio,platelet-to-lymphocyte ratio,and lymphocyte-to-monocyte ratio) for invasive bladder carcinoma[J].Korean J Urol,2015,56(11):749-755.
[19] 李书梅,徐小莉,梁迪,等.外周血中性粒细胞与淋巴细胞比值以及血小板与淋巴细胞比值评估胃癌患者预后的价值[J].中华肿瘤杂志,2014,36(12):910-915.
[20] 张文琪,郝权.术前外周血NLR对上皮性卵巢癌患者预后的影响[J].中国肿瘤临床,2014,41(10):634-638.
[21] 王腾,常树建,沈娣,等.血常规参数对乳腺癌预后的判断价值[J/CD].中华临床医师杂志: 电子版,2012,6(17):5100-5104.
[22] 宋杨梅,樊勇,艾比拜•玉素甫,等.甲状腺癌术前中性粒细胞与淋巴细胞比值和血小板与淋巴细胞比值与临床病理特征及预后关系研究[J].中国全科医学,2015,18(15):1748-1852.
Prognostic Value of Blood Neutrophil-to-lymphocyte Ratio(NLR), Platelet-to-lymphocyte Ratio (PLR), Lymphocyte-tomonocyteratio(LMR)in Patients with Advanced NSCLC
WEI Hai-bo, SUN Ya-li, ZHANG Ming-hui, YANG Yan, MA Yan-qing, ZHAO Yan, YANG Chun-jie
(Departent of Integrative Oncology, Inner Mongolia Medical University Chifeng Clinical Hospital, Chifeng Municipal Hospital, Chifeng 024000, China)
ObjectiveTo evaluate the impact value of preoperative neutrophil-lymphocyte ratio(NLR) , platelet-to-lymphocyte ratio (PLR), lymphocyte-tomonocyte ratio(LMR)for the prognosis of non small lung cancer patients.MethodsThe clinical data of 79 patients with advanced NSCLC were analyzed retrospectively. According to NLR, PLR and LMR, the patients were divided into high group and low group. Caner-specific survival was assessed using the Kaplan-Meier method. The survival rates and the clinic pathological factors in the two groups were analyzed using univariate analysis and COX regression model.ResultsRespectively. In the low NLR group, the 1-, 3-year survival rate was 79.5%, 18.2%, while those of the high NLR group was 68.6%, 2.9%, respectively; In the low PLR group, the 1-, 3-year survival rate was 79.5%, 18.2%, while those of the high PLR group was 68.6%, 2.9%, all showing significant difference (P<0.05).without statistic significance between the high LMR and low group (P>0.05). Univariate analysis showed that the survival rate was significantly correlated with histological differentiation, N stage, M stage, NLR, PLR, LMR(P<0.05). Multivariate analysis showed that histological differentiation, N stage, NLR, PLR(P<0.05) were independent risk factors for the prognosis(P<0.05).ConclusionNLR and PLR can be a clinically significant factor for the assessment of prognosis of Pancreatic Cancer.
Non small cell lung cancer; Neutrophil-lymphocyte ratio; platelet-to-lymphocyte ratio; lymphocyte-to-monocyte ratio; Prognosis
R734.2
B
1671-8194(2017)06-0006-03
