中华鲟野生群体及迁地群体的MHCⅠa基因遗传多样性变异研究
2017-03-27肖衎杜合军赵珣刘雪清刘娟娟
肖衎+杜合军+赵珣+刘雪清+刘娟娟

摘要:利用特异性引物MHCⅠf和MHCⅠr,分别从30尾野生中华鲟(Acipenser sinensis)、30尾中华鲟子一代和30尾中华鲟子二代的基因组DNA中扩增MHCⅠa基因的多肽结合位点(PBR)片段,扩增产物长度为127 bp。中华鲟野生群体30个样品265个有效克隆中共检测出50条特异序列(单倍型),中华鲟子一代群体30个样品的278个有效克隆中共检测出66条特异序列(单倍型),中华鲟子二代群体30个样品的257个克隆中检测出64条特异序列(单倍型)。单倍型Acsi-UAB*0101在3个群体中所占的百分比最高,分别为58.1%、38.8%和60.7%。单倍型分布及群体内遗传多样性参数分析表明,中华鲟子一代群体的MHC基因遗传多样性最丰富,野生中华鲟群体的MHCⅠa基因遗传多样性较低。中华鲟野生群体非同义替代与同义替代比率为1.33,分析表明正向选择可能是中华鲟MHCⅠa多态性的主要因素。该研究结果提供了中华鲟从野生群体到子二代群体MHCⅠa基因的部分遗传信息和遗传变异规律,为中华鲟全人工种群优化和繁殖管理提供理论依据。
关键词:中华鲟(Acipenser sinensis);主要组织相容性复合体(MHC);遗传多样性;遗传管理
中图分类号:S965.215;Q75 文献标识码:A 文章编号:0439-8114(2017)02-0306-08
中華鲟(Acipenser sinensis)是中国特有的古老大型海河洄游性鱼类,目前已处于极度濒危状态。建立人工迁地种群是避免该物种在近期灭绝的一种方式,而人工群体往往面临家养化问题。主要组织相容性复合体(Major Histocompatibility Complex,MHC)是脊椎动物中与病原识别及防御、亲缘识别和婚配等适应性遗传密切相关的基因。MHC基因包括两个典型的亚类和非典型的基因类,即典型的Ⅰ类基因、Ⅱ 类基因和补体类细胞因子等Ⅲ类基因,Ⅰ类基因与识别和递承内源性抗原相关,主要识别病毒类抗原。MHC基因已成为近年来研究的热点基因,广泛用于疾病相关性、分子生态和进化、保护遗传、繁殖行为等研究领域[1-7]。
MHC Ⅰ类与MHC Ⅱ类基因家族中抗原结合区域(Peptide binding region,PBR)是其变异最高的区域。在种群遗传多样性研究中,通常采用检测PBR水平来评价群体的MHC遗传多态性水平。近年来,MHC基因多态性与鱼类抗病相关性也已有较多报道。截至目前,国内关于MHC基因多态性和不同的等位基因与鱼类的抗病力相关性研究主要集中在牙鲆[8-11]。Jia等[12]对德国镜鲤MHC Ⅰ、Ⅱ基因多态性也进行了研究。李雪松等[13]和赵雪锦等[14]对“全红”和“粉玉”体色瓯江彩鲤MHC基因多态性与抗病性的关系进行了初步研究。国外对此方面的研究则主要集中在少数几种鲑科鱼类:如虹鳟、大西洋鲑[15-20]。对于鲟形目鱼类,目前仅一篇报道有关中华鲟和匙吻鲟的MHC Ⅰ基因进化研究[21],在GenBank中有大西洋鲟(Acipenser oxyrinchus)和欧洲大西洋鲟(Acipenser sturio)的两条MHC Ⅱ基因序列(GenBank序列号分别为AJ515709.1、AJ515708.1)以及西伯利亚鲟(Acipenser baerii)MHC Ⅱ 3条基因序列(JO288773.1、JO288774.1、JO288775.1),对中华鲟MHC基因遗传多样性相关的研究还未见报道。
本研究拟在MHC Ⅰa PBR座位上对野生中华鲟及蓄养在中国长江三峡集团公司中华鲟研究所人工繁殖的中华鲟子一代种群和子二代种群为研究对象,通过分离和筛选中华鲟MHC Ⅰa基因座位,对野生群体及人工繁殖的中华鲟子一代和子二代3个不同种群的MHC Ⅰa遗传变异水平和遗传结构及野生种群与人工繁殖种群的遗传变异差异进行了分析,为中华鲟全人工种群优化和繁殖管理提供科学的依据。
1 材料与方法
1.1 试验材料
试验鱼来自中国长江三峡集团公司中华鲟研究所,16龄以上的中华鲟子一代30尾,亲本来源为1980~2000年的野生中华鲟;2009、2010和2011年从葛洲坝采集到的野生中华鲟鱼卵孵化的苗种各10尾,共计30尾;2011、2012、2013年中华鲟研究所全人工繁殖的子二代中华鲟幼苗各10尾,共计30尾。分别采集少量鳍条,用无水乙醇固定。
1.2 引物设计
根据Wang等[21]报道的中华鲟MHC Ⅰa基因cDNA序列,利用Primer6.0设计中华鲟MHC Ⅰa基因PBR区特异引物:MHCⅠf(5′-TTTGAGTCCCTTGAGGCG-3′)和MHC Ⅰr(5′-TACAGACGAGCCGTGGAA-3′),目的片段大小为127 bp,由生工生物工程(上海)股份有限公司合成。
1.3 DNA提取和PCR扩增
将无水乙醇固定保存的鳍条样品剪碎,于70 ℃烘干使乙醇完全挥发。Qiagen基因组DNA提取试剂盒依据其说明书进行基因组DNA提取。1.0% Agarose凝胶电泳检测后,并检测其浓度和纯度,然后将DNA浓度调整至200 ng/μL,-20 ℃保存备用。
PCR反应总体积为50 μL,正、反引物各0.4 μmol/L,模板DNA为40 ng。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸7 min。
1.4 PCR产物的克隆与测序
50 μL的PCR产物经1%的琼脂糖凝胶电泳,切下目的片段,用Omega Gel Extraction Kit回收试剂盒进行回收。将回收产物按约3∶1的比例与pMD19-T(TakaRa)载体进行连接,然后将连接产物5 μL用于转化Ecoli DH5α感受态细胞。根据蓝白斑原理,筛选白色菌斑,接种至3 mL液体培养基过夜培养,用M13+/-引物菌液PCR检测,鉴定含插入片段的菌株。菌液送至上海英骏生物工程有限公司采用自动测序仪进行双向测序。
1.5 序列分析
获得的序列通过NCBI中BLAST同源检索,确认是否为目的片段。用Clustal w进行多序列比较,利用MEGA 7.0软件分析DNA序列和氨基酸序列的变异位点,并辅以人工校对。利用DNasp 5.1进行基因多态性分析和选择压力分析, 利用MEGA 7.0软件采用kimura双参数模型构建邻接(Neighbor joining,NJ)系统发育树。
2 结果与分析
2.1 PCR序列扩增
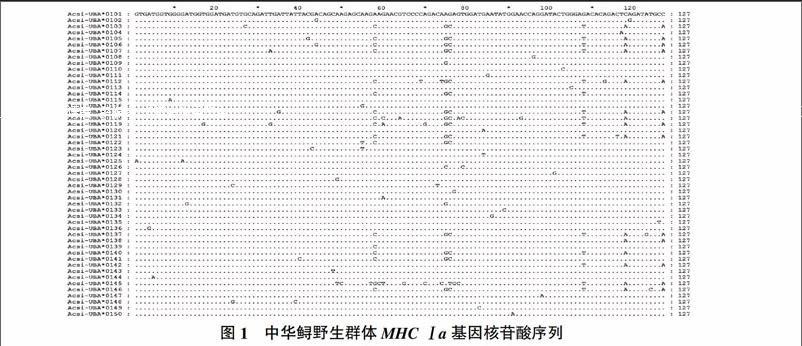
对90尾中华鲟的900个有效克隆进行了测序和分析,经过在GenBank中Blast保守区结构域(Conserved domains)比对后发现扩增得到的序列位于中华鲟MHC Ⅰ基因α1-2结构域内,确认其为中华鲟MHC Ⅰa基因PBR区内的片段。序列经对位排列和变异检测后,没有发现任何插入、缺失或异常的密码子。该核苷酸序列长度为127 bp,编码42个氨基酸。
2.2 MHC Ⅰa单倍型分离情况
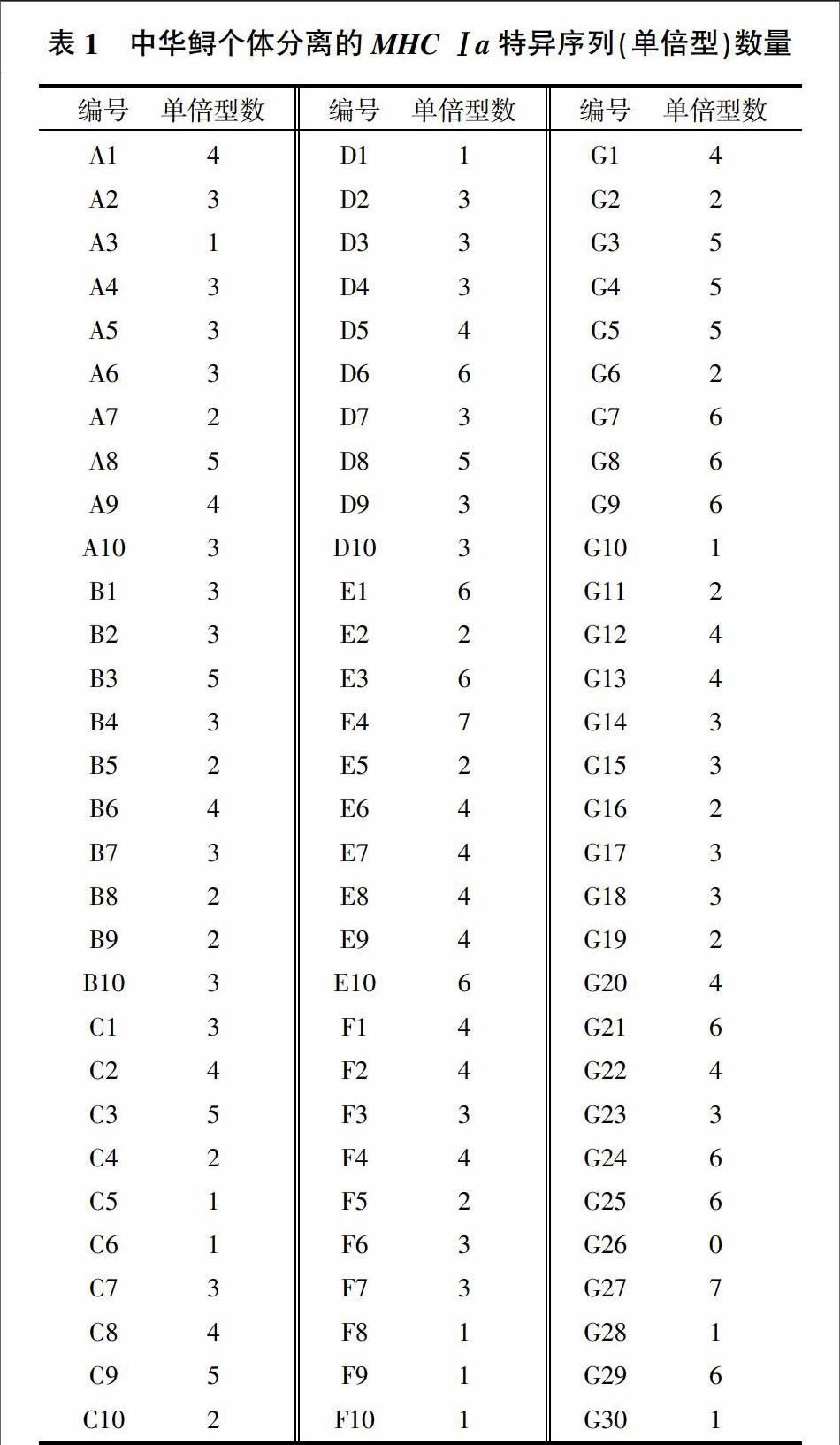
中华鲟野生群体30个样品265个有效克隆中共检测出50条特异序列(单倍型),中华鲟子一代群体30个样品的278个有效克隆中共检测出66条特异序列(单倍型),中华鲟子二代群体30个样品的257个克隆中检测出64条特异序列(单倍型)。MHC Ⅰa单倍型分离情况见表1。
2009年野生樣品编号为A1-A10;2010年野生样品编号为B1-B10;2011年野生样品编号为C1-C10。2011年子二代样品编号为D1-D10;2012年子二代样品编号为E1-E10;2013年子二代样品编号为F1-F10。子一代样品编号为G1-G30。
中华鲟3个群体共有单倍型序列7条,其中Acsi-UAB*0101、Acsi-UAB*0103和Acsi-UAB*0105为主要优势单倍型,Acsi-UAB*0101单倍型数量占野生群体有效克隆总数的58.1%,Acsi-UAB*0103单倍型数量占野生群体有效克隆总数的10.9%,Acsi-UAB*0105单倍型数量占野生群体有效克隆总数的7.6%;Acsi-UAB*0101和Acsi-UAB*0103也是中华鲟子一代群体和子二代群体的优势单倍型,分别占子一代群体总数的38.8%和31.7%,占子二代群体总数的60.7%和10.1%。3个主要单倍型在中华鲟3个群体中的分布比例见表2。
2.3 3个群体序列多态性和遗传多样性
图1是中华鲟野生群体50个单倍型的核苷酸序列比对结果,127 bp的核苷酸序列比对后发现有53个变异位点,变异率为41.73%。其中转换位点25个,颠换位点18个,既有转换又有颠换的位点10个。图2是中华鲟野生群体50个单倍型的氨基酸序列比对结果,翻译后序列长为42个氨基酸,在23个氨基酸位点发生替代,氨基酸序列多态性为54.76%。
图3是中华鲟子一代群体66个单倍型的核苷酸序列比对结果,127 bp的核苷酸序列比对后发现有64个变异位点,变异率为50.39%。其中转换位点30个,颠换位点24个,既有转换又有颠换的位点10个。图4是中华鲟野生群体66个单倍型的氨基酸序列比对结果,翻译后的42个氨基酸序列在26个氨基酸位点发生替代,氨基酸序列多态性为61.90%。
图5是中华鲟子二代群体64个单倍型的核苷酸序列比对结果,127 bp的核苷酸序列比对后发现有62个变异位点,变异率为48.82%。其中转换位点31个,颠换位点22个,既有转换又有颠换的位点9个。图6是中华鲟野生群体66个单倍型的氨基酸序列比对结果,翻译后的42个氨基酸序列在24个氨基酸位点发生替代,氨基酸序列多态性为57.14%。
对3个中华鲟种群的遗传多样性分析显示(表3):单倍型数目H最大的为子一代群体(66),其次为子二代群体(64),第三为野生群体(50);单倍型多样性h最大的为子一代群体(0.937),其次为子二代群体(0.898),第三为野生群体(0.879);核苷酸多样性指数π最大的为子一代群体(0.056),其次为野生群体(0.043),第三为子二代群体(0.015)。整体而言,子一代种群的各遗传多样性参数最高;子二代群体单倍型数和单倍型多样性较野生群体更高,但是核苷酸多样性、平均核苷酸差异数则低于野生群体。
2.4 同义替代和非同义替代
利用DNasp 5.0计算中华鲟MHC Ⅰa序列中的同义替代率(dn)和非同义替代率(ds),中华鲟野生群体的dn/ds为1.33,中华鲟子一代群体的dn/ds为1.03,中华鲟子二代群体的dn/ds为1.04(表4)。
2.5 系统发育树
图7、图8和图9分别是中华鲟3个群体MHC Ⅰ基因基于kimura双参数模型构建邻接(Neighbor joining,NJ)系统发育树。中华鲟3个群体MHC Ⅰ基因明显地被分为两大类群,推测中华鲟 MHC Ⅰ基因可能存在两个基因座位。由于部分单倍型序列差异较小,导致系统发育树某些节点自展值较低。
3 讨论
3.1 中华鲟MHC Ⅰ基因多态性
目前,有关鱼类MHC基因多态性的研究较多。庞纪彩等[22]从广东省 3 个不同罗非鱼养殖地区采集的137尾尼罗罗非鱼(Oreochromis niloticus)的个体基因组中扩增出长度为775~796 bp片段的MHC ⅡB核苷酸序列,共检测出49个单碱基突变位点;张玉喜等[9]对牙鲆84个个体的411个阳性克隆进行测序,发现有13种不同的MHC ⅡB核苷酸序列,分别编码13种不同的氨基酸序列。杨玲等[23]从扩增的262 bp的草鱼MHC Ⅰ基因核苷酸序列中,发现50个多态位点(19%),低于本研究变异率最小的野生群体(41.73%)。本研究中华鲟3个群体90个个体的800个克隆,共发现有157种不同的MHC Ⅰ核苷酸序列,表现出了丰富的基因多态性。中华鲟种群MHC Ⅰ基因多态性比其他养殖鱼类种群较高,一方面原因可能是其他养殖鱼类生活史较短,人工选育代数较多导致遗传多样性较低,而中华鲟由于生活史较长,人工选育代数较少;另一方面原因在于中华鲟自身遗传多倍性组成所致。
表2顯示了各单倍型在不同群体中的分布频率,各单倍型在同一种群出现频率差别很大,Acsi-UAB*0101在野生种群中出现的频率最高,占58.1%,其次为Acsi-UAB*0103和Acsi-UAB*0105单倍型,它们出现的频率分别为10.9%、7.55%。相同的单倍型在不同种群中出现的频率差别也很大,另外大多数单倍型只出现一次,Acsi-UAB单倍型的高多态性和低频率也反应出MHC基因的高度变异性[24]。
3.2 选择压力
MHC基因型的多样性,一般认为是由杂种优势、分子进化的中性理论和正向选择引起的[25]。中性理论认为在分子水平上的进化产生的随机漂移引起选择性中性或接近中性的突变,是对MHC基因多态性的可能解释。中华鲟3个群体的MHC Ⅰa非同义替代率与同义替代率之比均大于1,一般认为非同义替换高于同义替换是由正向选择作用产生的, 因此可以认为在中华鲟进化过程中,MHC Ⅰa主要受到正向选择的影响, 而正向选择正是MHC基因多态性的发生机制, 因此产生了众多的等位基因。MHC蛋白是脊椎动物适应性免疫系统的关键分子,其主要功能是识别和结合抗原,并将抗原呈递给T淋巴细胞。MHC蛋白识别和结合抗原的部位位于蛋白顶端的沟槽上,特别是PBR上的氨基酸残基,因此,MHC基因或基因型对抗原结合有特异性[26,27]。
3.3 中华鲟3个群体MHC Ⅰ基因遗传变异分析
本研究所用的中华鲟子一代样品均为1980年至2000年初的野生中华鲟繁殖的后代,年龄结构在16~29龄甚至更长,野生来源样品为2009、2010和2011年从葛洲坝采集的苗种。子一代中华鲟群体MHC Ⅰ基因遗传多样高于野生中华鲟群体,这表明近年来中华鲟野生种群MHC Ⅰ基因遗传多样呈现出下降趋势,其主要原因可能是中华鲟野生群体数量逐年下降。黄真理[28]建立了利用捕捞数据估算其资源量的理论和方法,对葛洲坝截流后的中华鲟资源量进行了初步估算,发现中华鲟年际资源增长率从1981年的6.92减少到1984年以后的0.793~0.956,1984年中华鲟资源量达到最大,其后逐年减少。危起伟等[29]研究葛洲坝截流24年来野生中华鲟产卵群体结构的变化发现,中华鲟雌雄性比由1981~1983年的1.10∶1降低到1987~1989年的0.63∶1,而后上升到2003~2004年的5.86∶1,野生中华鲟产卵群体性别结构发生严重失衡。野生种群数量的减少,再加上性比失衡,加速了参与繁殖亲鱼数量的减少及种群遗传多样性的快速下降。野生中华鲟群体MHC Ⅰ基因遗传多样性小于人工种群的另一种可能是采样年份参与繁殖的野生中华鲟群体相对较小。近年来中华鲟濒危程度加剧,繁殖种群逐年下降,从而导致参与产卵亲鱼的数量比较少,2009、2010和2011年采集的野生中华鲟苗种可能均为少数亲本个体所产生的后代,使得野生种群样品代表性不足。子一代中华鲟群体MHC Ⅰ基因遗传多样性高于子二代中华鲟群体,则表明子二代在传递过程中遗传多样性有所丢失的现象。因此,在人工种群遗传管理上,繁殖亲鱼配对上尽可能选择MHC基因型不同的个体进行繁殖配对,而且尽可能兼顾到稀有MHC基因型的传代问题,最大化减少稀有基因型的丢失。
MHC基因的遗传多样性与鱼类对疾病的抵抗力密切相关。Landis等[30]发现虹鳟的MHC Ⅰb基因在病毒感染后表达量上升;杨玲等[23]对草鱼MHC class Ⅰ基因多态性及其与鱼体抗柱形病能力的关系进行了研究分析,发现有6种等位基因只出现在抗病个体中,有7种等位基因只出现在染病个体中,显示MHC Ⅰ基因可以作为分子遗传标记进行抗病相关标记辅助育种;胡丹丹[31]研究虹鳟MHC Ⅰ基因第2外显子等位基因与抗传染性造血器官坏死病(IHN)性状的相关性发现,4种等位基因与抗病性状高度相关,3种等位基因与IHN易感性相关,并找出两种抗性群体中的优势等位基因。目前,本研究仅停留在群体遗传多样性层面,更深入研究将在个体水平上探索抗病性个体及疾病易感个体与某种类型MHC单倍型连锁关系,将更有利于中华鲟人工种群管理和繁殖对策制定。
参考文献:
[1] FROESCHKE G,SOMMER S.MHC class II DRB variability and parasite load in the striped mouse (Rhabdomys pumilio) in the Southern Kalahari[J].Mol Biol Evol,2005,22:1254-1259.
[2] HEDRICK P W,KIM T J,PARKER K M.Parasite resistance and genetic variation in the endangered Gila topminnow[J].Animal Conservation,2001,4:103-109.
[3] ARKUSH K D,GIESE A R,MENDONCA H L,et al.Resistance to three pathogens in the endangered winter-run Chinook salmon(Oncorhynchus tshawytscha):Effects of inbreeding and major histocompatibility complex genotypes[J].Can J Fish Aquat Sci,2002,59:966-975.
[4] MEYER-LUCHT Y,SOMMER S. MHC diversity and the association to nematode parasitism in the yellow-necked mouse (Apodemus flavicollis)[J].Molecular Ecology,2005,14:2233-2243.
[5] SOMMER S.The importance of immune gene variability (MHC)in evolutionary ecology and conservation[J].Frontiers in Zoology,2005,2:1-18.
[6] EDWARDS S V,HEDRICK P W. Evolution and ecology of MHC molecules:From genomics to sexual selection[J].Trends in Ecology & Evolution,1998.13:305-311.
[7] POTTS W K,MANNING C J,WAKELAND E K. Mating patterns in seminatural populations of mice influenced by MHC genotype[J].Nature,1991,352:619-621.
[8] 徐建勇,陳松林,毕金贞.野生抗病牙鲆MHC IIB内含子1和外显子2序列多态性[J].中国水产科学,2008,12(4):593-599.
[9] 张玉喜,陈松林.牙鲆MHC IIB基因多态性及其与鱼体抗病力关系的研究[J].水产学报,2006,30(5):633-639.
[10] ZHANG Y X,CHEN S L,LIU Y G,et al. Major histocompatibility complex class IIB allele polymorphism and its association with resistance/susceptibility to Vibrio anguillarum in Japanese Flounder(Paralichthys olivaceus)[J].Marine Biotechnology,2006(8):600-610.
[11] XU T J,CHEN S L,ZHANG Y X. MHC class IIα gene polymorphism and its association with resistance/susceptibility to Vibrio anguillarum in Japanese flounder(Paralichthys olivaceus)[J].Developmental and Comparative Immunology,2010,34:1042-1050.
[12] JIA Z Y,CHI X F,LI C T,et al. Development of MHC classI and II B primers in common carp and its molecular characterization[J].Biochem Genet,2010,48:690-695.
[13] 李雪松,刘至治,赵雪锦,等.“全红”体色瓯江彩鲤 MHC-DAB 基因多态性及其与鱼体抗病力关系的分析[J].水产学报,2011, 9(35):1294-1301.
[14] 赵雪锦,刘至治,李雪松,等.“粉玉”体色瓯江彩鲤MHC class II B基因多态性及其与鱼体抗病力的关系[J].中国水产科学, 2012,19(3):399-407.
[15] PALTI Y,NICHOLS K M,WALLER K I,et al. Association between DNA polymorphism tightly linked to MHC class II genes and IHN virus resistance in backcrosses of rainbow and cutthroat trout[J].Aquac,2001,194(3-4):283-289.
[16] LOHM J,GRAHN M,LANGEFORS A,et al. Experimental evidence for major histocompatibility complex-allele-specific resistance to a bacterial infection[J].Proceedings Royal Society,2002,269:2029-2033.
[17] GLOVER K A,GRIMHOLT U,BAKKE H G,et al. Major histocompatibility complex(MHC) variation and susceptibility to the sea louse Lepeophtheirus salmonis in Atlantic salmon Salmo salar[J].Dis Aquat Organ,2007,76(1):57-65.
[18] OZAKI A,SAKAMOTO T,KHOO S K,et al. Quantitative trait loci (QTLs) associated with resistance/susceptibility to infectious pancreatic necrosis virus (IPNV) in rainbow trout (Oncorkynckus mykiss)[J].Mol Genet Genomics,2001,265:23-31.
[19] WYNNE J W,COOK M T,NOWAK B F,et al. Major histocompatibility polymorphism associated with resistance towards amoebic gill disease in Atlantic salmon (Salmo salar L.)[J].Fish & Shellfish Immunology,2007,22:707-717.
[20] KJ?覫GLUM S,LARSEN S,BAKKE H G,et al. How specific MHC class I and II combinations affect disease resistance against salmon anaemia in Atlantic salmon(Salmo salar)[J].Fish & Shellfish Immunology,2006,21:431-441.
[21] WANG D,ZHONG L,WEI Q,et al. Evolution of MHC class I genes in two ancient fish,paddlefish(Polyodon spathula) and Chinese sturgeon(Acipenser sinensis)[J].FEBS Letters,2010, 584:3331-3339.
[22] 龐纪彩,高风英,卢迈新,等.广东养殖尼罗罗非鱼3个不同群体MHC ⅡB基因序列多态性和遗传分化[J].基因组学与应用生物学,2014,33(2):299-306.
[23] 杨 玲,孟庆磊,张龙岗,等.草鱼MHC class I基因多态性及其与鱼体抗柱形病能力关系分析[J].长江大学学报(自然科学版),2013,10(17):42-47.
[24] 徐田军,陈松林.牙鲆MHC-DAA结构及其等位基因多态性[J].遗传,2009,31(10):1020-1028
[25] PARHAM P,OHTA T. Population biology of antigen presentation by MHC class I molecules[J]. Science,1996,272(5258):67-74.
[26] SILVER M L, GUO H C, STROMINGER J L, et al. Atomic structure of a human MHC molecule Presenting an influenza virus peptide[J]. Nature,1992,360:367-369
[27] GUO H C,JARDETZKY T S,GARRETT T P J,et al.Different length peptides bind to HLA-Aw68 similarly at their ends but bulge out in the middle[J].Nature,1992,360:364-366.
[28] 黄真理.利用捕捞数据估算长江中华鲟资源量的新方法[J].科技导报,2013,31(13):18-22.
[29] 危起伟,陈细华,杨德国,等.葛洲坝截流24年来中华鲟产卵群体结构的变化[J].中国水产科学,2005,15(4):452-457.
[30] LANDIS E D,PURCELL M K,THORGAARD G H,et al. Transcriptional profiling of MHC class I genes in rainbow trout infected with infectious hematopoietic necrosis virus[J]. Molecular Immunology,2008,45:1646-1657.
[31] 胡丹丹.虹鳟MHC Ⅱ类A基因(DAA)多态性与抗IHN相关性分析[D].兰州:甘肃农业大学,2013.
