种植行距和品种对玉米根际反硝化菌群丰度和功能的影响*
2017-03-25金文俊曹文超董召荣王成雨
宋 贺, 金文俊, 车 钊, 曹文超, 董召荣, 王成雨**
种植行距和品种对玉米根际反硝化菌群丰度和功能的影响*
宋 贺1, 金文俊1, 车 钊1, 曹文超2, 董召荣1, 王成雨1**
(1. 安徽农业大学农学院 合肥 230036; 2. 中国农业大学资源与环境学院 北京 100193)
反硝化是根际氮素损失重要途径, 作物品种和行距改变是否会对根际反硝化产生影响尚不清楚。本研究比较了不同玉米品种和种植行距间根际土壤反硝化菌群丰度和功能的差异, 为降低根际反硝化损失和提高氮肥利用效率提供科学依据。通过两个独立的田间试验, 利用生物化学和分子微生物学方法, 分别研究‘浚单20’、‘安农8号’、‘郑单958’、‘品玉18’和‘隆平206’ 5个玉米品种以及20 cm、30 cm、40 cm、50 cm种植行距对根际土壤反硝化能力、反硝化菌群丰度、N2O/(N2O+N2)产物比和土壤呼吸等指标的影响。‘浚单20’、‘安农8号’、‘郑单958’根际反硝化能力显著低于其他两个品种; 随着行距减少, 反硝化能力有显著增加趋势。‘隆平206’和‘品玉18’的型反硝化菌群丰度显著高于其他品种, 而和型菌群的丰度以‘浚单20’和‘安农8号’最高; 行距20 cm的和型菌丰度显著高于其他行距处理, 但型菌丰度以40 cm行距丰度最大。品种对N2O/(N2O+N2)产物比有一定影响, 其中‘安农8号’最低, 但行距对产物比没有显著影响。相关分析表明反硝化能力与土壤呼吸和型菌群丰度均极显著正相关, 但与和型菌群未呈现这种关系, 由此表明型菌丰度和根际有机碳差异可能是造成反硝化能力不同的主导因子。品种和种植行距会对玉米根际反硝化过程产生一定影响, 根际低反硝化损失品种的筛选、选育和根际反硝化过程调控是减少根际反硝化损失, 提高氮肥利用效率的有效途径。
玉米; 品种; 行距; 根际; 反硝化能力; 反硝化菌群; N2O/(N2O+N2)产物比
根际是植物、土壤和微生物相互交流的中心, 也是植物与土壤生态系统物质交流的最活跃区域[1]。根际生态过程的调控是提高作物养分利用效率的关键。氮素转化是根际最核心的生态过程之一, 与作物氮肥利用率和氮素相关环境污染密切相关。氮素转化中反硝化过程将植物可利用的NO3–还原为植物较难利用的N2O、NO和N2等气态产物, 直接导致根际氮素损失。此外, N2O和NO是大气中主要的痕量气体, 对全球气候变暖和臭氧层破坏起到重要作用[2-3]。因此, 深入研究根际土壤反硝化过程对于提高作物氮肥利用率、降低痕量气体排放和促进低碳农业发展具有重要意义。
反硝化过程主要由反硝化菌群驱动, 受到土壤NO3–浓度、土壤pH和有机碳及盐分含量等因素的调控[4-5]。在作物生长过程中, 根系会通过吸收NO3–、盐基离子或释放有机碳调节根际土壤NO3–浓度、pH和盐分和有机碳含量, 进而影响反硝化过程。例如, 作物一生通过根系可释放约占整个光合产物17%的有机碳, 这些有机碳为根际反硝化菌提供重要的能源[6], 在一些NO3–含量高的土壤中, 根际反硝化率是非根际土壤的22倍[7]。不同种类植物根系在吸肥和分泌有机碳方面存在差异, 其根际反硝化特征也应不同。前人研究发现不同植物种类对根际型反硝化菌群结构产生显著影响[8]。同样, 同种作物的不同基因型在吸肥和分泌有机碳量和质方面也存在差异[9-11], 这些差异是否对反硝化菌群和功能产生影响, 目前尚不清楚。除品种优选外, 通过调节行距优化群体密度也是作物增产的一项有效措施, 被广泛应用于农业生产。不同种植行距会对作物根系吸肥和有机物释放造成显著影响[12-13], 但目前种植行距对根际反硝化的影响也不明确。
通过两个独立的田间小区试验, 本研究比较了不同玉米品种和种植行距间根际土壤、和型反硝化菌丰度的差异, 同时结合反硝化能力和N2O/(N2O+N2)产物比的测定, 明确反硝化功能的变化特征, 为阐明品种和种植行距间植株根际反硝化特征差异、降低根际氮素损失和提高作物氮肥利用率提供科学依据。
1 材料与方法
1.1 试验点概况
本研究包括两个试验地点, 分别为阜南和合肥试验点。阜南试验点位于安徽省阜南县农业科学研究所试验园(32°66¢N, 115°59¢E)。该地区年平均温度和降雨量分别为15 ℃和900 mm。土壤类型为砂浆黑土, 试验前表层土壤(0~20 cm)全氮含量1.53 mg∙kg-1,碱解氮83.2 mg∙kg-1, 速效磷56.5 mg∙kg-1, 速效钾78.7 mg∙kg-1, 有机质16.8 g∙kg-1[14]。合肥试验点位于安徽省合肥市安徽农业大学农翠园试验基地(31°87¢N, 117°25¢E)。该区年平均温度为15.7 ℃, 降雨量近1 000 mm。土壤类型为黄褐土, 玉米种植前0~20 cm土层有机质含量14.5 g∙kg-1, 全氮1.21 mg∙kg-1,碱解氮76.4 mg∙kg-1, 速效磷32.4 mg∙kg-1, 速效钾84.6 mg∙kg-1。
1.2 试验布置与样品采集
试验1为玉米品种比较试验, 在阜南试验点进行; 试验2为不同种植行距试验, 试验地点为合肥试验点。试验主要采用完全随机设计, 每个处理3次重复。
试验1, 小区面积为28 m2(4 m×7 m), 供试玉米品种包括‘浚单20’(XD)、‘安农8号’(AN)、‘郑单958’ (ZD)、‘品玉18’(PY)和‘隆平206’(LP)。2013年6月10日播种, 种植密度为6万株∙hm-2, 氮肥用量为240 kg(N)∙hm-2, 基追比5︰5, 追肥在大喇叭口进行。磷肥和钾肥用量分别为105 kg(P2O5)∙hm-2和105 kg(K2O)∙hm-2, 全部作为基肥施用。更多试验细节可参考文献[14]。
试验2, 玉米品种为‘郑单958’。小区面积为8 m2(2 m×4 m), 主要设置20 cm、30 cm、40 cm和50 cm 4个行距处理, 株距都为30 cm。2013年6月16日播种, 氮肥用量为220 kg(N)∙hm-2, 基追比5︰5, 追肥在大喇叭口进行。磷肥和钾肥用量分别为120 kg(P2O5)∙hm-2和110 kg(K2O)∙hm-2, 全部作为基肥施用。
于玉米开花初期在每个小区随机选点取样, 挖取玉米根系采用抖根分离法取根系所粘土壤为根际土壤, 用直径5 cm土钻取相应植株行间土壤为非根际土壤[15]。取样后装入塑料封口袋内, 放入装有冰袋的保温箱内, 带回实验室后过2 mm筛, 分两部分储藏, 一部分放在–20 ℃冰箱储藏, 主要用于反硝化功能基因分子定量试验; 另一部分放在4 ℃冰箱储藏, 主要用于培养试验和土壤理化性状测定。
1.3 土壤微生物总DNA提取和功能基因荧光定量
取0.5 g土样, 用土壤DNA提取试剂盒(Fast DNA SPIN Kit for Soil, 美国Q-BIO gene公司), 按试剂盒操作步骤, 提取土壤微生物总DNA, 总提取量为80 μL。洗脱液放入−20 ℃冰箱储藏。分别选取、和3对引物扩增反硝化菌功能基因、和[16-18]。50 μL反应体系包括25 μL SYBR Premix Ex Taq (TaKaRa, 日本), 引物各1 μL (10 μmol∙L-1), DNA模板1 μL, 其余的用灭菌高纯水补齐。扩增程序为95 ℃ 2 min; 95 ℃ 30 s, 58 ℃45 s, 72 ℃45 s, 35个循环。的PCR反应程序为: 94 ℃ 3 min; 94 ℃ 45 s, 55 ℃45 s, 72 ℃1 min, 35个循环。的PCR反应程序为95 ℃ 3 min; 94 ℃ 20 s, 59 ℃20 s, 72 ℃30 s, 35个循环。定量PCR反应在Mx3000P real-time PCR系统(Stratagene, USA)上进行。质粒和标准曲线的制备主要依照王晓辉[19]的方法。
1.4 反硝化能力(Denitrification Capacity, DC)、N2O/(N2O+N2)和土壤呼吸测定
反硝化能力的测定主要按照Šimek的标准方法[20]。各小区取两组10 g根际鲜土放入两组120 mL培养瓶中, 向瓶中加入4 mL浓度为10 mmol∙L-1的KNO3溶液, 随后密封, 并用氦气反复冲洗4次。其中一组注入10 mL乙炔, 另一组不注入。注乙炔的培养瓶, 用装有少量水、没有活塞的注射器插入瓶塞用来平衡瓶内气压。在24 h和48 h后, 两组都抽取5 mL气体上气相色谱测定N2O和CO2浓度(美国Agilent, GC-7890A), 防止气压变低, 由相同体积的氦气进行补气平衡。根据24 h到48 h N2O和CO2浓度变化率计算反硝化能力、N2O/(N2O+N2)和土壤呼吸[20-21]。其中添加乙炔的培养瓶N2O气体变化率是反硝化能力, 代表反硝化总量N2O+N2的产生率; 不添加乙炔的培养瓶N2O气体变化量代表反硝化过程N2O排放率。
1.5 土壤pH、无机氮、电导率和含水量测定
土壤无机氮(NH4+-N和NO3−-N)主要在1.0 mol×L-1KCl浸提后, 用流动分析仪测定(TRAACS2000, Hamburg, 德国)。电导率和土壤pH由电导仪和土壤pH计测定(上海, 雷磁), 水土比为5︰1。土壤含水量(%)为土壤水质量/烘干土质量×100%。
1.6 数据统计与分析
数据用SPSS 19分析软件进行单因素方差和相关性分析。图中数据为处理平均值±标准差。图表由Microsoft Excel 2007作图。
2 结果与分析
2.1 玉米品种和种植行距对根际土壤化学性状的影响
从表1可以看出, 不同品种玉米根际土壤的基本化学性状存在较为明显的差异。‘隆平206’根际土壤pH显著低于其他几个品种。硝态氮含量‘隆平206’最高, ‘浚单20’最低, 而铵态氮含量则相反。根际土壤电导率‘安农8号’和‘品玉18’最高, ‘郑单958’和‘隆平206’次之, ‘浚单20’最低。不同品种根际土壤含水量也存在一定差异, ‘浚单20’和‘隆平206’显著高于‘安农8号’和‘品玉18’。
种植行距对土壤化学性状也产生较明显影响。随着行距的减少, 根际土壤pH显著降低, 行距20 cm时土壤pH下降为5.55, 与周围土体相比下降近1个单位。在无机氮方面, 50 cm行距处理显著低于其他行距处理。40 cm行距处理土壤电导率最大。此外, 品种和行距比较试验均显示玉米开花期根际土壤pH显著低于周围非根际土壤。

表1 玉米品种和种植行距对根际土壤性状的影响
不同字母表示在品种或行距之间差异显著(<0.05)。Different letters indicate significant differences between varieties and row spacings (< 0.05).
2.2 玉米品种和种植行距对根际土壤反硝化菌群丰度的影响
图1A显示‘品玉18’和‘隆平206’根际土壤中型反硝化菌群丰度显著高于其他3个玉米品种。在型和型反硝化菌群方面, ‘浚单20’和‘安农8号’的丰度显著高于其他3个品种(图1)。此外, ‘浚单20’、‘安农8号’和‘郑单958’的/(+)比例显著高于‘品玉18’和‘隆平206’(图1B)。
种植行距也对反硝化菌群产生明显影响。从图2A可以看出, 20 cm行距根际土壤中型和型反硝化菌群丰度显著高于其他3个行距处理。在型菌群方面, 40 cm行距处理的丰度最高, 其他处理之间差异不显著(图2B)。与品种的影响不同, 行距对/(+)比例的影响较少, 处理之间差异不显著(图2B)。
比较两个试验根际和非根际土壤可知, 根际土壤中型反硝化菌群丰度显著高于非根际土壤, 但根际土壤和型反硝化菌群丰度并不完全高于非根际土壤(图1、图2)。两个试验中, 根际土壤中型反硝化菌群丰度远高于型, 它们之间相差两个数量级以上(图1、图2)。
XD为‘浚单20’, AN为‘安农8号’, ZD为‘郑单958’, PY为‘品玉18’, LP为‘隆平206’, Bulk为非根际土。不同字母表示在品种之间差异显著(<0.05)。XD: Xundan20; AN: Annong 8; ZD: Zhengdan 958; PY: Piyu 18; LP: Longping 206. Different letters indicate significant differences among varieties (< 0.05).
Bulk为非根际土, 不同字母表示行距间差异显著(<0.05)。Bulk: non-rhizosphere soil.Different letters indicate significant differences among row spacings (< 0.05).
2.3 玉米品种和种植行距对根际土壤反硝化能力、N2O/(N2O+N2)产物比和土壤呼吸的影响
从图3A可知, ‘隆平206’和‘品玉18’根际土壤反硝化能力显著高于其他3个品种。在N2O/(N2O+N2)产物比和根际土壤呼吸方面, ‘安农8号’均显著低于其他品种(图3)。除品种影响外, 种植行距也对反硝化能力和土壤呼吸产生显著影响。随着行距减少反硝化能力有显著增加的趋势, 20 cm处理的最高(图4A)。此外, 20 cm的土壤呼吸也显著高于其他行距较大处理。与品种的影响不同, 行距对N2O/(N2O+N2)产物比没有显著影响。两个试验中, 根际土壤反硝化能力和土壤呼吸均显著高于非根际土壤。
Bulk为非根际土, 不同字母表示品种间差异显著(<0.05)。Bulk: non-rhizosphere soil. Different letters indicate significant differences among varieties (< 0.05).
Bulk为非根际土, 不同字母表示行距间差异显著(<0.05)。Different letters indicate significant differences among row spacings (< 0.05) .
2.4 品种和行距比较试验中被测量变量之间相关性分析
在两个比较试验中, 反硝化能力与土壤呼吸极显著正相关(=0.889和0.866,<0.01), 与土壤pH呈极显著负相关(=-0.726和-0.918,<0.001)。土壤呼吸和土壤pH之间也表现出极显著负相关。此外, 反硝化能力与反硝化菌群丰度也极显著正相关(=0.850和0.795,<0.01)。在玉米品种比较试验中, 反硝化能力与型反硝化菌群丰度极显著负相关, 但在行距比较试验中, 两者相关性不显著(表2、表3)。两个试验中, 反硝化能力与型反硝化菌群丰度均不相关。在N2O/(N2O+N2)产物比方面, 在品种比较试验中, 它与/(+)极显著负相关(=-0.701,=0.001), 但与型反硝化菌群丰度不相关; 在行距比较试验中, 产物比与/(+)和型反硝化菌群丰度均不相关。
DC: 反硝化能力。*、**分别表示相关性显著(<0.05)和极显著(<0.01)。DC: denitrification capacity. * and ** indicate significant correlation at 0.05 and 0.01 levels, respectively.
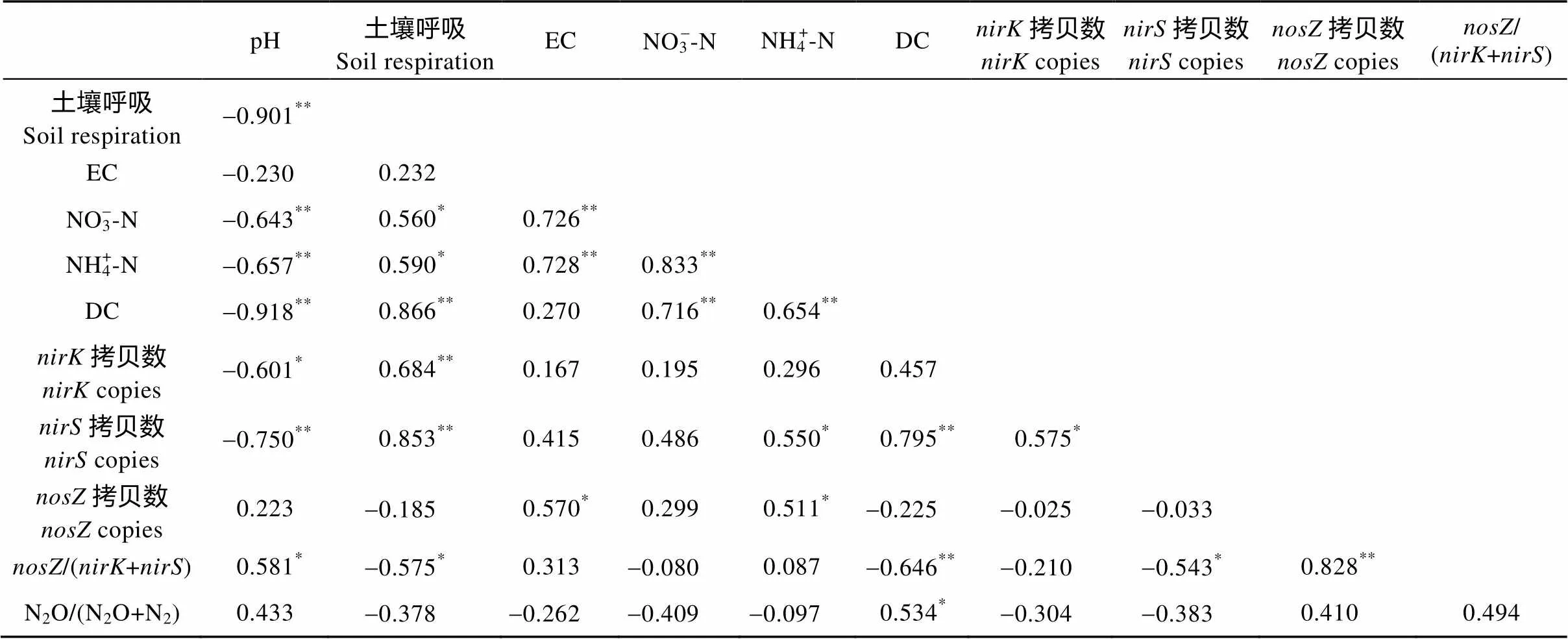
表3 行距比较试验中被测量变量间相关性分析
DC: 反硝化能力。*、**分别表示相关性显著(<0.05)和极显著(<0.01)。DC: denitrification capacity. * and ** indicate significant correlation at 0.05 and 0.01 levels, respectively.
3 讨论
根际土壤反硝化过程与根际氮素损失、作物氮肥利用效率密切相关[22]。本研究从品种和种植行距入手, 研究它们对根际土壤反硝化过程的影响。结果表明, 不同玉米品种间根际土壤反硝化能力方面存在一定差异。‘浚单20’、‘安农8号’和‘郑单958’的根际土壤反硝化能力显著低于‘隆平206’和‘品玉18’, 说明前3个品种的根际氮素反硝化损失相对较少。目前提高作物氮素利用率方面主要从精准施肥[23]、高氮吸收能力品种选育入手[24],很少考虑作物根际的氮素损失,特别是反硝化损失。而实际上, 减少根际氮素反硝化损失可能是提高作物氮肥利用效率的另一条重要途径。在未来研究中, 应重视根际土壤反硝化过程的调控和低反硝化损失品种的选育。
在目前的作物栽培措施中, “增密减氮”是提高作物氮肥利用、减少氮肥负面环境效应的重要措施[25]。比如Al-Naggar等[26]研究发现, 对于一些耐密的玉米品种, 当种植密度从每公顷71 400株增加到95 200株时, 氮肥用量可从每公顷570 kg N降低到285 kg N, 而此时产量基本保持不变。但本研究表明随着种植行距的减少, 即种植密度不断增加, 玉米根际土壤反硝化能力不断增加。可见作物密度的增加应该控制在一定的范围内, 如果超过某一临界密度, 根际氮素反硝化损失可能会显著提高, 从而又不得不增加氮投入量来获得高产。此时“增密减氮”措施的效果将会大大削弱, 很难起到减氮目的。Boomsma等[27]研究表明当种植密度从每公顷79 000株增加到104 000株时, 氮肥投入量反而要提高165 kg N才能获得相同产量。
在被测定的指标中, 根际反硝化能力在两个试验中与土壤呼吸均极显著正相关。土壤呼吸代表着土壤有机碳的矿化[20], 在一定程度上反映土壤微生物可利用有机碳的量[28]。由此推测, 玉米品种和种植行距对根际土壤反硝化过程影响, 可能很大程度由根际有机碳分泌量不同导致。在根际分泌物中, 有机酸是其重要的组成部分, 其分泌量与根际土壤pH显著负相关[29]。本研究也发现根际土壤pH与土壤呼吸极显著负相关。因此, 品种和种植行距试验中根际土壤pH显著性的差异在一定程度上印证了根际有机碳分泌量存在一定的不同。反硝化菌主要是异养微生物, 有机碳为它们提供能源。根际有机碳供应的差别将会对反硝化能力产生一定影响。因此, 在未来科学实践中, 根际土壤氮素反硝化损失的控制, 应首先从植物根系土壤有机物分泌调控入手。
除了受环境因子影响外, 反硝化菌群直接参与根际反硝化过程, 其丰度变化也可能对根际反硝化能力产生一定影响。本研究中不同玉米品种和种植行距对型、型和型反硝化菌均产生一定影响, 但其丰度与土壤反硝化能力相关性之间存在差异。两个试验中,型反硝化菌群丰度与反硝化能力没有显著相关性, 而型菌群丰度与反硝化能力均呈极显著正相关关系;型菌群丰度在品种试验中与反硝化能力呈负相关, 但在行距试验中相关性不显著。研究表明,型菌参与反硝化末端N2O还原, 它更多地与N2O/(N2O+N2)产物比有关, 但与反硝化能力相关性不强[30]。型和型反硝化菌均参与反硝化第2步NO2-还原, 它们与反硝化能力关系上的不同, 可能恰反映出两者生态位存在一定差异。两个试验表明, 玉米根际土壤中型反硝化菌丰度至少高于型菌两个数量级。可见在玉米根际中,型菌对NO2-还原起到绝对主导作用, 同时由于菌的剧烈竞争,型菌的丰度与根际反硝化能力相关性较差, 甚至负相关。根际土壤中型菌竞争较弱可能主要受两个因素影响。首先, 相比较型反硝化菌,型菌受pH降低影响较大[31]。本研究中根际土壤pH较非根际土壤显著下降, 有些处理下降了近1个单位。此外, 相对于型菌,型反硝化菌更喜欢有机碳和营养元素含量较高的环境, 而根际土壤恰具备这一特征[32]。
除了反硝化能力方面, 反硝化N2O/(N2O+N2)产物比因与痕量气体N2O排放密切相关, 备受关注。基因编码的N2O还原酶被认为是唯一的N2O生物汇, 因此一般认为型反硝化菌丰度与N2O/ (N2O+N2)产物比之间存在较强负相关[33]。但本研究两个试验结果表明,菌丰度与N2O/(N2O+N2)产物比的相关性并不显著。最新研究表明[34-35], 与型丰度绝对量相比,/(+)丰度比和N2O/(N2O+N2)产物比之间的关系更具可比性, 因为/(+)丰度比不但考虑N2O还原, 还考虑了N2O产生, 更能反映N2O的“源-汇平衡”。在本研究品种试验中,/(+)丰度比与N2O/(N2O+ N2)产物比呈极显著负相关关系; 但在密度试验中, 两者之间相关性不显著。造成这一结果的主要原因, 可能与两个试验中/(+)丰度比相差较大有关。在品种比较试验中,/(+)丰度比为4.3%~35.2%,型菌在反硝化菌群中占有一定比例, 能起到一定作用; 但在行距比较试验中,/ (+)丰度比仅为0.4%~1.3%,型菌在反硝化菌种群占据比例太低, 难以发挥较大作用, 因此与N2O/(N2O+N2)产物比的关系, 易受其他因素的影响。
4 结论
品种和种植行距都会对玉米根际土壤反硝化过程产生显著影响。‘浚单20’、‘安农8号’和‘郑单958’根际反硝化能力显著低于其他两个品种。随着行距减少, 反硝化能力有显著增加趋势。根际土壤有机碳量和型反硝化菌丰度的差异是造成反硝化过程改变的主导因子。品种对反硝化N2O/(N2O+N2)产物比有一定影响, 但行距对产物比没有显著影响。在未来玉米品种选育和高效栽培管理中, 根际低反硝化损失品种筛选、选育和根际土壤反硝化过程的调控是减少根际氮素反硝化损失、减少痕量气体排放和提高氮肥利用效率新的有效途径。
References
[1] 陆雅海, 张福锁. 根际微生物研究进展[J]. 土壤, 2006, 38(2): 113–121 Lu Y H, Zhang F S. The advances in rhizosphere microbiology[J]. Soils, 2006, 38(2): 113–121
[2] Bothe H, Ferguson S J, Newton W E. Biology of the Nitrogen Cycle[M]. Amsterdam: Elsevier Science, 2007: 1–427
[3] Ravishankara A R, Daniel J S, Portmann R W. Nitrous oxide (N2O): The dominant ozone depleting substance emitted in the 21st century[J]. Science, 2009, 326(5949): 123–125
[4] Philippot L, Hallin S, Schlote M. Ecology of denitrifying prokaryotes in agricultural soil[J]. Advances in Agronomy, 2007, 96: 249–305
[5] 宋贺, 王成雨, 陈清, 等. 长期秸秆还田对设施菜田土壤反硝化特征和N2O排放的影响[J]. 中国农业气象, 2014, 35(6): 628–634 Song H, Wang C Y, Chen Q, et al. Effects of long-term amendment of residue on denitrification characteristics and N2O emissions in greenhouse soil[J]. Chinese Journal of Agrometeorology, 2014, 35(6): 628–634
[6] Henry S, Texier S, Hallet S, et al. Disentangling the rhizosphere effect on nitrate reducers and denitrifiers: Insight into the role of root exudates[J]. Environmental Microbiology, 2008, 10(11): 3082–3092
[7] Hamonts K, Clough T J, Stewart A, et al. Effect of nitrogen and waterlogging on denitrifier gene abundance, community structure and activity in the rhizosphere of wheat[J]. FEMS Microbiology Ecology, 2013, 83(3): 568–584
[8] Wang H T, Su J Q, Zheng T L, et al. Impacts of vegetation, tidal process, and depth on the activities, abundances, and community compositions of denitrifiers in mangrove sediment[J]. Applied Microbiology and Biotechnology, 2014, 98(22): 9375–9387
[9] 盛婧, 张鹏, 孙国锋, 等. 基于污染控制的小麦品种氮磷钾吸收与移除特征研究[J]. 生态环境学报, 2015, 24(3): 487–493 Sheng J, Zhang P, Sun G F, et al. Nutrient absorption characteristics and removal from soil with different wheat varieties based on pollution control[J]. Ecology and Environmental Sciences, 2015, 24(3): 487–493
[10] Liu J G, Qian M, Cai G L, et al. Variations between rice cultivars in root secretion of organic acids and the relationship with plant cadmium uptake[J]. Environmental Geochemistry and Health, 2007, 29(3): 189–195
[11] Li X G, Zhang T L, Wang X X, et al. The composition of root exudates from two different resistant peanut cultivars and their effects on the growth of soil-borne pathogen[J]. International Journal of Biological Sciences, 2013, 9(2): 164–173
[12] 姜兴芳, 陶洪斌, 郑志芳, 等. 株行距配置对玉米根系性状及产量的影响[J]. 玉米科学, 2013, 21(2): 116–121 Jiang X F, Tao H B, Zheng Z F, et al. Effect of spacing allocation on the root system characters and yield of maize[J]. Journal of Maize Sciences, 2013, 21(2): 116–121
[13] Jiang W S, Wang K J, Wu Q P, et al. Effects of narrow plant spacing on root distribution and physiological nitrogen use efficiency in summer maize[J]. The Crop Journal, 2013, 1(1): 77–83
[14] 王成雨, 宋贺, 胡玲惠, 等. 玉米品种耐淹形态指标筛选及其耐淹光合生理特性研究[J]. 安徽农业大学学报, 2014, 41(4): 533–539 Wang C Y, Song H, Hu L H, et al. Screening for cultivars with water-logging resistance through analyzing morphological indexes and photosynthetic characteristics in maize[J]. Journal of Anhui Agricultural University, 2014, 41(4): 533–539
[15] 云鹏, 高翔, 陈磊, 等. 冬小麦–夏玉米轮作体系中不同施氮水平对玉米生长及其根际土壤氮的影响[J]. 植物营养与肥料学报, 2010, 16(3): 567–574 Yun P, Gao X, Chen L, et al. Plant nitrogen utilization and soil nitrogen status in rhizosphere of maize as affected by various nitrogen rates in wheat-maize rotation system[J]. Plant Nutrition and Fertilizer Science, 2010, 16(3): 567–574
[16] Braker G, Fesefeldt A, Witzel K P. Development of PCR primer systems for amplification of nitrite reductase genes (and) to detect denitrifying bacteria in environmental samples[J]. Applied and Environmental Microbiology, 1998, 64(10): 3769–3775
[17] Throbäck I N, Enwall K, Jarvis A, et al. Reassessing PCR primers targeting,andgenes for community surveys of denitrifying bacteria with DGGE[J]. FEMS Microbiology Ecology, 2004, 49(3): 401–417
[18] Henry S, Bru D, Stres B, et al. Quantitative detection of thegene, encoding nitrous oxide reductase, and comparison of the abundance of 16S rRNA,,, andgenes in soils[J]. Applied and Environmental Microbiology, 2006, 72(8): 5181–5189
[19] 王晓辉. 生物炭对设施栽培土壤硝化和反硝化微生物群落的影响研究[D]. 北京: 中国科学院大学, 2013: 27–29 Wang X H. Effect of biochar on nitrifying and denitrifying communities in greenhouse soils[D]. Beijing: University of Chinese Academy of Sciences, 2013: 27–29
[20] Šimek M, Kalčík J. Carbon and nitrate utilization in soils: The effect of long-term fertilization on potential denitrification[J]. Geoderma, 1998, 83(3/4): 269–280
[21] Šimek M, Hopkins D W. Regulation of potential denitrification by soil pH in long-term fertilized arable soils[J]. Biology and Fertility of Soils, 1999, 30(1/2): 41–47
[22] Zhou X G, Guan S N, Wu F Z. Composition of soil microbial communities in the rhizosphere of cucumber cultivars with differing nitrogen acquisition efficiency[J]. Applied Soil Ecology, 2015, 95: 90–98
[23] Williams A, Davis A S, Ewing P M, et al. Precision control of soil nitrogen cycling via soil functional zone management[J]. Agriculture, Ecosystems & Environment, 2016, 231: 291–295
[24] Ohunakin A O, Adebisi S O. Nitrogen use and assimilate partitioning ability for grain yield in some selected maize (L.) inbred lines genotypes[J]. American Journal of Experimental Agriculture, 2015, 5(2): 148–155
[25] Monneveux P, Zaidi P H, Sanchez C. Population density and low nitrogen affects yield-associated traits in tropical maize[J]. Crop Science, 2005, 45(2): 535–545
[26] Al-Naggar A M M, Shabana R A, Atta M M M, et al. Maize response to elevated plant density combined with lowered N-fertilizer rate is genotype-dependent[J]. The Crop Journal, 2015, 3(2): 96–109
[27] Boomsma C R, Santini J B, Tollenaar M, et al. Maize morphophysiological responses to intense crowding and low nitrogen availability: An analysis and review[J]. Agronomy Journal, 2009, 101(6): 1426–1452
[28] Wang W J, Dalal R C, Moody P W, et al. Relationships of soil respiration to microbial biomass, substrate availability and clay content[J]. Soil Biology Biochemistry, 2003, 35(2): 273–284
[29] Zeng F R, Chen S, Miao Y, et al. Changes of organic acid exudation and rhizosphere pH in rice plants under chromium stress[J]. Environmental Pollution, 2008, 155(2): 284–289
[30] Raut N, Dörsch P, Sitaula B K, et al. Soil acidification by intensified crop production in south Asia results in higher N2O/(N2O+N2) product ratios of denitrification[J]. Soil Biology and Biochemistry, 2012, 55: 104–112
[31] Yoshida M, Ishii S, Otsuka S, et al.-harboring denitrifiers are more responsive to denitrification-inducing conditions in rice paddy soil than-harboring bacteria[J]. Microbes and Environments, 2010, 25(1): 45–48
[32] Enwall K, Throbäck I N, Stenberg M, et al. Soil resources influence spatial patterns of denitrifying communities at scales compatible with land management[J]. Applied and Environmental Microbiology, 2010, 76(7): 2243–2250
[33] Ducey T F, Shriner A D, Hunt P G. Nitrification and denitrification gene abundances in swine wastewater anaerobic lagoons[J]. Journal of Environmental Quality, 2011, 40(2): 610–619
[34] Liu B B, Mørkved P T, Frostegård Å, et al. Denitrification gene pools, transcription and kinetics of NO, N2O and N production as affected by soil pH[J]. FEMS Microbiology Ecology, 2010, 72(3): 407–417
[35] Billings S A, Tiemann L K. Warming-induced enhancement of soil N2O efflux linked to distinct response times of genes driving N2O production and consumption[J]. Biogeochemistry, 2014, 119(1/3): 371–386
Effects of row spacing and maize variety on abundance and function of denitrifying bacterial flora in maize rhizosphere*
SONG He1, JIN Wenjun1, CHE Zhao1, CAO Wenchao2, DONG Zhaorong1, WANG Chengyu1**
(1. College of Agronomy, Anhui Agricultural University, Hefei 230036, China; 2. College of Resources and Environmental Sciences, China Agricultural University, Beijing 100193, China)
Denitrification is a key pathway of nitrogen loss in the rhizosphere. It is unknown whether changes in variety and row spacing of crop have any impacts on denitrification in the rhizosphere. Thus this study compared the differences in abundance and function of denitrifiers in the rhizosphere of different maize varieties and row spacings. The aim of the study was to provide scientific basis for reducing rhizosphere denitrification losses and improving nitrogen use efficiency. Based on data from two independent field experiments, the study investigated the effects of five maize varieties (‘Xundan 20’, ‘Annong 8’, ‘Zhengdan 958’, ‘Pinyu 18’ and ‘Longping 206’) and four row spacings (20 cm, 30 cm, 40 cm and 50 cm) on denitrification capacity, abundance of denitrifiers, N2O/(N2O+N2) ratio and soil respiration in the rhizosphere using biochemical and molecular microbiological methods. Denitrification capacities in the rhizospheres of ‘Xundan 20’, ‘Annong 8’ and ‘Zhengdan 958’ were significantly lower than those in the rhizosphere of the other maize varieties. With decreasing row spacing, denitrification capacity in rhizosphere soil obviously increased. The abundances of-denitrifiers in the rhizospheres of ‘Longping 206’ and ‘Pinyu 18’ were significantly higher than those in the rhizospheres of the other maize varieties. The abundances of- and-denitrifiers in the rhizospheres of ‘Xundan 20’ and ‘Annong 8’ were the highest. In all the row spacings, 20 cm had the highest abundances of- and-denitrifiers. As for-denitrifiers, the most abundance was found in the 40 cm row spacing treatment. The change of variety had a certain impact on N2O/(N2O+N2) ratios (e.g. ‘Annong 8’ had the lowest ratio), but the effect of row spacing was no significant. Correlation analysis showed there was a significantly positive correlation between denitrification capacity and soil respiration or the abundance of-denitrifiers. But not significant correlation was found between denitrification capacity and the abundances ofor-denitrifiers. This suggested that differences in the abundances of-denitrifiers and organic carbon in the rhizosphere were the dominant factors causing the changes in denitrification capacity. Changes in variety and row spacing could affect denitrification of maize rhizosphere as well. The screening of varieties with low denitrification loss and the regulation of denitrification processes in the rhizosphere were effective ways of reducing rhizosphere denitrification loss and improving crop nitrogen use efficiency.
Maize; Variety; Row spacing; Rhizosphere; Denitrification capacity; Denitrifying bacterial flora; N2O/(N2O+N2) ratio
10.13930/j.cnki.cjea.160882
S158.3
A
1671-3990(2017)03-0391-09
2016-10-08 接受日期: 2016-11-23
* 公益性行业(农业)科研专项经费(201503121–02)、国家自然科学基金(41301258, 31371566)和安徽省自然科学基金(1408085QC68)资助
* The study was supported by the Special Fund for Agro-scientific Research in the Public Interest of China (201503121–02), the National Natural Science Foundation of China (41301258, 31371566), and Anhui Provincial Natural Science Foundation (1408085QC68).
** Corresponding author, E-mail: wangjgcau@163.com
**通讯作者:王成雨, 主要研究方向为玉米高产栽培。E-mail: wangjgcau@163.com
宋贺, 研究方向为低碳农业生产。E-mail: songhesonghe@foxmail.com
Oct. 8, 2016; accepted Nov. 23, 2016
