131I标记槲皮素对未分化型甲状腺癌的辐射增敏作用
2017-03-24闯振蕾王玉君余红波曲昌发崔亚利
闯振蕾 王玉君 余红波 曲昌发 崔亚利
(哈尔滨医科大学附属肿瘤医院,黑龙江 哈尔滨 150081)
131I标记槲皮素对未分化型甲状腺癌的辐射增敏作用
闯振蕾 王玉君 余红波 曲昌发 崔亚利
(哈尔滨医科大学附属肿瘤医院,黑龙江 哈尔滨 150081)
目的 探讨131I标记槲皮素对未分化型甲状腺癌的辐射增敏作用。方法 利用细胞生长抑制实验观察131I-槲皮素对裸鼠种植甲状腺癌的治疗效果,应用免疫荧光显微镜观察γ-H2AX变化。结果 三种药物对DRO增殖的抑制强弱顺序为131I-QU> QU>131I且抑制作用与药物剂量及作用时间均呈依赖关系。与对照组相比,注射药物后治疗组肿瘤体积被明显抑制,从第3天开始,治疗组与对照组肿瘤体积有显著性差异(P<0.05),第28天的抑瘤率约为66.51%。免疫荧光显微镜测试显示槲皮素会影响γ-H2AX集落形成。结论 体外和体内的研究表明131I标记槲皮素能增强131I的内放疗敏感性,细胞用槲皮素预处理后显著增加了γ-H2AX的持续时间。
131I;槲皮素;未分化甲状腺癌;辐射增敏;γ-H2AX
天然产物的抗氧化和免疫增强作用经常被认为是正常组织的放射防护剂,与此同时,一些天然产物抗病毒和抗肿瘤效果可能作为一类独特的放疗增敏成分存在于肿瘤组织中。作为类次生代谢产品的植物黄酮类化合物已被证明具有诸多功能,如增强免疫、抗氧化、抗病毒、抗感染、抗肿瘤、保护心血管和许多其他药理作用〔1〕。槲皮素是一种天然的黄酮类化合物,其广泛分布在蔬菜和水果中,如苹果、坚果、浆果、洋葱、菜花、白菜等。研究表明,槲皮素可以减少紫外线辐射诱导皮肤损伤,增加在X射线辐照后小鼠的白细胞水平和人放射治疗后外周血中的淋巴细胞。此外抗氧化酶超氧化物歧化酶(SOD)的活性在组合组高于单独照射组〔2〕;放射治疗诱导毛细血管扩张后槲皮素可以导致肝小叶的瘀血发生逆转。这些研究表明,槲皮素与辐射可以扭转辐照的免疫毒性。由于槲皮素在细胞中表现出的多功能,我们假设槲皮素联合内放射治疗可以提高肿瘤的放疗敏感性。
1 材料与方法
1.1 细胞生长抑制实验 采用CCK-8方法检验不同药物作用下未分化甲状腺癌细胞DRO存活情况,并同时研究药物剂量、作用时间细胞存活的影响。在细胞水平上研究131I-QU、131I、QU对分化细胞增殖的抑制情况。其中131I的剂量分别为5、10、20、30、40 μCi,QU的浓度分别为14、28、56、84、112 μmol/L,药物作用时间分别为24、48、72 h。
1.2131I-槲皮素对甲状腺癌的治疗效果 将未分化型甲状腺癌组织碎片接种在裸鼠的右侧皮下,当肿瘤达到100~150 mg(100~150 mm3)时候开始治疗,每组8只小鼠,观察瘤内注射131I-QU及同等量的PBS(pH7.4,0.01 mol/L)0~28 d后,治疗组及对照组裸鼠肿瘤的体积变化。
1.3 免疫荧光显微镜 把呈指数增长的未分化型甲状腺癌细胞放置在22 cm2的盖玻片上,(加入槲皮素或无槲皮素)131I的剂量40 μCi,QU的浓度分别为112 μmol/L,在0、2、8、12、24 h收集细胞并进行免疫荧光检查,通过曲线和直方图表达细胞计数。
1.4 统计学分析 采用SPSS17.0软件行SNK-t检验。
2 结 果
2.1 药物对DRO增殖的影响 药物对DRO增殖的抑制强弱顺序为131I-QU> QU>131I,抑制作用与药物剂量呈依赖关系,见图1。当QU浓度为112 μmol/L、131I剂量为40 μCi、作用时间为72 h时,131I-QU对细胞增殖的抑制率达到(86.87±7.15)%,QU及131I对细胞的抑制率分别为(58.43±5.08)%、(18.86±6.29)%。与相同剂量的131I相比,131I-QU对细胞的抑制作用约提高5倍。
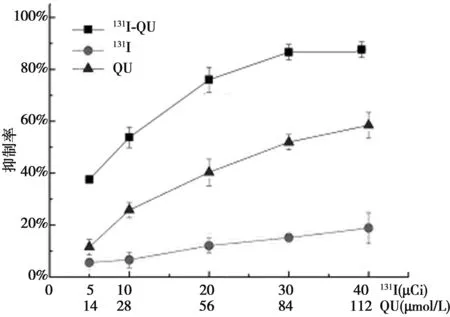
图1 药物对DRO增殖的抑制作用
2.2 两组肿瘤体积比较 在28 d的观察期内,对照组肿瘤体积不断增大,第28天时,肿瘤体积为(907.65±189.21)mm3。与对照组相比,注射药物后治疗组肿瘤体积明显被抑制,且从第3天开始,治疗组与对照组肿瘤体积差异显著(P<0.05),治疗组第28天的抑瘤率约为66.51%。瘤内注射131I-QU后的第7天,治疗组肿瘤体积达到最小〔(34.93±13.29)mm3〕,随后治疗组肿瘤体积开始逐渐增大。见图2。
2.3 免疫荧光显微镜结果 为了验证槲皮素诱导的放疗增敏机制,本文测试了槲皮素是否会影响γ-H2AX集落形成。H组蛋白的磷酸化变体H2AX是DNA链断裂和DNA修复能力的象征。时间进程的实验表明,在缺乏槲皮素组别中,照射40 μCi的12 h内放疗诱导的γ-H2AX焦点回到了照射之前的水平。当这些细胞用槲皮素预处理后则显著增加了γ-H2AX的持续时间。见图3。
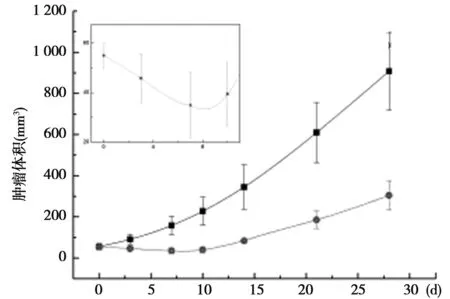
图2 两组肿瘤体积比较

图3 免疫荧光显微镜结果
3 讨 论
如何克服肿瘤的放疗抵抗性一直是肿瘤放疗学首要面临的挑战和难题,其中包括开发特异性的放疗增敏剂。分子靶向放疗增敏可以有效抑制DNA损伤。对于放疗增敏的最理想情况就是找到特异性的肿瘤细胞并且最大限度保护周围正常组织。
本实验表明:QU进入细胞后能嵌入到DNA双链上,通过共价或非共价键作用与DNA磷酸基团结合。由于未分化型甲状腺癌细胞DRO不能摄取131I,因此131I及131I+QU主要通过内照射抑制癌细胞的生长。与131I相比,131I-QU能被癌细胞摄取,并嵌入到DNA双链中,这将大大增加药物对细胞核及DNA的损伤,并加速细胞的碎裂。槲皮素的放射线增敏效应进一步证明在人类肿瘤异种移植模型体内,槲皮素可增强化疗药物诱导细胞凋亡〔3,4〕。
本实验采用的是131I标记QU,也可用发射俄歇电子的125I、124I、123I等标记QU,俄歇电子能量低(多为20~50 eV),传能线密度LET高(与α粒子相当)。俄歇电子在组织内的射程约为1~10 nm,仅相当于6个碱基对的距离,若与QU结合嵌入到癌细胞DNA中将对DNA造成更大的损伤,同时对周围正常组织具有更小的生物毒性。其原因可能是1 mCi的131I-QU不足以完全抑制肿瘤的生长或131I-QU在肿瘤内的滞留时间不够长。鉴于此,要完全抑制≤50 mm3的肿瘤的生长,需增加131I-QU单次给药的剂量或采用多次给药的治疗手段。另外,也可延长药物在肿瘤内的滞留时间以达到更好的治疗效果。在机制研究中,我们发现槲皮素可延长γ-H2AX的集落形成表明槲皮素可能干扰DNA修复过程,同以往实验结果相同〔5〕。
1 Formica JV,Regelson W.Review of the biology of Quercetin and related bioflavonoids〔J〕.Food Chem Toxicol,1995;33:1061-80.
2 Cui Y,Lin C.Quercetin enhances immune function of irradiated rats〔J〕.Chin J Radiat Med Radiat Protect,2008;4:354-7.
3 Xavier CP,Lima CF,Rohde M,etal.Quercetin enhances 5-fluorouracil-induced apoptosis in MSI colorectal cancer cells through p53 modulation〔J〕.Cancer Chemother Pharmacol,2011;68(6):1449-57.
4 Staedler D,Idrizi E,Kenzaoui BH,etal.Drug combinations with quercetin:doxorubicin plus quercetin in human breast cancer cells〔J〕.Cancer Chemother Pharmacol,2011;68(5):1161-72.
5 Lin CH,Yu Y,Zhao HG,etal.Combination of quercetin with radiotherapy enhances tumor radiosensitivity in vitro and in vivo〔J〕.Radiother Oncol,2012;104:395-400.
〔2016-09-14修回〕
(编辑 郭 菁)
国家自然科学基金资助项目(81271526)
崔亚利(1968-),男,博士,主任医师,主要从事肿瘤核医学研究。
闯振蕾(1990-),女,在读硕士,主要从事肿瘤核医学研究。
R736.1
A
1005-9202(2017)05-1052-03;
10.3969/j.issn.1005-9202.2017.05.005
