姜黄素调控食管癌Eca-109细胞分化、增殖、凋亡的机制
2017-03-24金宇斌李立德苗春兴李胜龙
金宇斌 李立德 韩 莹 苗春兴 张 霞 李胜龙
(牡丹江医学院第二附属医院胸外科,黑龙江 牡丹江 157009)
姜黄素调控食管癌Eca-109细胞分化、增殖、凋亡的机制
金宇斌 李立德1韩 莹 苗春兴 张 霞 李胜龙
(牡丹江医学院第二附属医院胸外科,黑龙江 牡丹江 157009)
目的 探讨姜黄素对食管癌Eca-109细胞的分化、增殖、凋亡及分泌信号蛋白(Wnt)信号通路的影响及机制。方法 MTT法检测8、16、32、64 μmol/L的姜黄素作用于食管癌Eca-109细胞24、48、72 h后细胞存活情况,计算细胞凋亡率,原位末端标记法(TUNEL)检测48 h后细胞凋亡情况,RT-PCR检测48 h后细胞中β连环蛋白(β-catenin)、GSK-3β、c-myc的mRNA的表达情况,Western印迹检测48 h后细胞中β-catenin、GSK-3β、c-myc蛋白的表达情况。 结果 姜黄素对食管癌Eca-109细胞的抑制作用随着作用时间和作用浓度的增加而增加,姜黄素作用24 h IC50为28.1 μmol/L,48 h为23.2 μmol/L,72 h为15.6 μmol/L。TUNEL检测细胞凋亡率随着药物作用浓度的增加而增加。β-catenin、c-myc的转录水平随着药物浓度的增加而减弱。GSK-3β的转录水平随着药物浓度的增加而加强。β-catenin、c-myc蛋白表达量随着药物浓度的增加而减弱。GSK-3β蛋白表达水平随着药物浓度的增加而加强。结论 姜黄素可以抑制食管癌Eca-109细胞增殖,促进细胞凋亡。姜黄素可以上调Wnt信号通路中GSK-3β酶的表达、促进β-catenin蛋白降解,从而抑制c-myc基因的转录,抑制癌细胞生长增殖。
食管癌;增殖;凋亡;信号通路
食管癌早期发病症状不明显,确诊后一般已经发展到食管癌晚期〔1〕。常见的治疗方法有手术治疗、化疗和放射治疗。但手术治疗方法有限,化疗效果显著但副作用大,长期化疗会引起一系列的继发感染,损害人体其他正常细胞的正常功能。姜黄素是从姜科植物郁金块根、姜黄根茎等提取的一种植物多酚,具有利胆、抗金黄色葡萄球菌等药理作用〔2〕。对癌症、老年痴呆等具有治疗作用。姜黄素对胃癌、肝癌、乳腺癌、淋巴癌等具有很好的抑制作用〔3〕,目前姜黄素对食管癌的作用机制尚不清楚。分泌信号蛋白(Wnt)信号通路在细胞的生长增殖过程中起决定性作用,其中β连环蛋白(β-catenin)、GSK-3β、c-myc是该信号通路中关键因子〔4〕。本研究拟探讨姜黄素对食管癌细胞增殖凋亡的影响及与Wnt信号通路的关系。
1 材料与方法
1.1 材料 细胞:食管癌细胞Eca-109购自中科院上海细胞所。主要仪器和设备:酶标仪(南京德铁实验设备有限公司),紫外分光光度计(美国Thermo),CO2培养箱(日本SANYO),超净工作台(苏州净化设备有限公司),倒置显微镜(日本尼康),PCR仪(美国Beckman Coulter),离心机(湖南恒诺医用设备有限公司),反转录试剂盒(碧云天生物技术有限公司),RPMI-1640培养基(美国Sigma),PCR扩增试剂盒(美国Thermo),琼脂糖(美国Thermo),抗体稀释液(杭州联科生物股份有限公司),胎牛血清(FBS)(杭州四季青有限公司),TUNEL细胞凋亡试剂盒(碧云天生物技术有限公司),青链霉素(美国Sigma),姜黄素粉(杭州默沙东生物制药有限公司),胰蛋白酶(美国Sigma),RNA提取试剂盒(碧云天生物技术有限公司),细胞总蛋白提取(碧云天生物技术有限公司),PBS(上海欣百诺生物工程有限公司),β-actin单克隆抗体(美国Bioworld),β-catenin单克隆抗体(美国Bioworld),GSK-3β单克隆抗体(美国Bioworld),c-myc单克隆抗体(美国Bioworld),辣根过氧化物标记的二抗(美国Bioworld)。
1.2 方法
1.2.1 细胞培养 将液氮罐中保存的食管癌细胞Eca-109取出,放置于37℃的水浴锅中融化,观察细胞融化后,移液枪吹打细胞混匀后,转移至15 ml离心管中,加入10 ml细胞培养液(含10%胎牛血清,100 U/ml青霉素,100 μg/ml链霉素的RPMI1640培养基)悬浮细胞,1 000 r/min离心5 min,弃上清液,加入3 ml细胞培养液重悬细胞,转移至细胞培养瓶中,37℃,5%CO2培养箱中培养。观察细胞长满细胞瓶时,倒掉细胞培养液,加入适量磷酸盐缓冲液(PBS)洗涤后,加入0.25%胰蛋白酶消化细胞。倒置显微镜下观察细胞间隙变大时,1 000 r/min离心5 min,弃上清液,用PBS洗涤细胞,加入适量细胞培养液接种于新的细胞瓶中,37℃,5%CO2培养箱中培养。
1.2.2 噻唑蓝(MTT)法观察细胞增殖情况 培养至对数生长期的食管癌细胞Eca-109,胰蛋白酶消化后,PBS洗涤,1 000 r/min离心5 min,弃上清液。加入细胞生长液调整细胞浓度为5×104个/ml,接种于96孔细胞培养板中,每孔加入细胞悬浮液100 μl,37℃,5%CO2培养基中培养24 h。吸除培养液,加入不同浓度的姜黄素使终浓度为8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L,同时设置空白组和阴性对照组,空白组中不加细胞加入等量的姜黄素,阴性对照组中加入等量的细胞生长液代替药物。为了提高实验结果的精确性,减小实验误差,每组设置10个复孔。放置于37℃,CO2培养箱中培养24、48、72 h。培养结束后加入5 mg/ml的MTT溶液10 μl,37℃孵育4 h。弃去上清,加入二甲基亚砜(DMSO)溶液100 μl,37℃孵育震荡10 min。用酶标仪检测各孔在490 nm处的吸光度(OD值),每组实验数据取各孔的平均值,计算细胞的IC50和细胞抑制率,细胞抑制率=1-(药物作用组-空白组)/(对照细胞组-空白组)。
1.2.3 原位末端标记法(TUNEL)检测细胞凋亡 终浓度为8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L的姜黄素与Eca-109细胞作用48 h后。加入4%多聚甲醛固定液放置于室温下固定细胞30 min,弃上清,PBS洗涤细胞3次,3 min/次,加入3%H2O2甲醇阻断内源性氧化物酶,孵育30 min,加入PBS洗片。加入含有0.1%TritonX-100的0.1%的枸橼酸钠溶液作为通透液,放置于冰盒中孵育2 min,小心吸除液体,加入转化剂过氧化物酶(POD)50 μl,盖上盖玻片,37℃于湿盒中反应30 min,洗片。加入100 μl二氨基联苯胺(DAB)显色剂显色,室温静置15 min,用酒精脱水后,用二甲苯透明封片。同时设置对照组。显微镜下观察细胞核为棕红色为阳性,计算凋亡率。凋亡率的计算方法:胞核为红棕色的细胞数与总细胞数量的百分比。
1.2.4 RT-PCR检测细胞中β-catenin、GSK-3β、c-myc的表达 食管癌细胞Eca-109经8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L的姜黄素作用48 h后,PBS洗涤细胞,加入适量的Trizol Reagent裂解食管癌细胞,用氯仿抽提,吸取水相层到新EP管中,加入异丙醇混匀,12 000 r/min离心15 min。用提前预冷的乙醇洗涤,放置于室温下风干,用RNAse free溶解RNA,保存于-80℃备用。用紫外分光光度计检测RNA纯度及浓度,OD260 nm/OD280 nm比值1.8~2.0认为RNA纯度很高。反转录系统合成β-catenin、GSK-3β、c-myc的cDNA。PCR扩增β-catenin、GSK-3β、c-myc的cDNA。扩增产物经1.5%琼脂糖凝胶电泳后,EB染色,凝胶系统成像。运用Image J分析目的基因表达率。
1.2.5 Western印迹检测药物作用后Eca-109细胞中β-catenin、GSK-3β、c-myc表达 取对数生长期的食管癌细胞Eca-109经胰蛋白酶消化后,接种于6孔细胞培养板中,观察细胞贴壁后,弃细胞培养液,加入姜黄素终浓度为8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L的培养基,37℃,CO2培养箱中培养48 h。PBS洗涤2次,加入胰蛋白酶消化细胞,将细胞悬液转移到新的EP管中,PBS重悬细胞。按照细胞总蛋白提取试剂盒步骤提取细胞蛋白。按照蛋白浓度测定试剂盒操作步骤测定提取的蛋白浓度。在蛋白样品中加上样缓冲液混合后,煮沸变性5 min。每孔中加50 μl样品,电压80 V,marker进入分离胶后,将电压升高至120 V,电泳结束后将蛋白凝胶取出,滤纸、凝胶、聚偏氟乙烯(PVDF)膜、滤纸依次夹好,4℃转膜过夜。取膜,Tris盐酸缓冲液(TBST)洗膜3次,5%脱脂奶粉室温封闭2 h。加入一抗4℃过夜,TBST洗膜,加入二抗室温下孵育1.5 h。TBST洗膜后,显影,通过Odyssey扫描系统分析蛋白表达量。
2 结 果
2.1 MTT法检测细胞抑制情况 作用时间为24、48、72 h的8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L浓度的姜黄素作用食管癌细胞Eca-109后的抑制率与对照组相比均差异显著(P<0.05)。姜黄素对食管癌Eca-109细胞的抑制作用随着作用时间和作用浓度的增加而增加。计算姜黄素作用24 h IC50为28.1 μmol/L、48 h IC50为23.2 μmol/L、72 h IC50为15.6 μmol/L。见表1。
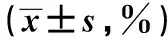
表1 MTT法检测姜黄素作用后食管癌Eca-109细胞的 抑制率
与对照组比较:1)P<0.05
2.2 TUNEL检测姜黄素作用后的食管癌细胞凋亡情况 姜黄素浓度为8 μmol/L、16 μmol/L、32 μmol/L、64 μmol/L与细胞Eca-109作用48 h后,TUNEL检测细胞凋亡率分别为0.325 4±0.011 5,0.451 9±0.021 4,0.681 6±0.017 8,0.853 4±0.021 7。对照组的细胞凋亡率为0.056 5±0.002 7。各浓度姜黄素作用后的细胞Eca-109凋亡率与对照组相比均差异显著(P<0.05)。姜黄素可以促进食管癌Eca-109细胞凋亡。
2.3 RT-PCR检测药物作用后细胞中β-catenin、GSK-3β、c-myc的mRNA的表达 8、16、32、64 μmol/L姜黄素作用后β-catenin、GSK-3β、GSK-3β、c-myc的表达率与对照组相比差异显著(P<0.05)。姜黄素可以抑制食管癌细胞Eca-109中β-catenin、c-myc的转录,随着作用浓度的增加,抑制作用加强。姜黄素可以促进食管癌细胞Eca-109中GSK-3β的转录,随着作用浓度的增加,促进作用加强。见表2。
2.4 Western印迹检测β-catenin、GSK-3β、c-myc的表达 各浓度姜黄素作用后的Eca-109细胞中β-catenin蛋白表达率、GSK-3β蛋白表达率、c-myc蛋白表达率与对照组相比差异显著(P<0.05)。姜黄素可以抑制β-catenin、c-myc蛋白的表达,且随着作用浓度的增加抑制作用增强。姜黄素可以促进GSK-3β蛋白的表达,且随着作用浓度的增加促进作用增强。见表3,图1。
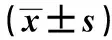
表2 RT-PCR检测姜黄素作用后细胞中β-catenin、 GSK-3β、c-myc 表达率
与0 μmol/L比较:1)P<0.05;与0 μmol/L比较:2)P<0.01,下表同
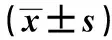
表3 Western印迹检测药物作用后细胞中β-catenin、 GSK-3β、c-myc蛋白表达率
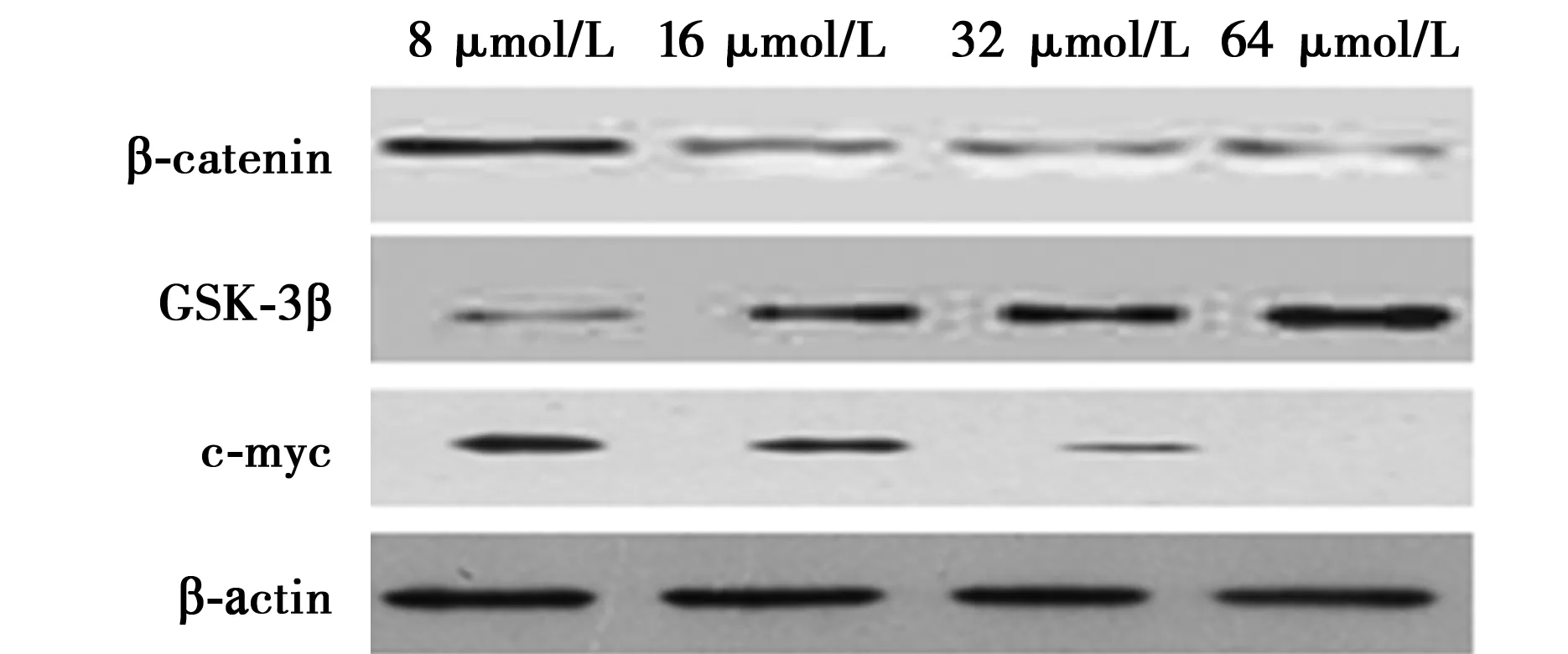
图1 Western印迹检测药物作用后细胞中β-catenin、 GSK-3β、c-myc蛋白表达
3 讨 论
姜黄素是一种用从姜科植物中提取的植物色素。姜黄素的药用历史悠久,具有多种药用价值,在治疗胸胁刺痛、风湿引起的肩膀疼痛、闭经、跌打肿痛等方面疗效显著。另外姜黄素还可以调节血脂、消炎、抗纤维化、抗动脉硬化、预防癌症、治疗癌症。姜黄素有多种用途,在临床上也具有极高的应用价值〔5〕。由于姜黄素提取至植物中,副作用小,姜黄素的抗肿瘤功效越来越成为研究热点。研究表明,姜黄素具有抑制肿瘤细胞增殖,促进肿瘤细胞凋亡等作用〔6〕。
细胞凋亡是一种正常情况下的细胞程序性死亡,受多基因调控〔7〕。细胞凋亡与细胞坏死不同,细胞凋亡是一种严格程序下细胞自我毁灭的死亡。细胞凋亡涉及一系列复杂的过程,受多种机制调控,与多种信号通路有关,受多种凋亡因子作用。正常情况下,细胞的增殖与凋亡处于动态平衡状态〔8〕。肿瘤的发生是肿瘤细胞增殖与凋亡平衡被打破造成的。研究表明,姜黄素可以通过作用于细胞线粒体,改变细胞线粒体膜通透性,细胞色素C趁机被释放而引起细胞凋亡〔9〕。另外,姜黄素可以促进凋亡基因Bax的表达,抑制Bcl-2转录而促进细胞凋亡。本研究显示药物作用后的食管癌Eca-109细胞增殖作用明显减弱,药物浓度越大,姜黄素抑制作用越明显,药物作用时间越长,姜黄素抑制作用也越明显。TUNEL结果显示,姜黄素可以促进食管癌Eca-109细胞凋亡。
Wnt信号通路与细胞的增殖分化有密切关系。Wnt信号通路是由跨膜蛋白(Fz)、Wnt、大肠腺瘤息蛋白(APC)、β-catenin等组成,这些蛋白分子将信号从细胞表面传递至细胞内。β-catenin的多少决定了Wnt信号通路开启还是关闭〔10〕。当细胞内β-catenin蛋白表达水平升高,Wnt信号通路开启,β-catenin蛋白表达水平降低,Wnt信号通路关闭。β-catenin蛋白的表达受相关因子的调控,GSK-3β、APC可以阻碍β-catenin蛋白作用,而散乱蛋白(Dishevelled)可以促进β-catenin蛋白的作用。正常情况下,细胞浆内的一部分β-catenin蛋白结合在细胞膜上,另一部分蛋白被GSB-3β、APC、Axin复合物降解。当Wnt蛋白与Frzzelds、LRP-5、LRP-6形成的跨膜受体结合,降解GSB-3β、APC、Axin形成的复合物,使β-catenin蛋白降解受阻。聚集在细胞质中的β-catenin蛋白受到相关转录因子作用进入细胞核,促进癌基因的恶性增殖。其中GSB-3β是细胞质中β-catenin升高的关键酶,可以负调控β-catenin蛋白〔11〕。c-myc是信号通路Wnt的一个靶基因,在细胞持续增殖过程中起重要作用,属于细胞核内的癌基因。当信号通路Wnt激活后,靶基因c-myc被激活,大量表达,细胞恶性增殖〔12〕。
本研究提示姜黄素可以抑制食管癌Eca-109细胞的增殖分化,通过干扰细胞周期,促进细胞凋亡。姜黄素能促进GSB-3β的表达而促进β-catenin降解,减少细胞中β-catenin的含量从而阻碍c-myc癌基因表达,干扰癌细胞的Wnt信号通路,抑制癌细胞增殖。
1 谢天鹏,向 润,杨晓军.食管癌术后一年内复发的特点及相关因素分析〔J〕.中华肿瘤杂志,2016;38(2):146-9.
2 王静瑞,谢小娟,朱永锋.姜黄素对大鼠体外循环所致急性肺损伤中细胞凋亡及CCAAT/增强子结合蛋白同源蛋白的影响〔J〕.中华实验外科杂志,2016;33(1):118-21.
3 冀润利,陈 凯,许 威.姜黄素抑制胰腺癌转移的实验研究〔J〕.中华胰腺病杂志,2016;16(1):15-8.
4 陈 明,董启榕.Wnt与转化生长因子-β信号在成骨细胞分化中的相互作用〔J〕.中华实验外科杂志,2016;33(3):864-8.
5 高梦丹,林敬铨,童 亮.姜黄素抑制NF-κB信号通路对脊髓损伤修复作用的研究进展〔J〕.中国药理学与毒理学杂志,2016;30(3):272-7.
6 彭 琳,李利锋,韩 刚.载姜黄素羧甲基壳聚糖纳米粒的制备和性能〔J〕.中国医药工业杂志,2016;47(2):178-82.
7 李胜男,李 伟,周冬梅.血糖波动对糖尿病大鼠小肠上皮细胞凋亡的影响及可能机制〔J〕.中国老年学杂志,2016;36(7):1598-600.
8 申 薇,梁冰锋,秦金金.那可丁联合顺铂对人卵巢癌SKOV3细胞增殖及凋亡的影响〔J〕.中国老年学杂志,2016;36(2):303-5.
9 连 洁,洪广亮,仝 欢.姜黄素上调线粒体融合蛋白2抑制脓毒症小鼠淋巴细胞凋亡的实验研究〔J〕.中华急诊医学杂志,2016;25(2):153-9.
10 时 汀,张建淮.IWR-1对人肝癌细胞株Hep3B的增殖及Wnt/β-catenin信号通路的抑制作用〔J〕.肿瘤防治研究,2016;43(3):207-10.
11 兰 玲,邓 微,陈海翎.β-catenin核易位遏制人甲状腺癌细胞中钠碘转运体膜定位的实验观察〔J〕.中华医学杂志,2016;96(11):891-6.
12 周小青,曹泽标,刘旺华.丹龙醒脑方对脑缺血再灌注大鼠侧脑室室管膜下区神经干细胞增殖与c-myc、c-jun表达的影响〔J〕.中国中医药信息杂志,2016;23(4):49-53.
〔2016-06-21修回〕
(编辑 袁左鸣)
李立德(1981-),男,主治医师,主要从事食道癌研究。
金宇斌(1973-),男,副主任医师,主要从事食道癌研究。
R735
A
1005-9202(2017)04-0806-04;
10.3969/j.issn.1005-9202.2017.04.010
1 牡丹江医学院第二附属医院教研科
