嗜线虫致病杆菌YL001抑菌活性成分及其产量影响因素的研究
2017-03-23李忝珍张淑静王永宏
许 鹏,李忝珍,张淑静,刘 启,王永宏,张 兴
(西北农林科技大学 无公害农药研究服务中心,陕西杨凌 712100)
嗜线虫致病杆菌YL001抑菌活性成分及其产量影响因素的研究
许 鹏,李忝珍,张淑静,刘 启,王永宏,张 兴
(西北农林科技大学 无公害农药研究服务中心,陕西杨凌 712100)
采用硅胶柱层析等分离方法,结合MS与NMR技术,对嗜线虫致病杆菌YL001发酵产物中的抑菌活性成分进行分离鉴定;采用微量稀释法对Nematophin的抑菌活性进行测定;利用HLPC分析不同因素对Nematophin产生的影响。结果表明,分离得到主要抑菌活性物质 Nematophin,并鉴定其结构为3-吲哚乙基(3′-甲基-2′-酮)戊酰胺,其对革兰氏阳性菌具有较好的抑菌活性;不同菌株发酵产物中Nematophin的产量不同,其中YL001菌株的产量最高,为115.23 μg/mL;Nematophin产量在初始pH 4.5~8.5逐渐升高,初始pH 8.5时最高,为155.08 μg/mL。发酵罐培养条件下Nematophin的产量高于摇瓶,且在初始pH 8.5时达到最高,为206.97 μg/mL。主要抑菌活性物质与文献报道的 Nematophin相同,昆虫病原线虫共生菌次生代谢物的产生与菌种、菌株及培养条件密切相关。
嗜线虫致病杆菌;分离;抑菌活性;Nematophin
昆虫病原线虫共生细菌是寄生于昆虫病原线虫肠道内的一种革兰氏阴性细菌,包括致病杆菌(Xenorhabdus)和发光杆菌(Photorhabdus)属,分别与斯氏线虫(Steinernema)和异小杆线虫(Heterorhabditis)共生,属肠杆菌科(Enteobacteriaceae)[1],存在于侵染期线虫肠道内,在昆虫血腔内繁殖,产生毒素并分解昆虫的营养物质,使其患败血症死亡[2-3]。共生菌能产生多种次生代谢产物,这些代谢产物不仅具有多种化学结构,而且在医药和农业上具有广泛的生物活性[4]。目前已从致病杆菌(Xenorhabdus)和发光杆菌(Photorhabdus)中分离鉴定出40多种具有生物活性的代谢产物,这些代谢产物化学结构多样,在医药和农业上有广泛的生物活性,如抗细菌和真菌、杀虫、杀线虫、抗溃疡、抗肿瘤和抗病毒[4-6]作用。线虫共生菌次生代谢物的产生与菌种、菌株及培养条件密切相关。不同种致病杆菌产生的抑菌物质有较大差异;同一菌株在不同培养条件下的代谢也有一定差异[5-10]。培养基供给共生菌生长、繁殖、代谢和合成抑菌物质所需要的营养物质,它的成分和组分含量对共生菌的生长及抑菌物质的产生等均有较大影响;不同共生菌对营养物质的要求各不相同,同一菌种在不同生长阶段对营养的需求也有一定差异。另外,发酵条件也是影响发酵过程中各种化学及生物学反应的环境因素,主要包括pH、发酵时间、种龄、接种量、通气和温度等[11]。发酵条件不同产生的代谢产物同样存在差异。
嗜线虫致病杆菌YL001(XenorhabdusnematophilaYL001)是西北农林科技大学无公害农药研究中心分离得到的一株对植物病原菌有较强抑制作用的昆虫病原线虫共生菌[12],前期研究[13]发现YL001菌株发酵上清液乙酸乙酯粗提物对多种病原菌具有较好的抑制效果,随着初始pH的升高,其发酵液和乙酸乙酯提取物的抑菌活性也逐步提高,初始pH可以显著影响X.nematophilaYL001的抑菌活性及代谢,碱性条件更有利于活性物质的产生[14]。因此,为明确不同酸碱条件下YL001菌株抑菌物质产生的差异,本文对该菌株的发酵液乙酸乙酯粗提物中主要抑菌活性物质进行分离,通过波谱分析鉴定其化学结构,并进行不同菌株和不同培养条件下Nematophin的HPLC定量分析,研究结果为该菌的产业化奠定基础。
1 材料与方法
1.1 供试菌株与培养基
1.1.1 供试菌株 嗜线虫致病杆菌XenorhabdusnematophilaYL001(简称YL001)由西北农林科技大学无公害农药研究服务中心提供;嗜线虫致病杆菌(Xenorhabdusnematophila) AN6、ALL、A24(简称AN6、ALL、A24)和伯氏致病杆菌(Xenorhabdusbovienii) X-7(简称X-7)由广东省昆虫研究所提供。
1.1.2 供试病原菌 大肠杆菌(Escherichiacoli)、蜡状芽孢杆菌(Bacilluscereus)、枯草芽孢杆菌(Bacillussubtilis)、金色葡萄球菌(Staphylococcusaureus)、白菜软腐病菌(Erwiniacarotorora)、水稻白叶枯病菌(Xanthomonasoryzaepv.oryzae)、猕猴桃溃疡病菌(Pseudomonassyringaepv.actinidae)均由西北农林科技大学无公害农药研究服务中心提供。
1.1.3 培养基 鉴别培养基[15]NBTA:牛肉膏3 g/L,蛋白胨5 g/L,营养琼脂 15 g/L,溴麝香百里酚兰 0.025 g/L,氯化三苯基四氮唑 0.04 g/L,pH7.0。
种子培养基LB:胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,pH 7.0。
发酵培养基TSB:胰蛋白胨17 g/L,大豆胨3 g/L,NaCl 5 g/L,磷酸氢二钾2.5 g/L,葡萄糖2.5 g/L,pH 7.0。
病原细菌培养基(NA培养基):牛肉膏3 g/L,蛋白胨5 g/L,营养琼脂15 g/L,pH 7.0。
各处理发酵培养基初始pH分别用0.1 mol/L NaOH和0.1 mol/L HCl调节,其余培养基pH 7.0。
1.2 试验方法
1.2.1 发酵培养 种子制备:挑取种管保存的共生菌单菌落于LB培养基,在28 ℃、180 r/min活化24 h后划线于NBTA平板,25 ℃培养48 h,观察菌落的颜色变化,区分初生型和次生型共生菌。菌落为蓝色,周围培养基中的染料被吸收变为黄色的为初生型;菌落为红色,周围培养基中染料不被吸收而保持蓝色的为次生型。用接种环挑取初生型菌,接种于LB培养基,28 ℃、180 r/min振荡培养至OD600 nm为2.00,作为种子。
摇瓶发酵:按9%的接种量将种子接于装有100 mL发酵培养基的500 mL摇瓶中,在摇床转速180 r/min、28 ℃条件下培养。
发酵罐发酵:使用镇江东方生物工程设备技术公司生产的GUJS-7B型5 L全自动控制发酵罐进行发酵。发酵罐容积5 L,2层6平直叶搅拌器,3挡板。装料系数0.75,接种量9%,发酵温度28 ℃,通气量2.5 L/min,搅拌转速200 r/min,发酵过程中流加泡敌消泡。
1.2.2 乙酸乙酯粗提物的制备 取低温保存共生菌发酵液,调pH除去蛋白后9 000 r/min、4 ℃离心30 min,发酵上清液用乙酸乙酯萃取4次,萃取液通过无水硫酸钠柱后浓缩蒸干,备用,干物质量浓度为625 mg/L。
1.2.3 柱层析分离 采用柱层析分离方法对乙酸乙酯粗提物进行分离,以枯草芽孢杆菌(B.subtilis)作为指示菌,利用琼脂扩散法[12-13]进行抑菌活性追踪。
1.2.4 波谱测定 质谱(MS)用电子轰击质谱(EI-MS)测定,核磁结构测定用Bruker-ADVANCE III500核磁共振仪,红外光谱(IR)用Shimadzu IR-外光谱仪测定,高效液相色谱仪(996,Waters公司)Thermo 反向C18柱(4.6 mm× 250 mm,5 μm);流动相为[V(乙腈)∶V(水)]= 65∶35(水中含φ=0.1%甲酸);流速1.0 mL/min;检测波长为254 nm。
1.2.5 抑菌活性物质的生物活性测定 采用琼脂稀释法[16]测定分离所得化合物Nematophin对细菌的最小抑制质量浓度(MIC)。
1.2.6 Nematophin HPLC定量分析 各处理干样分别溶于1 mL甲醇至4 ℃冰箱,备用。每个处理3次重复。HPLC定量分析采用外标法,液相色谱仪(600,Waters公司)Thermo 反向C18柱(4.6 mm× 250 mm,5 μm);流动相:0~2 min为10%乙腈,2~20 min为10%~40%乙腈,20~40 min为40%~100%乙腈,40~45 min为100%~10%乙腈,45~55 min为10%乙腈;流速1.0 mL/min;检测波长为254 nm;进样量10 μL;柱温30 ℃。
以不同质量浓度标准品Nematophin建立标准曲线来测定各样品中Nematophin的产量。
1.2.7 数据分析 作图采用Excel 2007及Empower软件,方差分析采用SPSS 22.0。
2 结果与分析
2.1 抑菌活性物质的提取、分离和纯化
将乙酸乙酯粗提物硅胶柱层析,分别用石油醚、乙酸乙酯、三氯甲烷进行洗脱,得到3个组分,采用活性追踪法,对有活性的三氯甲烷洗脱组分进行进一步柱层析分离,得到抑菌活性物质纯品;液相检测其纯度为99.6%,如图1所示。
2.2 结构鉴定及理化性质
Electron impact MS质谱显示,相对分子质量为272.04,结合NMR信息(表1)及红外光谱结果确定分子式为C16H20N2O2,与已报道主要抑菌化合物Nematophin[16]结构一致。结构如图2所示,Nematophin为白色晶体,易溶于乙酸乙酯、氯仿、丙酮和甲醇,微溶解于石油醚,不溶于水。在中性和碱性条件下稳定。
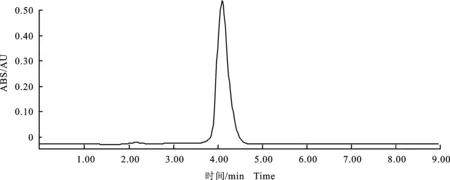
图1 Nematophin液相图Fig.1 HPLC result of Nematophin

位置编号Positionno氢谱1H-NMR碳谱13C-NMRNH8.03(lH,bs)1-NH7.11(1H,bd,J=3.0Hz)27.07(1H,bd,J=3.0Hz)112.33112.647.66(1H,dd,J=9.8Hz,0.75Hz)118.757.27(1H,td,J=10.1Hz,1.5Hz)122.067.18(1H,td,J=9.9Hz,1.3Hz)119.677.44(1H,d,J=10.0Hz)111.38127.29136.5103.07(2H,t,J=5.1Hz)25.5113.70(2H,q,J=5.0Hz)39.61’202.42’160.13’3.55(1H,sext,J=4.9Hz)40.44’1.79(1H,m)25.21.46(1H,m)5’11.53’-CH315.2
2.3 Nematophin的抑菌活性测定
由表2可知,Nematophin对革兰氏阳性细菌具有较高的抑菌活性,对革兰氏阴性菌活性较差;其中对金黄色葡萄球菌具有较好的抑制作用,其MIC为2.5 μg/mL;对猕猴桃溃疡病菌及大肠杆菌表现出较低的抑制活性。

图2 Nematophin结构式Fig.2 Sructure of Nematophin
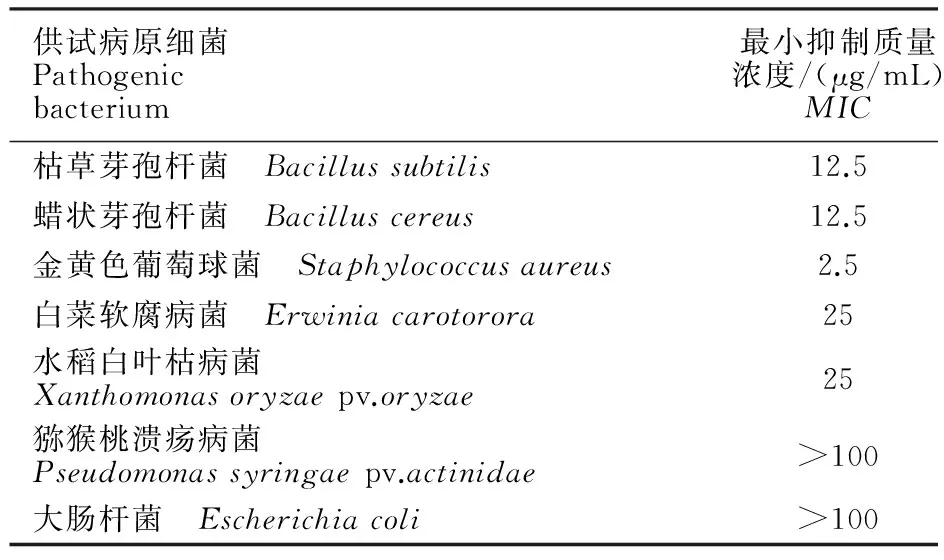
供试病原细菌Pathogenicbacterium最小抑制质量浓度/(μg/mL)MIC枯草芽孢杆菌 Bacillussubtilis12.5蜡状芽孢杆菌 Bacilluscereus12.5金黄色葡萄球菌 Staphylococcusaureus2.5白菜软腐病菌 Erwiniacarotorora25水稻白叶枯病菌Xanthomonasoryzaepv.oryzae25猕猴桃溃疡病菌Pseudomonassyringaepv.actinidae>100大肠杆菌 Escherichiacoli>100
2.4 致病杆菌不同菌种及菌株中Nematophin 的HPLC定量分析
由表3可知,不同菌种及菌株间Nematophin的产量存在较大差异,其中伯氏致病杆菌X.bovieniiX-7不产生Nematophin;在X.nernatophila的各菌株中,Nematophin 的产量随发酵时间的延长逐渐升高。其中,YL001菌株中Nematophin的产量最高,A24菌株中Nematophin的产量最低。
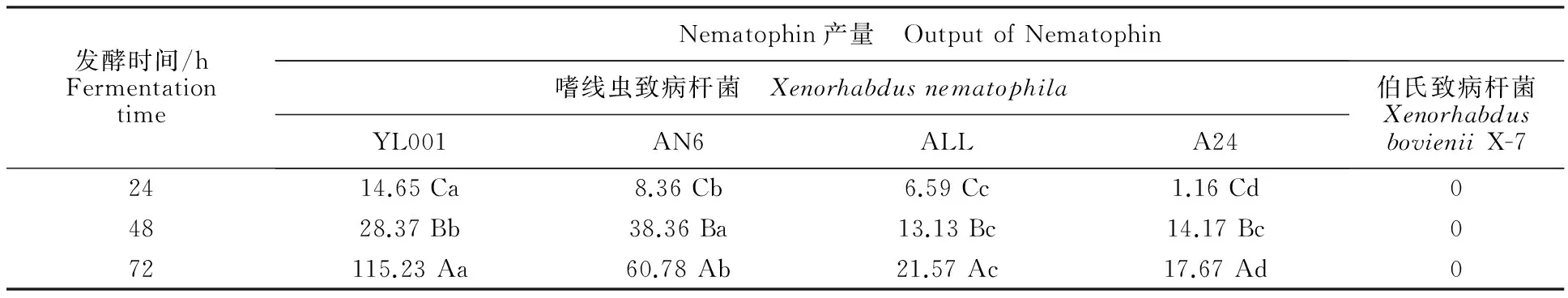
表3 致病杆菌不同菌种及菌株中Nematophin 的产量Table 3 Nematophin in different species and strains of Xenorhabdus μg/mL
注:数据均为3次重复平均值,采用Duncan’s,同列数据后不同大小写字母表示差异显著(P<0.01),同行数据后不同小写字母表示差异显著(P<0.05)。下表同。
Note: Data is the average of 3 duplications, and different capital and small letters followed after data in each column mean significant difference atP<0.01 andP<0.05,respectively.The same as below.
2.5 不同初始pH条件下YL001菌株发酵产物中Nematophin 的HPLC定量分析
2.5.1 摇瓶发酵培养 由图3可知,Nematophin产量随初始pH的升高(4.5~8.5)呈升高趋势,pH为8.5时达到最高,为155.08 μg/mL ;pH为9.5时Nematophin的产量突然降低,说明中性及偏碱性条件下更有利于Nematophin的产生。
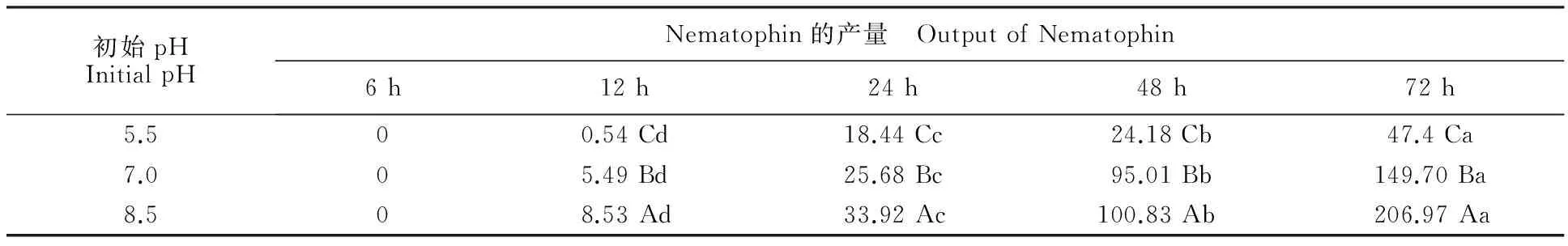
2.5.2 发酵罐发酵培养 由表4可知,Nematophin产量随初始pH的升高(5.5~8.5)呈升高趋势,在同一pH条件下,Nematophin产量随时间呈升高趋势,在初始pH为8.5时达到最高(206.97 μg/mL),与摇瓶发酵时不同初始pH条件下YL001菌株中Nematophin产量变化的结果相似,但明显高于摇瓶发酵初始pH为8.5时的产量(155.08 μg/mL)。

图3 不同初始pH条件下Xenorhabdus nematophila YL001中Nematophin的产量Fig.3 Nematophin of Xenorhabdus nematophila YL001 in different initial pH
表4 不同初始pH条件下XenorhabdusnematophilaYL001中Nematophin 的产量
Table 4 Nematophin ofXenorhabdusnematophilaYL001 in different initial pH μg/mL
3 结论与讨论
本研究鉴定的X.nematophilaYL001菌株代谢产物主要抑菌活性物质的结构与Nematophin[16]一致,对其进行生物活性测定发现,Nematophin对革兰氏阳性及革兰氏阴性菌都有一定的抑制作用,尤其对革兰氏阳性菌表现出较好的活性,对枯草芽孢杆菌的MIC(12.5 μg/mL)与文献[16]中Nematophin对枯草芽孢杆菌的MIC(12 μg/mL)结果接近;对金黄色葡萄球菌MIC为2.5 μg/mL比文献[16]中Nematophin对金黄色葡萄球菌MIC为1.5 μg/mL高。Seunguk等[17]测定Nematophin对金黄色葡萄球菌MIC为0.391 μg/mL,可能由于不同菌株的金黄色葡萄球菌对Nematophin敏感性不同;该化合物对植物病原真菌灰霉病菌及疫霉病菌也表现出较好的抑制MIC(12 μg/mL)[16],Nematophin具有较好的开发前景,它对植物病原真菌的抑制作用还需进一步研究。此外,国内曾报道[18]该化合物还有较好的抗肿瘤活性。
共生菌次生代谢物的产生与菌种、菌株及培养条件密切相关。不同种的致病杆菌产生的抑菌物质有较大的差异,本研究中发现,Nematophin的产量随菌株的不同而表现明显差异,嗜线虫致病杆菌YL001菌株在相同培养条件下Nematophin产量最高,而伯氏致病杆菌X-7的代谢产物中没有检测到Nematophin,但是前期研究中发现致病杆菌X-7代谢产物乙酸乙酯提取物也表现出较好的抑菌活性,可能是有其他的抑菌化合物存在;说明同属不同种或同种不同菌株,在相同培养条件下产生的抗菌物质有很大差别。
同一菌株在不同培养条件下的代谢也有一定差异。初始pH作为细菌生长的重要影响因子,对共生菌细胞生长、产物积累以及生物活性同样具有重要的影响[19]。本研究发现,不同初始pH培养条件下,在一定范围内Nematophin的产量随pH的升高而升高,初始pH 8.5时,Nematophin产量达到最高,这与郭树奇[14]通过LC-MS分析YL001菌株在不同pH条件下Nematophin产量的结果(pH 8.5时Nematophin的产量为pH 4.5时的17.52倍)一致;发酵罐培养条件下Nematophin产量明显高于摇瓶发酵。
嗜线虫致病杆菌次生代谢物Nematophin的产生与菌种、菌株及培养条件密切相关。不同种致病杆菌产生的抑菌物质有较大差异,同一菌株在不同培养条件下的代谢也有一定差异,为今后工业化开发具有指导意义。
Reference:
[1] GAUGLER R.Entomopathogenic Nematology [M].New York: CABI Publishing,2002.
[2] MARTENS E C,HEYNGENS K,GOODRICH B H.Early colonization events in the mutualistic association betweenSteinernemacarpocapsae nematodes andXenorhabdusnematophilabacteria [J].JournalofBacteriology,2003,185(10):3147-3154.
[3] WATERFIELD N R,BOWEN D J,FETHERSON J D,etal.The toxin complex genes ofPhotorhabdus: a growing gene family [J].TrendsinMicrobiology,2001,9(4):185-191.
[4] CHEN G,MAXWELL P,DUNPHY G B,etal.Culture conditions ofXenorhabdusandPhotorhabdussymbionts of Entomopathogenic nematodes[J] .Nematologica,1996,42(1):124-130.
[5] QIU X,HAN R,YAN X ,etal.Identification and characterization of a novel gene involved in the trans-Specific nematicidal activity ofPhotorhabdusluminescensLN2 [J].AppliedandEnvironmentalMicrobiology,2009,75(12):4221-4223.
[6] BERNIE V,MCLNERNEY W C,TAYLOR M J,etal.Biologically active metabolites fromXenorhabdusspp.,part 2.Benzopyran-1-one derivatives with gastroprotective activity [J].JournalofNaturalProducts,1991,54(3):785-795.
[7] LANG G,KALVELAGE T,PETERS A,etal.Linear and cyclic peptides from the Entomopathogenic bacteriumXenorhabdusnematophilus[J].JournalofNaturalProducts,2008,71(6):1074-1077.
[8] GUALTIERI M,AUMELAS A,THALER J O.Identification of a new antimicrobial lysine-rich cyclolipopeptide family fromXenorhabdusnematophila.[J].TheJournalofAntibiotics,2009,62(6):295-302.
[9] FUCHS S W,PROSCHAK A,JASKOALL T W,etal.Structure elucidation and biosynthesis of lysine-rich cyclic peptides inXenorhabdusnematophila[J].Organic&BiomolecularChemistry,2011,9(9):3130-3132.
[10] 杨秀芬,杨怀文,简 恒,等.嗜线虫致病杆菌产生抗生素的培养基及条件 [J].微生物学通报,2001,28(1):12-16.
YANG X F,YANG H W,JIAN H,etal.Effect of fermentation conditions on antibiotic production ofXenorhabdusnematophila[J].MicrobiologyChina,2001,28 (1):12-16(in Chinese with English abstract).
[11] FANG X L,HAN L R,CAO X Q,etal.Statistical optimization of process variables for antibiotic activity ofXenorhabdusbovienii[J].PLosOne,2012,7(6):e38421.
[12] 王永宏,张 兴.2株昆虫病原线虫共生菌代谢物的抑菌作用[J].西北农林科技大学学报(自然科学版),2007,35(2):125-130.
WANG Y H,ZHANG X.Studies on antimicrobial activity of metabolites of symbiotic bacteria associated with Entomopathogenic nematodes [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2007,35(2):125-130(in Chinese with English abstract).
[13] 许 贤,王永宏,刘 霞,等.昆虫病原线虫共生菌筛选及其发酵液抑菌活性初步研究[J].西北农林科技大学学报(自然科学版),2006,34(7):50-54.
XU X,WANG Y H,LIU X,etal.Entomopathogenic nematodes symbiotic bacteria screening and preliminary study of the fermented liquid antibacterial activity[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2006,34(7):50-54(in Chinese with English abstract).
[14] 郭树奇.pH调控嗜线虫致病杆菌抑菌活性机理的初步研究[D].陕西杨凌:西北农林科技大学,2015.
GUO SH Q.Study on antibacterial mechanism ofXenorhabdusnematophilaregulated by pH [D].Yangling Shaanxi: Northwest A&F University,2015(in Chinese with English abstract).
[15] AKHURST R J.Morphological and functional dimorphism inXenorhabdusspp.,bacteria symbiotically associated with the insect pathogenic nematodesNeoaplectanaandHeterorhabditis[J].Microbiology,1980,121(2):303-309.
[16] LI J,CHEN G,WEBSTER J M.Nematophin,a novel antimicrobial substance produced byXenorhabdusnematophila(Enterobacteriaceae) [J].CanadianJournalofMicrobiology,1997,43(8):770-773.
[17] SEUNGUK P,MYUNG K P,SEONG H J,etal.Isolation and synthesis of tryptamine derivatives from a symbiotic bacteriumXenorhabdusnematophilusPC [J].BulletinoftheKoreanChemicalSociety,2003,24(5):623-626.
[18] 吕秋军,简 恒,刘卫京,等.从嗜线虫杆菌分离的吲哚衍生物抗肿瘤活性的研究[J].中国新药杂志,2002,11(11):850-852.
LÜ Q J,JIAN H,LIU W J,etal.Study on the anti-tumor activity of an indole derivative isolated fromXenorhabdus[J].ChineseJournalofNewDrug,2002,11(11): 850-852(in Chinese with English abstract).
[19] WANG Y H,FANG X L,CHENG Y P,etal.Manipulation of pH shift to enhance the growth and antibiotic activity ofXenorhabdusnematophila[J].JournalofBiomedicineandBiotechnology,2011(1):137-143.
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Antimicrobial Active Constituents and Its Yield Influencing Factors ofXenorhabdusnematophilusYL001
XU Peng, LI Tianzhen, ZHANG Shujing, LIU Qi, WANG Yonghong and ZHANG Xing
(Research and Development Center of Biorational Pesticides, Northwest A&F University, Yangling Shaanxi 712100, China)
The active ingredients from fermentation broth ofXenorhabdusnematophilusYL001 were isolated and purified by column chromatography and other extraction process, and their structures were identified by MS and NMR spectra.The minimal inhibitory concentrations (MIC) against bacteria of the purified Nematophin were detected by broth dilution technique.Analyzing the yield influencing factors of Nematophin by using HPLC.The factors related to Nematophin production, including different strains of the same species and culture conditions, were also explored.The results showed that one antibacterial ingredient was isolated from fermentation broth ofXenorhabdusnematophilusYL001 and identified as Nematophin with a chemical name of 3-indoleethyl (3′-methyl-2′-oxo)pentanamide which possesses significant activity against Gram-positive bacteria.The output of Nematophin was different fromXenorhabdusneamatophilastrains, and the highest yield of Nematophin was obtained from YL001 strain, which was 115.23 μg/mL.The yield of Nematophin increased in the range of initial pH 4.5 to pH 8.5, and the highest yield, 155.08 μg/mL, was obtained at pH 8.5.The yield of Nematophin was higher in fermentation tank than in the Erlenmeyer flask, and the highest yield,206.97 μg/mL, of Nematophin was obtained in fermentation tank at pH 8.5.In conclusion, the main ingredient inXenorhabdusneamatophilawas designated as Nematophin identified by former documents, the secondary metabolites of the insect pathogenic nematode symbiotic bacteria is closely related to the bacteria, strain, and the cultured conditions.
Xenorhabdusneamatophila;Isolation;Antibacterial activity;Nematophin
XU Peng, male, master student .Research area: pesticide toxicology and microbial metabolism.E-mail:xupeng19900721@126.com
WANG Yonghong, male,research fellow, doctoral supervisor.Research area: microbial pharmaceutical and fermentation technology.E-mail:yhwang@nwsuaf.edu.cn
日期:2016-12-29
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161229.1009.044.html
2015-12-17
2016-01-15
国家自然科学基金(31171910);陕西省自然科学基金重点项目(2014JZ004);中央高校基本科研创新重点项目(ZD2013003)。
许 鹏,男,硕士研究生,研究方向为农药毒理学和微生物代谢。E-mail: xupeng19900721@126.com
王永宏,男,研究员,博士生导师,研究方向为微生物制药及发酵技术。E-mail: yhwang@nwsuaf.edu.cn
S482.2+92
A
1004-1389(2017)02-0317-06
Received 2015-12-17 Returned 2016-01-15
Foundation item The National Natural Science Foundation of China (No.31171910); Key Project of Natural Science Foundation of Shaanxi Province (No.2014JZ004); Central University Basic Research and Innovation Projects (No.ZD2013003).
