β-伴大豆球蛋白α′-亚基的基因克隆及原核表达
2017-03-23许妍妍孙晓静余少璟辰巳英三栾广忠
许妍妍,董 宇,王 新,彭 飞,孙晓静,余少璟,辰巳英三,栾广忠
(1.西北农林科技大学 食品科学与工程学院,陕西杨凌 712100;2.开封市食品药品检验所,河南开封 475000;3.日本国际农林水产业研究中心,日本筑波 305-8686)
β-伴大豆球蛋白α′-亚基的基因克隆及原核表达
许妍妍1,董 宇2,王 新1,彭 飞1,孙晓静1,余少璟1,辰巳英三3,栾广忠1
(1.西北农林科技大学 食品科学与工程学院,陕西杨凌 712100;2.开封市食品药品检验所,河南开封 475000;3.日本国际农林水产业研究中心,日本筑波 305-8686)
为制备N-连接糖基缺失的重组β-伴大豆球蛋白α′-亚基,以‘鲁96150’大豆种子为原料提取总RNA,经RT-PCR一步法获得‘鲁96150’大豆的全长cDNA,采用自行设计的引物F1/F2扩增得到目的基因α′,与pGEM-T easy载体相连构建重组克隆载体pGEM-α′,经XhoⅠ/EcoRⅠ双酶切得到目的基因与载体pET-28a连接构建重组原核表达载体pET-28a-α′,将经菌落PCR、双酶切及测序鉴定正确的表达载体转入感受态细胞E.coliBL21(DE3),经异丙基硫代半乳糖苷(IPTG)诱导表达重组蛋白α′-亚基。对重组α′-亚基的诱导表达条件进行筛选,发现在菌液OD600值为0.8、诱导温度30 ℃、IPTG浓度为0.2 mmol/L的诱导条件下诱导9 h后α′-亚基的表达量较高,重组α′-亚基的分子质量大小约为70 ku;工程菌pET-28a-α′-BL21经超声破碎、离心后发现重组α′-亚基部分存在于上清液中,部分形成包涵体蛋白。重组α′-亚基的克隆及表达为β-伴大豆球蛋白结构及功能特性的研究奠定基础。
β-伴大豆球蛋白;亚基;重组蛋白;克隆;基因表达
β-伴大豆球蛋白(β-conglycinin)是大豆蛋白的主要组分之一,由α′-亚基(71 ku)、α-亚基(67 ku)及β-亚基(50 ku)3种亚基通过疏水作用和氢键构成三聚体;这3种亚基的含量对大豆蛋白的功能特性有显著影响。根据3种亚基氨基酸序列的相似性,α-及α′-亚基在结构上可分为延伸区(extension region)和核心区(core region)而β-亚基不具有延伸区,α′-亚基与α-亚基分别含有2个N-连接的糖基而β-亚基只含有1个N-连接糖基[1-4]。N-连接糖基对β-伴大豆球蛋白α′-亚基功能特性影响的研究较为少见。Maruyama等[5]利用大肠杆菌表达系统制备得到N-连接糖基缺失的重组蛋白α′-亚基及α′-亚基核心区,发现α′-亚基N-连接糖基及延伸区的缺失均不会影响重组α′-亚基自组装成三聚体;β-伴大豆球蛋白是7S大豆球蛋白的主要成分,亲水性较强的糖基可能会阻碍7S大豆球蛋白相互凝聚[6],去除β-伴大豆球蛋白上的糖基可能会提高7S大豆球蛋白的凝胶能力。本研究选取‘鲁96150’大豆种子为原料提取大豆总RNA,利用原核表达系统对β-伴大豆球蛋白的α′-亚基进行克隆与表达,制备得到N-连接糖基缺失的重组α′-亚基,为探究β-伴大豆球蛋白结构与功能性质的关系奠定基础。
1 材料与方法
1.1 试验材料
大豆‘鲁96150’由西北农林科技大学农学院提供;感受态细胞E.coliDH5α,天根生化科技北京有限公司;E.coliBL21(DE3),北京全式金生物技术有限公司(TransGen Biotech);质粒pGEM-T easy,普洛麦格(北京)生物技术有限公司(promega);质粒pET-28a由西北农林科技大学食品学院微生物发酵实验室提供。
1.2 主要试剂与仪器
主要试剂:植物总RNA提取试剂盒、RT-PCR试剂盒、rTaqDNA 聚合酶、DL 2 000 DNA Marker、DL 5 000 DNA M arker、Quick Cut限制性内切酶EcoRⅠ、XhoⅠ,大连TaKaRa公司;蛋白胨、酵母粉,赛默飞世尔科技公司;T4-DNA 连接酶,NEB公司;DNA纯化试剂盒、质粒提取试剂盒、蛋白质分子量Marker(MP102),天根生化科技北京有限公司;琼脂粉、琼脂糖、β-巯基乙醇、异丙基硫代-β-D-半乳糖苷(IPTG)、丙烯酰胺、甲叉丙烯酰胺、十二烷基硫酸钠(SDS),北京索莱宝有限公司,其他试剂均为国产分析纯。
主要仪器:DYY-6C电泳仪,北京六一生物科技有限公司;Hema 9700 PCR 扩增仪,珠海黑马医学仪器有限公司;BIO-RAD Gel Doc XR+凝胶成像仪,美国伯乐BIO-RAD公司。
1.3 试验方法
1.3.1 引物设计与合成 NCBI官网中查找β-伴大豆球蛋白α′-亚基的基因序列(GB 编号为AB234094.1),根据α′-亚基的编码基因序列设计1对引物[5,7],即上游引物F1:5′-CGGAC-GACGACGACAAGGTGGAGGAAGAAGAAG-AA-3′,下游引物F2:5′-CCGCTCGAGTCAGTAAAAAGCCCTCAAAATT-3′。上游引物F1引入肠激酶酶切位点(划横线部分碱基)及相应保护碱基,下游引物F2引入限制性内切酶XhoI酶切位点(划横线部分碱基)、终止密码子(划虚线部分碱基)及相应的保护性碱基,扩增所得基因片段理论大小为 1 683 bp,引物由大连TaKaRa公司合成。
1.3.2 大豆总RNA提取及目的基因扩增 取200 mg‘鲁96150’大豆种子冻干粉提取总RNA,以大豆总RNA 为模板采用试剂盒中随机引物构建cDNA文库。反应条件:42 ℃逆转录30 min,95 ℃保温5 min,4 ℃保温。以cDNA为模板用引物F1/F2扩增得到目的基因α′,采用10 g/L 的琼脂糖凝胶检测后回收目的基因片段,PCR反应体系50 μL:10×PCR BufferⅡ 5 μL,dNTP mixture(10 mmol/L each) 2 μL,上游引物(20 μmol/L)0.5 μL,下游引物(20 μmol/L) 0.5 μL,TaKaRa ExTaqHS(5 U/μL)0.5 μL,上述反转录反应液2.5 μL,无菌纯水补加50 μL。PCR反应条件:94 ℃变性30 s,55 ℃退火2 min,72 ℃延伸2 min,30个循环,最后72 ℃延伸7 min。
1.3.3 重组克隆载体pGEM-α′的构建、筛选及鉴定 利用T4-DNA 连接酶将α′基因片段与克隆载体pGEM-T easy相连,反应体系:α′基因片段3.5 μL,克隆载体pGEM-T easy质粒0.5 μL,T4-DNA 连接酶1 μL,2×T4-DNA连接酶 Buffer 5 μL,总体积为10 μL。将该连接体系置于4 ℃条件下反应14 h后导入到感受态细胞E.coliDH 5α。从含有氨苄青霉素的LB固体培养基中随机挑取单个白色克隆菌落,用于菌落PCR筛选。菌落PCR反应体系(25 μL):13 μL聚合酶 rTaqmix,1 μL单克隆菌株菌液,1 μL上游引物F1,1 μL下游引物F2,补加去离子水至终体积。将筛选得到的阳性克隆菌株接种于氨苄青霉素为100 μg/mL的液体LB培养基中培养并提取质粒,后用10 g/L琼脂糖凝胶电泳及限制性内切酶EcoRⅠ/XhoⅠ双酶切鉴定。首先利用XhoⅠ限制性内切酶对重组质粒酶切1 h,经检测其可被切分成单一条带,之后加入EcoRⅠ限制性内切酶继续酶切。将鉴定结果正确的阳性菌株送样测序(由上海桑尼生物科技有限公司完成),将pGEM-α′测序结果与 GenBank上α′-亚基基因编码区进行序列比对,最终确认重组克隆载体[8]。将构建成功的重组克隆载体命名为pGEM-α′,将测序正确的阳性克隆菌株37 ℃增菌培养后于-80 ℃保存菌种。
1.3.4 重组表达载体pET-28a-α′的构建、筛选及鉴定 将pGEM-α′和pET-28a载体经限制性内切酶EcoRⅠ/XhoⅠ双酶切,酶切反应体系(25 μL):限制性内切酶EcoRⅠ/XhoⅠ各0.5 μL,10×QuickCut Green Buffer缓冲液1 μL,待酶切载体5 μL,补加超纯水至终体积。分别将pGEM-α′与pET-28a的双酶切体系置于37 ℃下反应1 h后回收,双酶切产物用10 g/L琼脂糖凝胶电泳分析鉴定,之后回收带有双黏性末端的目的片段。
将双酶切产物α′和pET-28a在T4-DNA连接酶作用下16 ℃连接14 h,连接体系(20 μL):5 μL双酶切产物α′,3 μL双酶切产物pET-28a,T4-DNA连接酶1 μL,T4-DNA连接酶10×Buffer 2 μL,超纯水9 μL。将连接产物导入E.coliBL21(DE3)中,设置空白与阳性对照。将转化菌液涂布于含卡那霉素(Kana)50 μg/mL固体LB培养基上,37 ℃下培养14 h。随机挑取单克隆菌落,利用引物 F1/F2和T7/T7Ter进行菌落PCR筛选。将阳性菌株接种于含50 μg/mL卡那霉素液体LB培养基中培养并提取质粒,后经电泳及EcoRⅠ/XhoⅠ单酶切及双酶切鉴定,将鉴定结果正确的菌株送样测序。将测序结果正确的重组表达载体命名为pET-28a-α′,阳性菌株命名为pET-28a-α′-BL21,挑选单菌落,37 ℃增菌培养后-80 ℃保存菌种[9-10]。
1.3.5 重组蛋白α′-亚基表达条件的筛选 将培养12 h的pET-28a-α′-BL21菌液按体积分数为1%接种量接种至液体LB培养基(Kana终质量浓度50 μg/mL)中,选取诱导前不同菌液浓度(OD600值为0.2、0.4、0.6、0.8、1.0、1.2、1.4)、不同诱导温度(20、25、30、37 ℃)、不同诱导剂IPTG浓度(0、0.2、0.4、0.6、0.8、1.0、1.2 mmol/L)、不同诱导时间(3、6、9、21、24、27 h)对诱导表达条件进行筛选,取1 mL诱导菌液进行SDS-PAGE检测,用体积分数为12.5%分离胶和体积分数5%浓缩胶,体系为29∶1,利用Quantity One软件分析目的蛋白的表达量[9-11]。
1.3.6 重组蛋白α′-亚基存在形式判定 将pET-28a-α′-BL21培养至菌液OD600值在0.8左右,加入终浓度为0.2 mmol/L的IPTG诱导表达,分别于20、25、30、37 ℃下培养8 h,6 000 r/min离心20 min收集菌体,用磷酸盐缓冲液PBS(25 mmol/L 磷酸钠缓冲液Na2HPO4和NaH2PO4,500 mmol/L NaCl,1 mmol/L EDTA,1 mmol/L PMSF,0.02% NaN3,pH=7.4)重悬后冰浴超声波破碎菌体。超声条件:振幅40,10 s/2 s,10 min,超声4个循环后取出,静置于4 ℃冰箱12 h后,在4 ℃、10 000 r/min 离心15 min,取其上清液为目的蛋白α′的粗蛋白液,于4 ℃保存,将上清和沉淀进行SDS-PAGE分析[11-12]。
2 结果与分析
2.1 大豆总RNA的提取
以大豆 ‘鲁96150’为原料,利用植物总RNA快速提取试剂盒提取大豆总RNA,用10 g/L的琼脂糖凝胶电泳进行鉴定。图1中2条清晰条带分别为28S和18S rRNA,第1个条带(28S)的亮度明显高于第2个条带(18S),所得大豆总RNA可用于RT-PCR。
2.2 目的基因α′-亚基的扩增
以大豆总RNA为模板,利用引物F1/F2经RT-PCR扩增得到目的基因α′。图2中扩增所得基因片段位于2 000 bp与1 500 bp之间与α′-亚基基因的理论大小相符,成功扩增得到α′-亚基基因片段。
2.3 重组克隆载体pGEM-α′的构建、筛选及鉴定
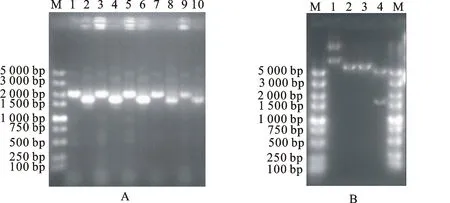
选取编号为1号、2号的单克隆菌株,以自身引物F1/F2和pGEM-T Easy通用测序引物MR(48)/MF(47)对重组克隆载体pGEM-α′进行菌落PCR筛选,结果见图3-A所示,扩增所得条带均与目的基因片段大小一致。图3-B为pGEM-α′经EcoRⅠ/XhoⅠ限制性内切酶单酶切、双酶切结果示意图,泳道1中的重组克隆载体pGEM-α′质粒大小在7 000 bp和4 000 bp之间,与重组克隆载体的理论大小一致;2、3号泳道为pGEM-α′经过EcoRⅠ、XhoⅠ单酶切结果,重组质粒pGEM-α′均能被切成单一条带;EcoRⅠ/XhoⅠ双酶切的4号泳道有2个清晰的条带,一条约为3 000 bp与pGEM-T Easy 载体(2 867 bp)相一致,另一条与RT-PCR扩增所得目的基因片段α′-亚基的位置相一致,由此说明pGEM-α′中目的基因α′的连接方向正确,EcoRⅠ酶切位点成功引入。图3-C中空载体pET-28a经EcoRⅠ/XhoⅠ双酶切和经过XhoⅠ单酶切后均呈单一条带,pET-28a经双酶切后未出现2条基因条带,这可能是因为pET-28a经双酶切后的片段太小而无法检测到[13]。

M.DL 5 000 DNA marker;1.大豆总RNA Total RNA of soybean
图1 大豆总RNA提取结果
Fig.1 Total RNA of soybean

M.DL 5 000 DNA marker;1.α′-亚基基因片段 The gene segment of α′ subunit
图2 目的基因片段α′的扩增结果
Fig.2 Amplification of α′ gene by RT-PCR

A.菌落PCR鉴定 The colony PCR identification;M.DL 5 000 DNA marker;1、3、5.单克隆菌株1号、2号以及空白利用引物F1/F2的PCR扩增结果 The colony PCR of the monoclonal bacteria colony No.1,No.2 and the blank in the 1,3,5 lane respectively by F1/F2;2、4、6.单克隆菌株1号、2号以及空白利用引物MR (48)/MF (47)的扩增结果 The colony PCR of the monoclonal bacteria colony No.1,No.2 and the blank in the 2,4,6 lane respectively by MR (48)/MF (47).
B.重组克隆载体pGEM-α′质粒及酶切鉴定 The restriction enzyme digestion of the recombinant cloning vector pGEM-α′;M.DL 10 000 DNA marker;1.重组克隆载体pGEM-α′ The recombinant cloning vector pGEM-α′;2~4.pGEM-α′分别经EcoRⅠ/XhoⅠ单酶切、双酶切 The pGEM-α′ restriction enzyme digestion byEcoRⅠ/XhoⅠ single enzyme and double enzyme digestion.
C.表达载体pET-28a酶切 The restriction enzyme digestion of the recombinant expression vector pET-28a;M.DL 5 000 DNA marker;1.表达载体pET-28a The recombinant expression vector pET-28a;2~4.pET-28a分别经EcoRⅠ/XhoⅠ单酶切、双酶切 The restriction enzyme digestion of pET-28a byEcoRⅠ/XhoⅠ single enzyme and double enzyme digestion.
图3 重组克隆载体pGEM-α′的筛选及鉴定
Fig.3 Screening and identification of the recombinant cloning vector pGEM-α′
2.4 重组表达载体pET-28a-α′的构建、筛选及鉴定
选取编号为3~7的5个单克隆菌落,分别采用自身引物F1/F2和pET-28a通用测序引物T7/T7Ter进行菌落PCR扩增,重组表达载体菌落PCR筛选结果如图4-A所示,经F1/F2扩增得到的条带约为1 700 bp而经T7/T7Ter扩增得到的条带约为2 000 bp,均与理论扩增条带的大小相一致。如图4-B所示重组表达载体pET-28a-α′经EcoRI、XhoI单酶切后呈单一条带,双酶切得到2个大小不一条带分别约为5 000 bp、1 700 bp与pET-28a载体(5 422 bp)、α′-亚基的基因片段(1 683 bp)大小相一致;测序所得碱基序列于NCBI 中进行Blast比对分析,该序列中目的基因共1 683个碱基与Gene Bank 编号为dbj|AB234094.1的α′-亚基编码区215-1897的碱基一致性达到100%,未发生突变、移码,目的基因片段α′-亚基正确连接到表达载体上。
A.重组表达载体pET-28a-α′菌落PCR鉴定 The colony PCR identification of the recombinant expression vector pET-28a-α′;M.DL 5 000 DNA marker;1~10.单克隆菌株3~7号分别以T7/T7ter和F1/F2为上下游引物的菌落PCR结果 The colony PCR of the monoclonal bacteria colony No.3-7 by T7/T7terand F1/ F2.
B.重组表达载体pET-28a-α′双酶切鉴定 The restriction enzyme digestion of the recombinant expression vector pET-28a-α′;M.DL 5 000 DNA marker;1~4为重组表达载体pET-28a-α′、pET-28a-α′经EcoRⅠ单酶切、pET-28a-α′经XhoⅠ单酶切、pET-28a-α′经EcoRⅠ、XhoⅠ双酶切结果 The recombinant expression vector pET-28a-α′;2-4.The restriction enzyme digestion of the pET-28a-α′ byEcoRⅠ/XhoⅠ single enzyme and double enzyme digestion.
图4 重组表达载体pET-28a-α′的筛选及酶切鉴定
Fig.4 Screening and identification of the recombinant expression vector pET-28a-α′
2.5 重组α′-亚基的存在形式
将pET-28a-α′-BL21菌培养至OD600为0.8,加入IPTG至终浓度为0.2 μmol/mL,分别于20、25、30、37 ℃下培养8 h,后经超声波破碎。如图5所示,空载体菌及为未添加诱导剂的工程菌pET-28a-α′-BL21,于70 ku左右处均未出现目的蛋白。分别于20、25、30、37 ℃下诱导培养的菌体超声后的上清液和沉淀中,于70 ku处均出现蛋白条带;在诱导温度为20~37 ℃,降低诱导温度无法改善部分包涵体的生成,降低包涵体形式重组α′-亚基蛋白含量的方法需要进一步探究;上清液含有部分重组α′-亚基蛋白,具有较好的溶解性,可用于后期重组α′-亚基的分离纯化[14]。
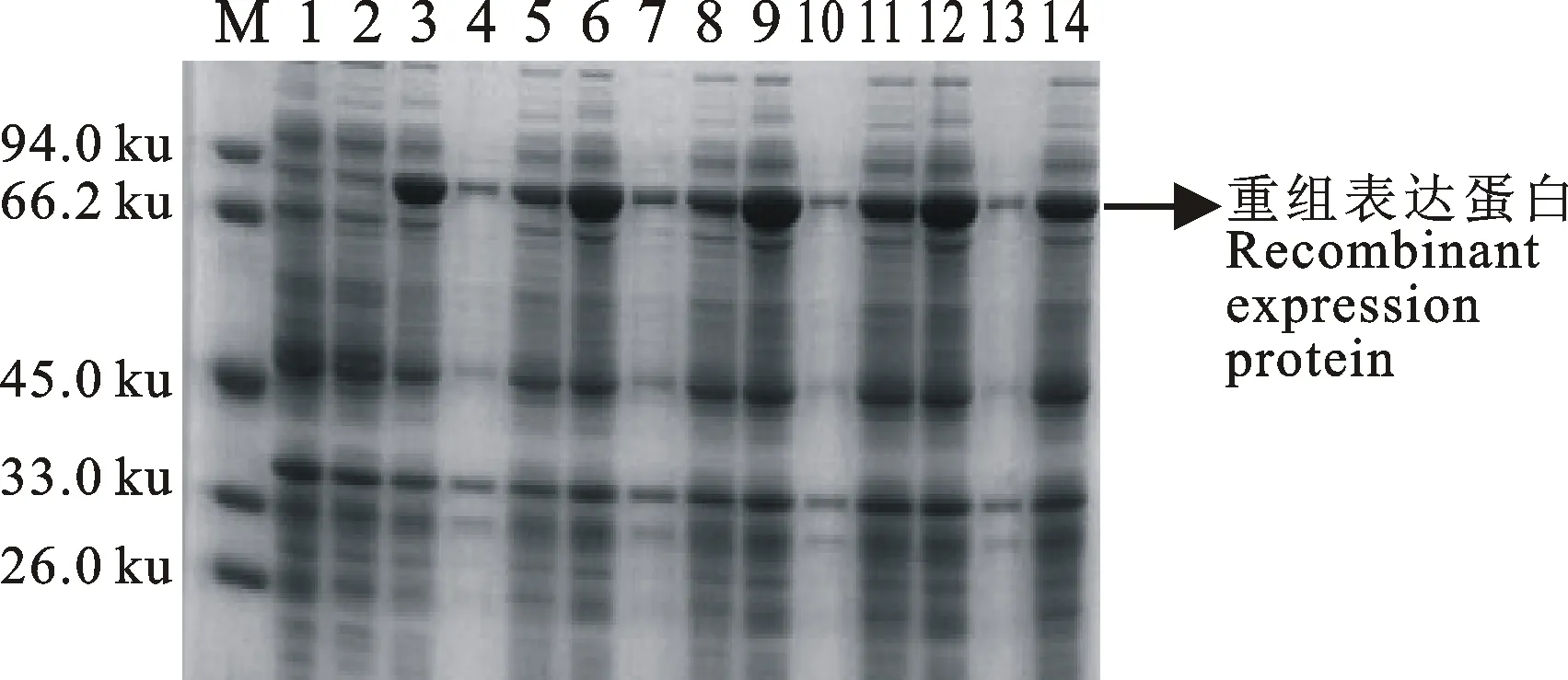
M.蛋白质marker Protein marker;1~2.空载体菌、未诱导菌 Empty carrier bacteria,non-induced bacteria;3~14.分别为20、25、30、37 ℃下诱导的全菌、沉淀、上清 The bacteria,precipitation and supernatant induced by 20,25,30 and 37 ℃ respectively.
图5 诱导温度对重组α′-亚基存在形式的影响
Fig.5 Influence of the recombinant α′-subunit forms at different induction temperatures
2.6 重组α′-亚基表达条件的筛选
重组α′-亚基诱导条件的筛选结果如图6-A所示,当OD600值为0.8,诱导温度为20、25、30、37 ℃下α′-亚基的含量分别达到26.7%、28.3%、30.2%、26.6%,诱导温度为30 ℃下重组α′-亚基的含量最高;当IPTG浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 μmol/mL时,α′-亚基含量分别为22.7%、21.6%、22.6%、22.4%、21.2%、21.4%,添加诱导剂IPTG工程菌才会产生重组α′-亚基,当IPTG浓度在0.2~1.2 μmol/mL,加大诱导剂浓度无法显著提高目的蛋白的含量;如图6-B所示,当OD600值为0.2、0.4、0.6、0.8、1.0、1.2、1.4时,重组α′-亚基的含量先呈逐渐升高后降低形势之后又呈升高后降低形势,分别达到10.3%、24.3%、28.9%、30.9%、27.4%、29.4%、22.6%,当OD600值为0.8时重组α′-亚基的含量最高;如图6-C所示,当诱导时间为9 h时,α′-亚基的含量最高达到31.6%,随着诱导时间的延长菌体浓度逐渐升高,因此延长诱导时间也可以获得大量的目的蛋白。
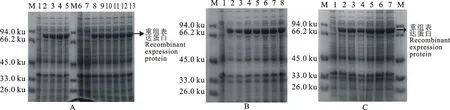
A.诱导温度及诱导剂IPTG浓度对重组α′-亚基的影响 The influence of induction temperature and IPTG concentration on the recombinant α′ subunit;M.蛋白质marker Protein marker;1.空载体菌 Empty carrier bacteria;2~5.分别为诱导温度为20、25、30、37 ℃的菌体蛋白 The bacteria induced by 20,25,30 and 37 ℃ respectively;6.空载体菌 Empty carrier bacteria;7~13.诱导剂IPTG浓度分别为0、0.2、0.4、0.6、0.8、1.0、1.2 μmol/mL The bacteria induced by IPTG concentration 0,0.2,0.4,0.6,0.8,1.0,1.2 μmol/mL.
B.菌体浓度OD600值对重组α′-亚基的影响 The influence of OD600value on the recombinant α′ subunit:M.蛋白质marker Protein marker;1.空载体菌 Empty carrier bacteria;2~8.OD600值分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4 The bacteria induced by OD600value 0.2,0.4,0.6,0.8,1.0,1.2 and 1.4 respectively.
C.诱导时间对重组α′-亚基的影响 The influence of induction time on the recombinant α′ subunit:M.蛋白质marker Protein marker;1.空载体菌 Empty carrier bacteria;2~7.诱导时间分别为3、6、9、21、24、27 h The bacteria induced by 3,6,9,21,24 and 27 h respectively.
图6 不同诱导条件对重组α′-亚基表达的影响
Fig.6 Influence of the α′ subunit expression and forms at different induction conditions
3 结论与讨论
本研究从大豆‘鲁96159’中提取总RNA,采用自行设计的引物F1/F2经RT-PCR一步法扩增获得β-伴大豆球蛋白α′-亚基的基因片段,成功构建带有EcoRI和XhoI限制性内切酶酶切位点的重组克隆载体pGEM-α′和重组表达载体pET-28a-α′;2种重组载体经菌落PCR鉴定、双酶切鉴定以及碱基序列鉴定均正确。将重组表达载体pET-28a-α′转入E.coliBL21(DE3)中,经诱导表达获得分子量约为70 ku的重组α′-亚基。经筛选获得重组α′-亚基的表达条件分别为:IPTG浓度为0.2 mmol/L、诱导温度30 ℃、诱导时间9 h并且OD600值为0.8。部分重组α′-亚基未形成包涵体存在于上清液中,有利于后期重组α′-亚基蛋白的分离纯化。
阳性工程菌pET-28a-α′-BL21所表达的重组α′-亚基分别存在于超声破碎的上清液和沉淀中,在温度为20~37 ℃,降低诱导温度对重组α′-亚基包涵体的生成没有显著影响;诱导剂浓度在0.2~1.2 μmol/mL,提高诱导剂浓度对重组α′-亚基的表达量无显著影响;由于诱导温度及诱导剂浓度对表达蛋白包涵体形式的生成具有重要影响,因此,可以通过进一步降低诱导温度及诱导剂浓度来降低包涵体形式重组α′-亚基的含量。由于包涵体形式的重组蛋白的溶解性较差,需进行较为繁琐的后期处理复性,为获得大量无包涵体形式的重组α′-亚基、提高重组α′-亚基的得率,探究β-伴大豆球蛋白α′-亚基在E.coli中的表达机理是十分必要的。
重组α′-亚基蛋白的N-端引入表达载体pET-28a自身所携带的His-Tag标签,可采用Ni2+亲和层析柱[13]或Ni2+磁性微球[15]纯化重组α′-亚基蛋白,提高后期的纯化效率;在设计上游引物F1时,在重组α′-亚基N-端的第1个氨基酸之前引入了肠激酶酶切位点,可以利用肠激酶定向将表达载体pET-28a自身所携带的组氨酸标签及多余氨基酸切除;下游引物引入终止密码子,避免pET-28a的氨基酸连接到重组α′-亚基蛋白的C-端,获得氨基酸序列完整的重组蛋白α′-亚基,为重组α′-亚基蛋白理化及功能特性的研究做准备。
Reference:
[1] WOLF W J,BABCOCK G E,SMITH A K.Ultracentrifugal differences in soybean protein composition [J].Nature,1961,191(4796):1395-1396.
[2] DERCY S E,WRIGHT D B,BLOULTER L.Storage protein of legume seeds [J].Phytochemistry,1976,15(1):3-24.
[3] UTSUMI S,KINSELLA J E.Structure function relationship in food proteins:subunit interaction in heat-induced gelation of 7S,11S,and soy isolate proteins [J].JournalofAgricultureandFoodChemistry,1985,33(2):297-303.
[4] CONSONNI A,LOVATI M R,PAROLARI A,etal.Heterologous expression and purification of the soybean 7S globulin α' subunit extension region:in vitro evidence of its involvement in cell cholesterol homeostasis[J].ProteinExpressionandPurification,2011,80(1):125-129.
[5] MARUYAMA N,KATSUBE T,WADA Y,etal.The roles of the N-linked glycans and extension regions of soybean β-conglycinin in folding,assembly and structural features [J].EuropeanJournalofBiochemistry,1998,258(2):854-862.
[6] 栾广忠.碱性蛋白酶Alcalase凝固豆浆机理的研究[D].北京:中国农业大学,2005:56-62.
LUAN G ZH.Studies on the mechanism of soymilk coagulation by an alkaline proteinase Alcalase[D].Beijing:China Agricultural University,2005:56-62(in Chinese with English abstract).
[7] LIU Y,REN L M,GE L M,etal.Strategy for fusion expression and preparation of functional glucagon-like peptide-1 (GLP-1) analogue by introducing an enterokinase cleavage site[J].BiotechnologyLetters,2014,36(8):1675-1680.
[8] 陈浩然,王增鑫,王雅君,等.重组E.coliL-天冬酰胺酶的克隆及表达与纯化[J].济南大学学报(自然科学版),2015,29(1):22-25.
CHEN H R,WANG Z X,WANG Y J,etal.Cloning,expression and purification of recombinedE.coliL-Asparaginase[J].JournalofUniversityofJinan(ScienceandTechnologyEdition) ,2015,29(1):22-25 (in Chinese with English abstract).
[9] 玉佳男,田 晶,李宝丽,等.变形链球菌UA159葡萄糖基转移酶B催化活性区的基因克隆及表达[J].现代食品科技,2015,31(5):71-75,129.
YU J N,TIAN J,LI B L,etal.Gene cloning and expression of the catalytic region of glycosyltransferase B fromStreptococcusmutansUA159[J].ModernFoodScienceandTechnology,2015,31 (5):71-75,129(in Chinese with English abstract).
[10] 王 盼,费永涛,刘冬梅,等.植物乳杆菌DMDL 9010中亚硝酸盐还原酶的基因克隆、表达和纯化[J].现代食品科技,2015,31(6):150-155,271.
WANG P,FEI Y T,LIU D M,etal.Cloning,expression,and purification of the nitrite reductase gene fromLactobacillusplantarumDMDL 9010[J].ModernFoodScienceandTechnology,2015,31(6):150-155,271(in Chinese with English abstract).
[11] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriouhaae T4[J].Nature,1970,227:680-685.
[12] 王玉海,岳 娟,王 鹏,等.编码米曲霉果糖基转移酶基因在大肠杆菌中的重组表达[J].现代食品科技,2014,30(9):67-72,178.
WANG Y H,YUE J,WANG P,etal.Recombinant expression of fructosyl transferase gene ofAspergillusoryzaeinEscherichiacoli[J].ModernFoodScienceandTechnology,2014,30(9):67-72,178(in Chinese with English abstract).
[13] 严 萍,朱喜梅,李 璐,等.Mincle 受体蛋白克隆、原核表达与纯化[J].现代食品科技,2015,31(3):77-83,76.
YAN P,ZHU X M,LI L,etal.Prokaryotic expression and purification of Mincle receotor protein[J].ModernFoodScienceandTechnology,2015,31(3):77-83,76(in Chinese with English abstract).
[14] 汪家政,范 明.蛋白质技术手册[M].北京:科学出版社,2005:183.
WANG J ZH,FAN M.The Manual of Protein Technology[M].Beijing:Science Press,2005:183(in Chinese).
[15] 王文加,郭晓林,韦安慧,等.基于Fe3O4·SiO2/Ni-NTA磁性微球的His-tag融合蛋白纯化体系的建立[J].高等学校化学学报,2012,33(2):303-307.
WANG W J,GUO X L,WEI A H,etal.Purification of Histidine-tagged fusion proteins based on Fe3O4·SiO2/Ni-NTA magnetic spheres [J].ChemicalJournalofChineseUniversities,2012,33(2):303-307(in Chinese with English abstract).
(责任编辑:史亚歌 Responsible editor:SHI Yage)
Cloning and Prokaryotic Expression of Soybean β-conglycinin α′-Subunit Gene
XU Yanyan1,DONG Yu2,WANG Xin1,PENG Fei1,SUN Xiaojing1,YU Shaojing1,Eizo Tatsumi3and LUAN Guangzhong1
( 1.College of Food Science & Engineering,Northwest A&F University1,Yangling Shaanxi 712100,China; 2.Kaifeng Institute for Food and Drug Control,Kaifeng Henan 475000,China; 3.Japan International Research Center for Agricultural Science,Tsukuba 305-8686,Japan)
In order to build theE.coliexpression system for the α′ subunit of soybean β-conglycinin,the total RNA were extracted from the seeds of soybean variety ‘Lu 96150’.The α′ coding sequence was amplified by one step assay of RT-PCR,and then inserted into the vector of pGEM-T easy.After digested byXhoI/EcoRI,the α′ fragment was inserted into the prokaryotic expression vector pET-28a containing His-tag.The constructed vector pET-28a-α′ was verified by the colony PCR,restriction endonuclease digestion and DNA sequencing.Then the pET-28a-α′ vector was transformed intoE.colihost strain BL21 (DE3) for IPTG induction expression.A recombinant protein about 70 ku was well expressed by inducing with the OD600value 0.8,IPTG 0.2 mmol/L at 30 ℃ for 9 h.After ultrasonication and centrifuge the target protein α′ subunit was found in the supernatant not in the form of inclusion body,more convenient to the further purification work.This study could provide a theoretical basis for the structure and function relationship study of soybean β-conglycinin.
β-conglycinin; Subunit; Recombinant protein; Cloning; Gene expression
XU Yanyan,female,master student.Research area:soybean processing technology.E-mail:1175580375@qq.com
LUAN Guangzhong,male,Ph.D,associate professor.Research area:soybean,grain and oil processing technology.Email:qlgz@nwsuaf.edu.cn
日期:2016-12-29
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161229.1008.040.html
2016-05-14
2016-06-06
中日合作项目(K332021107)。
许妍妍,女,硕士研究生,研究方向为大豆深加工技术。E-mail:1175580375@qq.com
栾广忠,男,博士,副教授,研究方向为大豆及粮油深加工技术。E-mail:qlgz@nwsuaf.edu.cn
TS201
A
1004-1389(2017)02-0304-07
Received 2016-05-14 Returned 2016-06-06
Foundation item Sino Japan Cooperation Project(No.K332021107).
