早期贲门腺癌中SOX17启动子区甲基化检测的临床意义
2017-03-23陈晨陆璨陆前进
陈晨,陆璨,陆前进
(中南大学湘雅二医院 1.胸外科 2. 口腔医学中心 3.医学表观基因组学湖南省重点实验室,湖南 长沙 410011)
贲门腺癌(gastric cardia adenocarcinoma,GCA) 是临床上常见的恶性肿瘤之一。GCA的流行病学特征是其与食管鳞状细胞癌(Esophageal squamous cell carcinoma,ESCC)的发病地域分布性相一致[1-2]。近年来胃部肿瘤的发生率呈整体下降趋势,而食管和胃交界部肿瘤的发病率则呈明显上升趋势,其原因主要与胃食管反流等因素相关[1,3]。统计分析认为早期GCA患者术后5年生存率约为80%,但中晚期患者5年生存率不足10%,最主要的原因是肿瘤的复发和远期转移[4-5]。因此寻找有效的肿瘤预后标志物对于改善GCA患者生存时间至关重要。目前认为肿瘤的发生是一个多基因累积变化或相互作用叠加的结果。其中癌基因突变和抑癌基因的失活是肿瘤形成的两大重要因素,而抑癌基因启动子区CpG岛高甲基化则是导致其功能失活的主要机制之一[6]。
SOX17基因定位于8q11.23,属于SOX转录因子家族。SOX基因家族是一个转录因子超家族,该家族的共同特征是均具有一个高度保守的HMG-box区域,与性别决定基因SRY具有高度同源性[7]。目前为止SOX基因家族共发现了30多个成员,其主要功能是参与正常生理状态下的性别决定、神经发生、软骨形成等一系列发育过程[8-9]。近年研究发现某些SOX基因家族成员参与了Wnt/β-catenin信号通路的调控,SOX17基因被认为是β-catenin/TCF转录激活复合物的一个负调节因子,其通过与TCF/LEF的相互作用,影响下游靶基因的表达,抑制肿瘤细胞的生长。目前已在多种肿瘤中观察到了SOX17基因的表达失活,且其功能异常与肿瘤的进展和转移密切相关[10-11]。本研究通过观察GCA肿瘤组织,癌旁正常组织以及病理确证为肿瘤细胞阴性的淋巴结组织中SOX17基因启动子区甲基化情况,探索SOX17基因启动子甲基化与GCA肿瘤发生之间的关系,对寻找GCA肿瘤诊断和预后分子标记物具有重要临床意义。
1 材料与方法
1.1 标本来源
收集2013年1月—2014年12月间本院手术切除的GCA标本,其中肿瘤组织42例,对应癌旁正常组织41例(缺失1例,癌旁正常组织取自肿瘤边缘5 cm外区域),以及相应癌旁淋巴结组织79枚(尽量保证每例检测2个淋巴结)均为石蜡包埋组织标本。全部肿瘤组织均经病理诊断为早期贲门腺癌,其中I期19例,II期23例。按照组织分化程度,高分化10例,中分化17例,低分化15例。所有淋巴结样本均由病理免疫组化检测确证为未见转移癌的淋巴结。所有肿瘤患者中,男25例,女17例;年龄最小者55岁,最大68岁,中位年龄63.7岁;术前均未接受化疗或放疗。所有患者于术后进行定期随访,中位随访时间39个月。本研究经过本院伦理委员会批准后实施。
1.2 检测方法
1.2.1 DNA样本提取和亚硫酸氢钠修饰 为最大程度检测石蜡标本DNA中SOX17甲基化情况,本研究采用一种全新的基于磁珠的DNA提取和亚硫酸氢钠修饰技术[12-14],简述如下:取石蜡组织切片 10 μm 各 2~5片,加入 Incubation Buffer/Proteinase K 溶液(Promega公司)56℃孵育过夜,加入磁珠(Promega公司),充分混匀使DNA吸附于磁珠上;采用 Zymo 公司 EZ DNA Methylation kit试剂直接在磁珠上对DNA进行亚硫酸氢钠修饰,最终获得可直接用于后续PCR扩增的DNA模板。
1.2.2 甲基化特异性PCR 扩增 SOX17基因和内参基因β-actin扩增引物由上海Invitrogen 公司合成,具体引物序列如下。SOX17:上游引物5'-TTT AAC GAC GCG GGA TCG-3', 下 游 引 物 5'-CCC AAC CGA CCT AAT AAC ACT ACG-3',探针CGT TTT CGT CGT TTT ATT GGT TAT ATT TGT GTA G;β-actin: 上 游 引 物 5'-TAG GGA GTA TAT AGG TTG GGG AAG TT-3', 下 游 引 物 5'-AAC ACA CAA TAA CAA ACA CAA ATT CAC-3',探针 CGA CTG CGT GTG GGG TGG TGA TGG AGG AGG TTT AGG CAG TCG。PCR 反应体系:10×PCR 缓冲液 2.5μL;10 mmol/L dNTP 混合液0.5μL;50 mmol/L MgCl20.8μL;Platinum Taq DNA 聚合酶 0.2μL;上游及下游引物各 1μL;2μL 修饰后的 DNA 模板;双蒸水 17μL;总体积共25μL。反应条件如下:95℃预变性 5min;94℃变性 30 s,60℃退火 30 s,72℃延伸 30 s,共循环45个周期;72℃终末延伸5min。每个样本重复 3 遍,采 用 2-ΔΔCT法 判 断 Real time PCR 阳 性结果[13]。
1.3 统计学处理
采用SPSS 20.0 软件对数据进行统计学分析。两组间均数的比较用独立样本t检验,肿瘤及对应癌旁正常组织甲基化差异采用配对t检验。SOX17启动子区甲基化状态与临床病理参数的关系采用χ2检验或Fisher's确切概率法,采用Kaplan-Meier检验进行生存分析,P<0.05为差异有统计学意义。
2 结 果
2.1 肿瘤组织中SOX17基因启动子甲基化情况及与临床病理因素的关系
在肿瘤组织和未发生转移的淋巴结组织中均能检测到SOX17启动子区异常甲基化(图1)。
42例GCA肿瘤组织中有31例(73.8%)检测出SOX17基因启动子区甲基化阳性;41例正常组织中2例(4.9%)检测出SOX17基因启动子区甲基化阳性(表1);与正常组织比较,GCA肿瘤组织中SOX17甲基化发生率明显高于正常组织(P<0.001);SOX17的甲基化与患者性别、年龄、饮酒史、肿瘤TNM分期及分化程度无关(表2)。
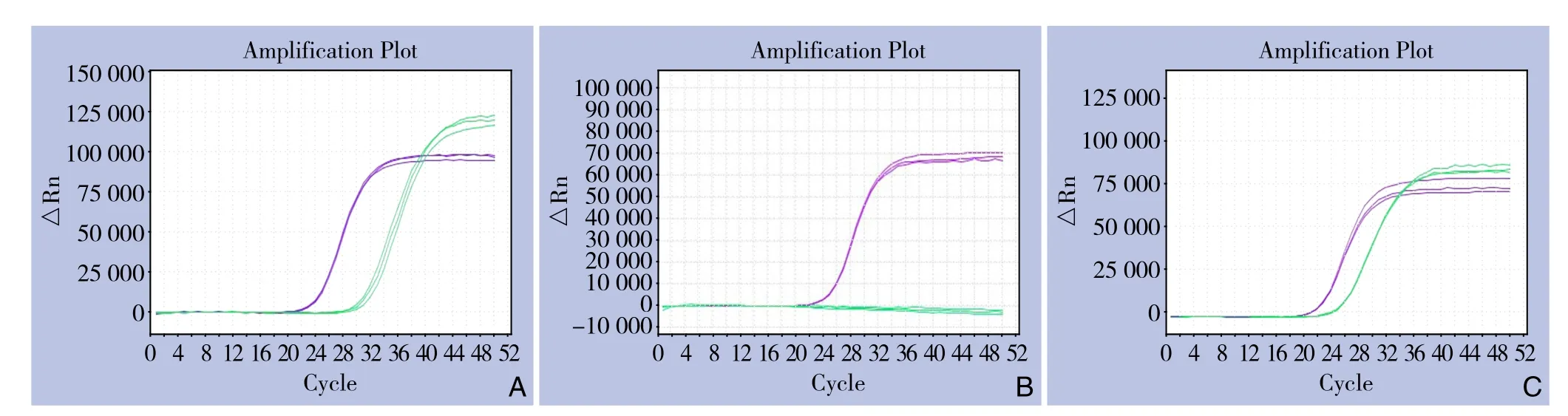
图1 Real time PCR结果 A:肿瘤组织中SOX17启动子区甲基化阳性;B SOX17启动子区甲基化阴性;C)淋巴结中SOX17启动子区甲基化阳性

表1 肿瘤组织与正常组织中SOX17基因启动子区的甲基化比率[n(%)]
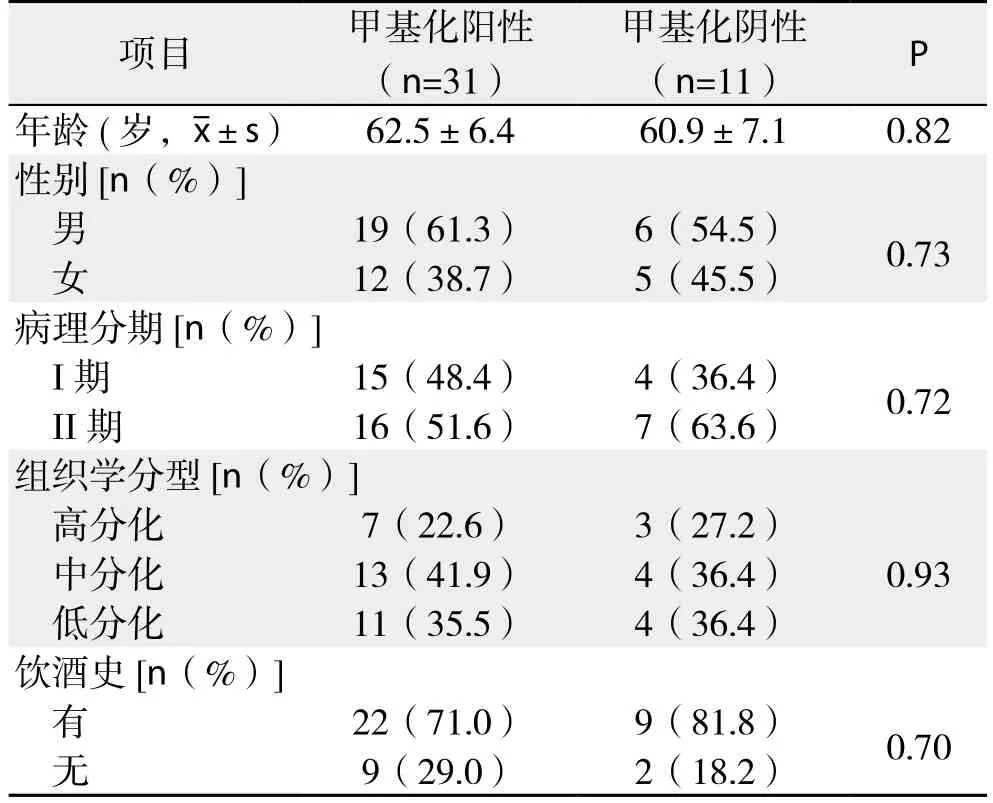
表2 SOX17基因启动子区甲基化与GCA临床病理特征的关系
2.2 淋巴结中SOX17基因启动子的甲基化
在肿瘤组织SOX17甲基化阳性的GCA31例所对应的淋巴结中,共有18例(共29枚淋巴结)检测到SOX17启动子区甲基化;在肿瘤组织SOX17甲基化阴性的11例中,相应的淋巴结组织均未检测到SOX17甲基化。
2.3 SOX17基因甲基化与肿瘤预后的关系
42例患者术后总的生存率为78.6%(图2A)。生存分析显示,在GCA肿瘤组织中,与SOX17甲基化阴性者比较,SOX17甲基化阳性的患者预后不佳,但无统计学差异(P=0.14)(图2B);而在淋巴结中SOX17甲基化阳性者,其生存时间明显短于淋巴结中SOX17甲基化阴性者(P<0.05)(图2C)。
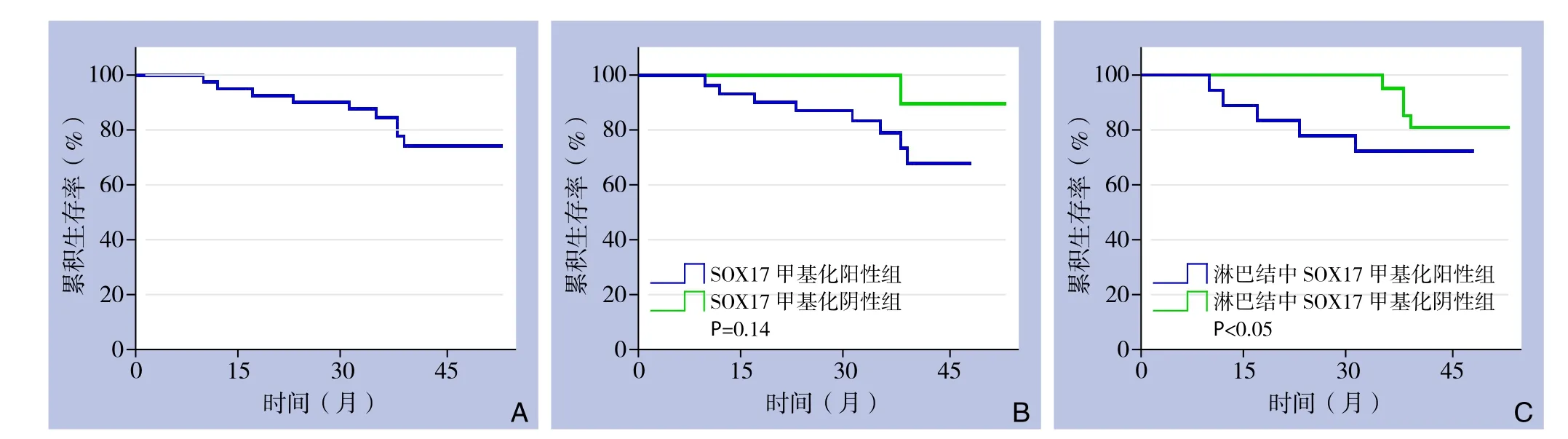
图2 SOX17基因甲基化与生存的关系 A:42例GCA患者总体生存曲线;B:GCA肿瘤组织中检测SOX17甲基化状态与生存预后关系;C:淋巴结中检测SOX17甲基化状态与生存预后关系
3 讨 论
Wnt/β-catenin信号通路的异常活化与多种肿瘤的发生密切相关。正常生理状态下,该通路的关键调控基因,如APC、SOX17等基因可以通过抑制通路的活化阻止肿瘤的发生和进展[15]。目前认为SOX17基因对Wnt/β-catenin信号通路的调控并不依赖于通过与Wnt信号蛋白或其配体的结合来拮抗通路的激活,而是通过与细胞核内多种转录因子的相互竞争,抑制或开启下游靶基因的转录[16-18]。在对结肠癌的研究中发现,SOX17基因启动子区高度甲基化,基因表达失活。去除异常甲基化可以恢复SOX17的基因转录,抑制β-catenin诱导的转录激活,抑制肿瘤细胞生长[19]。Balgkouranidou 和Oishi等[17,20]在 对 胃 癌 的 研 究中也观察到SOX17的异常甲基化状态,且血浆中SOX17的甲基化被认为可以作为胃癌患者的预后判断指标[17,20]。这些都提示了SOX17基因启动子区甲基化与肿瘤的发生进展密切相关。本研究显示,GCA肿瘤组织中SOX17基因启动子区甲基化发生率为73.8%,明显高于正常对照组的4.9%;在病理确证为肿瘤细胞阴性的癌旁淋巴结中,也能检测到SOX17的甲基化异常,这些都提示了SOX17启动子区甲基化是GCA肿瘤发生中的重要事件。
研究[21-22]认为,肿瘤作为一种全身性疾病,其DNA甲基化的异常改变并不仅仅局限于肿瘤细胞中。肿瘤发生时,在循环血、肿瘤引流淋巴结以及机体免疫细胞中均可观察到与肿瘤变化趋势一致的基因改变。Brock等[23]的研究发现,早期肺癌患者术后病理确证为肿瘤阴性的淋巴结中可以检测到DNA的异常甲基化,且这些异常的甲基化与肿瘤中的DNA甲基化变化趋势相一致;联合检测肿瘤组织和相应淋巴结中DNA甲基化的改变可以作为肿瘤预后的判断指标。这提示了检测癌旁未发生癌转移的淋巴结中DNA甲基化状态具有重要临床意义。
在DNA甲基化的检测过程中,亚硫酸氢钠修饰是必不可少的关键步骤,但该步骤同时也会造成DNA的损伤和降解,极大降低了甲基化检测的灵敏度。尤其是对于石蜡标本和血浆标本中的小片段DNA,即使采用巢式PCR,其检测效果仍不能令人满意。为了解决这一问题,本研究采用一种全新的基于磁珠的亚硫酸氢钠修饰处理方式,将DNA结合在磁珠上之后直接进行亚硫酸氢钠修饰,最大程度减低了DNA的损失和降解,大大提高了检测的灵敏度[12,14]。尤其是对于病理阴性的淋巴结组织,本研究在29枚淋巴结组织中检测到了SOX17基因的甲基化,且淋巴结中SOX17甲基化阳性的病例预后明显不佳,提示了运用这种全新的检测方法在淋巴结中检测SOX17启动子甲基化,对于GCA肿瘤预后判断具有重要临床意义。
综上所述,本研究提示了SOX17基因甲基化在GCA肿瘤发生进展中扮演重要角色;同期检测肿瘤组织和相应淋巴结中DNA甲基化状态对早期GCA肿瘤预后的判断具有重大意义。
[1]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China,2015[J]. CA Cancer J Clin, 2016, 66(2):115–132. doi: 10.3322/caac.21338.
[2]Bray F, Jemal A, Grey N, et al. Global cancer transitions according to the Human Development Index (2008–2030): a population-based study[J]. Lancet Oncol, 2012, 13(8):790–801. doi: 10.1016/S1470–2045(12)70211–5.
[3]Chen W. Cancer statistics: updated cancer burden in China[J]. Chin J Cancer Res, 2015, 27(1):1. doi: 10.3978/j.issn.1000–9604.2015.02.07.
[4]Nishimaki T, Kanda T, Nakagawa S, et al. Outcomes and prognostic factors after surgical resection of hypopharyngeal and cervical esophageal carcinomas[J]. Int Surg, 2002, 87(1):38–44.
[5]Wu L, Xu Z, Zhao X, et al. Surgical treatment and prognosis of esophageal cancer after distal gastrectomy[J]. J Gastrointest Surg,2010, 14(1):32–37. doi: 10.1007/s11605–009-1005–5.
[6]Baylin SB, Ohm JE. Epigenetic gene silencing in cancer - a mechanism for early oncogenic pathway addiction?[J]. Nat Rev Cancer, 2006, 6(2):107–116.
[7]Ye YW, Wu JH, Wang CM, et al. Sox17 regulates proliferation and cell cycle during gastric cancer progression[J]. Cancer Lett, 2011,307(2):124–131. doi: 10.1016/j.canlet.2011.03.024.
[8]Li Y, Chen P, Zu L, et al. Erratum: MicroRNA-338–3p suppresses metastasis of lung cancer cells by targeting the EMT regulator Sox4[J]. Am J Cancer Res, 2016, 6(7):1582.
[9]Li Y, Lv Z, He G, et al. The SOX17/miR-371–5p/SOX2 axis inhibits EMT, stem cell properties and metastasis in colorectal cancer[J]. Oncotarget, 2015, 6(11):9099–9112.
[10]Fu DY, Tan HS, Wei JL, et al. Decreased expression of SOX17 is associated with tumor progression and poor prognosis in breast cancer[J]. Tumour Biol, 2015, 36(10):8025–8034. doi: 10.1007/s13277–015-3547–3.
[11]Zhang Y, Bao W, Wang K, et al. SOX17 is a tumor suppressor in endometrial cancer[J]. Oncotarget, 2016, 7(46):76036–76046. doi:10.18632/oncotarget.12582.
[12]Keeley B, Stark A, Pisanic TR 2nd, et al. Extraction and processing of circulating DNA from large sample volumes using methylation on beads for the detection of rare epigenetic events[J]. Clin Chim Acta, 2013, 425:169–175. doi: 10.1016/j.cca.2013.07.023.
[13]Hulbert A, Jusue-Torres I, Stark A, et al. Early Detection of Lung Cancer Using DNA Promoter Hypermethylation in Plasma and Sputum[J]. Clin Cancer Res, 2017, 23(8):1998–2005. doi:10.1158/1078–0432.CCR-16–1371.
[14]Bailey VJ, Zhang Y, Keeley BP, et al. Single-tube analysis of DNA methylation with silica superparamagnetic beads[J]. Clin Chem,2010, 56(6):1022–1025. doi: 10.1373/clinchem.2009.140244.
[15]Yin D, Jia Y, Yu Y, et al. SOX17 methylation inhibits its antagonism of Wnt signaling pathway in lung cancer[J]. Discov Med, 2012,14(74):33–40.
[16]Kormish JD, Sinner D, Zorn AM. Interactions between SOX factors and Wnt/beta-catenin signaling in development and disease[J]. Dev Dyn, 2010, 239(1):56–68. doi: 10.1002/dvdy.22046.
[17]Balgkouranidou I, Karayiannakis A, Matthaios D, et al. Assessment of SOX17 DNA methylation in cell free DNA from patients with operable gastric cancer. Association with prognostic variables and survival[J]. Clin Chem Lab Med, 2013, 51(7):1505–1510. doi:10.1515/cclm-2012–0320.
[18]Balgkouranidou I, Chimonidou M, Milaki G, et al. SOX17 promoter methylation in plasma circulating tumor DNA of patients with nonsmall cell lung cancer[J]. Clin Chem Lab Med, 2016, 54(8):1385–1393. doi: 10.1515/cclm-2015–0776.
[19]Zhang W, Glöckner SC, Guo M, et al. Epigenetic inactivation of the canonical Wnt antagonist SRY-box containing gene 17 in colorectal cancer[J]. Cancer Res, 2008, 68(8):2764–2772. doi: 10.1158/0008–5472.CAN-07–6349.
[20]Oishi Y, Watanabe Y, Yoshida Y, et al. Hypermethylation of Sox17 gene is useful as a molecular diagnostic application in early gastric cancer[J]. Tumour Biol, 2012, 33(2):383–393. doi: 10.1007/s13277–011-0278-y.
[21]Belinsky SA, Klinge DM, Dekker JD, et al. Gene promoter methylation in plasma and sputum increases with lung cancer risk[J]. Clin Cancer Res, 2005, 11(18):6505–6511.
[22]Dawson MA, Kouzarides T. Cancer epigenetics: from mechanism to therapy[J]. Cell, 2012, 150(1):12–27. doi: 10.1016/j.cell.2012.06.013.
[23]Brock MV, Hooker CM, Ota-Machida E, et al. DNA methylation markers and early recurrence in stage I lung cancer[J]. N Engl J Med, 2008, 358(11):1118–1128. doi: 10.1056/NEJMoa0706550.
