《日本胰腺协会胰腺癌临床实践指南(2016)》解读
2017-03-23黄耿文宁彩虹申鼎成曹昕彤
黄耿文,宁彩虹,申鼎成,曹昕彤
(中南大学湘雅医院 胰胆外科,湖南 长沙 410008)
胰腺癌恶性程度高,预后极差,5年存活率不及5%[1]。近年来,包括美国国家综合癌症网络(NCCN)、欧洲肿瘤内科学会以及中华医学会外科学分会胰腺外科学组[2-3]等相关机构均相继更新了有关胰腺癌的诊治指南。2006年日本胰腺协会(JPS)首次发布了基于循证医学的胰腺癌临床实践指南,并于2009年7月和2013年10月先后对指南进行了2次修订。2016年10月,该指南重新进行了更新并于2017年5月以英文发表在《Pancreas》上[4]。这一新的指南针对疾病概念、诊断、可切除性胰腺癌的外科治疗、可切除性胰腺癌的辅助治疗、局部晚期不可切除胰腺癌的治疗、转移性胰腺癌的治疗、支架治疗、姑息医学等八大部分内容,共计51个临床具体问题提出了76条推荐性意见,并按照GRADE标准给出了推荐等级和证据级别。为了避免偏颇,修订委员会涵盖了各个相关领域的专家,包括内科学、外科学、肿瘤学、放射学、内镜学、心理-肿瘤学、姑息医学、癌症护理、癌症药学、社工和营养师,甚至还包括了1名胰腺癌患者。这一新修订的指南代表了当前日本标准的胰腺癌临床实践规范。根据GRADE标准将推荐等级分为二级:1级(强烈推荐)和2级(建议)。证据级别分为A(最高级)、B、C、D(最弱)4个等级。本文对这一指南的主要观点做一解读。
1 疾病概念
1.1 胰腺癌的危险因素有哪些?
⑴ 家族史:胰腺癌家族史(B)、家族性胰腺癌;⑵ 遗传性疾病:遗传性胰腺炎(C)、遗传性乳腺癌卵巢癌综合征、黑斑息肉病(Peutz-Jeghers综合征)、家族性非典型性多发性痣-黑色素瘤综合征、遗传性非息肉病性肠癌(Lynch综合征)、家族性结直肠腺瘤性息肉病(FAP);⑶ 合并症:糖尿病(B)、慢性胰腺炎(B)、导管内乳头状黏液性肿瘤、胰腺囊肿、肥胖(B);⑷ 生活方式:吸烟(B)和酗酒(C);⑸ 职业因素:氯化烃化合物从业者(B)。建议将导管内乳头状黏液性肿瘤和胰腺囊肿视为胰腺癌的癌前病变,进行严密的随访观察(2C)。
1.2 什么是家族相关性胰腺癌?
家族相关性胰腺癌是指排除已知的遗传性胰腺癌综合征以外,家族中有2个以上一级直系亲属(父母、兄弟姐妹、子女)罹患胰腺癌(C)。
1.3 什么是临界可切除性胰腺癌?
JPS发布的第7版胰腺癌研究通则[4]根据局部侵犯程度和有无远处转移将胰腺癌分为:可切除,临界可切除和不可切除(2B)。临界可切除性胰腺癌是指行标准胰腺癌根治手术时较大可能成为R1切除(即切缘组织学有肿瘤残留)。根据侵犯门静脉系统和动脉系统将临界可切除性胰腺癌分为两类,即临界可切除门静脉型和临界可切除动脉型。临界可切除门静脉型是指肿瘤仅侵犯门静脉系统,与肠系膜上静脉/门静脉接触≥180°或完全阻塞肠系膜上静脉/门静脉,但侵犯范围不超过十二指肠下缘,且对肠系膜上动脉、腹腔干或肝总动脉没有侵犯或接触。临界可切除动脉型是指肿瘤与肠系膜上动脉或腹腔干接触<180°,且动脉狭窄或扭曲;或肿瘤侵犯肝总动脉,但肝固有动脉和腹腔干不受侵犯。
推荐采用多排螺旋CT(MDCT)诊断临界可切除性胰腺癌(1B),腹腔镜探查对诊断肝脏微小转移和腹膜种植具有一定作用,故建议必要时采用(2B)。
2 诊 断
2.1 如何发现胰腺癌?
当有多个胰腺癌危险因素存在或患者出现胃痛、厌食、腹胀、黄疸、体质量减轻、新发糖尿病或背痛等症状时,应考虑胰腺癌的可能(2C),建议检测血液胰酶、肿瘤标志物以及超声来筛查胰腺癌(2C)。
2.2 怀疑胰腺癌时,应采取什么诊断方法?
一旦怀疑胰腺癌,推荐采用动态CT(MDCT更佳)、MRI(MRCP)(1B)和/或EUS(2B)以进一步明确诊断,其中EUS敏感性相对更高。经上述检查(包括超声、CT、MRI及EUS)仍难以明确诊断时,建议行ERCP(2B)。PET有助于区分肿瘤的良恶性,然而其对于诊断小胰腺癌和胰腺癌的微小远处转移灶作用有限(2C)。细胞学和组织学诊断胰腺癌的敏感性和特异性较高,有助于区分胰腺癌和其它胰腺疾病(2C)。
2.3 如何对胰腺癌分期?
推荐行动态MDCT和/或动态MRI来确定胰腺癌的分期(TNM分期)(1B),必要时建议行EUS(2B)。必要时还可以行腹腔镜检查,以评估肝脏转移和腹膜种植情况(2B)。
2.4 如何确定胰腺癌的可切除性?
推荐行MDCT评估胰腺癌的局部侵犯程度(1B),必要时行EUS(2B)。推荐行动态MDCT和/或动态MRI评估是否有远处转移(1B)。如果动态MDCT和/或动态MRI未能发现远处转移,必要时可考虑行PET和/或腹腔镜检查(2B)。
2.5 腹腔镜检查是否有助于胰腺癌分期?
腹腔镜检查有助于发现肝脏转移和腹膜种植。因此,对于可切除性胰腺癌或局部进展性胰腺癌无法排除远处转移时,建议采取腹腔镜探查(2C)。
2.6 如何早期诊断胰腺癌以获取长期预后?
≤1 cm的胰腺癌的长期预后可能较好。胰管扩张和胰腺囊性病变是早期诊断胰腺癌的重要的间接征象。当B超和动态MDCT检查难以直接发现肿瘤时,建议行EUS或MRCP(2C)。当EUS检查发现肿块时,建议在EUS引导下行细针抽吸细胞学检查(2C)。当胰管存在局限性狭窄,管径变化及分支胰管扩张时,建议行ERCP并获取胰液行细胞学检查(2C)。
3 治 疗
3.1 可切除性胰腺癌的外科治疗
推荐对可切除性胰腺癌采用外科治疗(1B)。建议在大的胰腺中心进行胰腺癌手术,可能降低总体病死率、住院病死率、外科手术相关性并发症及缩短术后住院时间(2B)。临界可切除胰腺癌的术前多学科治疗(MDT)可提高胰腺癌切除率及R0切除率,可能改善临床结果,这有待于大规模前瞻性临床试验来证实(B)。腹腔灌洗细胞学阳性的胰腺癌患者是否应该行外科手术治疗尚不明确(D)。采取保留幽门的胰十二指肠切除术治疗胰头癌可缩短手术时间和减少围手术期失血量,同时并不影响手术生存率和术后并发症的发生(2B)。术中联合门静脉切除能否改善胰腺癌的临床预后目前尚不明确,若可获得R0切除,可以考虑联合门静脉切除(C)。胰腺癌的扩大淋巴结及神经丛清扫不能改善患者的存活率,故不推荐常规采用(1B)。当术中探查发现胰头癌不能切除时,如肿瘤侵犯或可疑侵犯胆管,建议行胆道旁路引流术(2B);如肿瘤侵犯或可疑侵犯十二指肠,建议行胃空肠吻合术(2B)。
腹腔镜下胰十二指肠切除术治疗胰腺癌的作用目前尚未得到证实,除非在临床试中,否则不推荐对胰腺癌患者行腹腔镜下胰十二指肠切除术(1D)。而腹腔镜下远侧胰腺切除术治疗胰体尾癌的作用在日本已经得到认可,但其作用及安全性仍需进一步积累病例来证实(D)。
胰腺癌患者行外科手术治疗后,应进行密切随访。建议术后2年内,每3~6个月检查肿瘤标记物和动态CT,之后每6~12个月检查1次,至少随访至术后5年(2C)。
胰腺切除术后的营养支持治疗对患者也很重要。鉴于肠内营养发生感染相关性并发症较静脉营养低,建议对胰腺癌切除术后患者予以肠内营养治疗(2C)。
3.2 可切除性胰腺癌的辅助治疗
由于新辅助治疗(含放化疗或化疗)对可切除性胰腺癌患者围手术期和远期预后的影响尚不明确,故除非是在临床试验中,否则不建议行新辅助治疗(2C)。不推荐对可切除性胰腺癌患者行术中放疗(1B),不建议对可切除性胰腺癌患者行术后辅助放化疗(2B)。可切除性胰腺癌患者术后行辅助化疗可显著延长存活期,故推荐使用,推荐将S-1单药化疗方案作为术后一线辅助化疗方案(1A),而对于不能耐受S-1的患者,推荐吉西他滨单药化疗(1A)。
3.3 局部晚期不可切除胰腺癌的治疗
推荐将放化疗或化疗作为局部晚期不可切除胰腺癌的初始治疗(1B)。放化疗:建议放疗联合氟尿嘧啶或吉西他滨治疗(2B),推荐采用三维立体治疗方案对肿瘤进行精准放疗,同时可减少对周围器官的辐射剂量(1B),辐射范围仅包括整体的肿瘤区域及经常转移的淋巴结区域(2C)。诱导化疗可作为局部晚期不可切除胰腺癌放疗之前的一种治疗选择(2C)。目前仅有1篇报道支持对局部晚期不可切除胰腺癌采取术中放疗(C)。放化疗或单纯放疗有望改善局部晚期胰腺癌患者的生活质量(B)。化疗:建议局部晚期不可切除性胰腺癌的一线化疗方案可采取吉西他滨单药方案(2B)、S-1单药方案(2B)、FOLFIRINOX(2C)以及吉西他滨联合白蛋白-紫杉醇方案(2C)。此外,也可以考虑使用吉西他滨联合S-1化疗方案(证据等级:无效,推荐程度:无)。当一线化疗方案无效时,可考虑使用二线化疗方案延长患者生存周期(2B)。化疗可用至肿瘤出现明显进展时或出现明显化疗副作用时(2C)。免疫治疗对延长不可切除胰腺癌患者的生存期无明显作用,不建议常规使用(2C)。
3.4 转移性胰腺癌的治疗
3.4.1 化疗 转移性胰腺癌的一线化疗方案包括FOLFIRINOX方案或吉西他滨联合白蛋白-紫杉醇方案(1A)。如果患者一般状况难以耐受上述一线化疗方案时,推荐采用吉西他滨单药方案、吉西他滨联合盐酸厄罗替尼方案或S-1单药方案(1A)。此外,可以考虑使用吉西他滨联合S-1方案(推荐程度:无;证据等级:无)。当一线化疗方案无效时,可考虑使用二线化疗方案延长患者生存周期(2B)。化疗可用至肿瘤出现明显进展时或出现明显化疗副作用时(2C)。免疫治疗对延长转移性胰腺癌患者的生存期无明显作用,不建议常规使用(2C)。
3.4.2 放疗 当胰腺癌出现骨转移时,可考虑进行放疗以缓解疼痛(1A)。
3.5 支架治疗
当不可切除胰腺癌继发梗阻性黄疸时,推荐采取胆道引流(1C),引流方法优先考虑内镜引流(2B)。各种胆道支架的优劣性尚无定论,医生可根据患者特点及医疗机构情况予以选择(C)。覆膜型自膨式金属支架较塑料支架可维持更长久的通畅性,建议作为首选(2C)。当合并十二指肠梗阻时,可考虑行胃空肠吻合术或消化道支架植入(C)。
3.6 姑息医学
建议肿瘤科医生、精神科医生、护士及医辅人员共同照顾患者以缓解胰腺癌患者及家人的心理困扰(2C)。若患者出现明显腹痛或背痛时,应详细评估疼痛原因及程度(1D),必要时使用非阿片类或阿片类镇痛药治疗(1B),若上述药物难以缓解疼痛,建议辅用镇静药物(2B),也可考虑神经阻滞(2A)。
当不可切除胰腺癌患者出现进食困难和营养恶化时,建议采用要素饮食(2C)。
胰腺癌是一种预后极差且存活率很低的恶性肿瘤,其发病率仍在逐年升高,因此胰腺癌的早期发现、诊断、规范治疗显得尤为重要。日本胰腺协会胰腺癌临床实践指南(2016)在胰腺癌的诊断与治疗流程方面提供了许多有价值的推荐性意见(图1-3),值得参考、学习和借鉴。

图1 胰腺癌诊断流程图Figure 1 Algorithm for diagnosis of pancreatic cancer

图2 胰腺癌治疗流程图Figure 2 Algorithm for treatment of pancreatic cancer
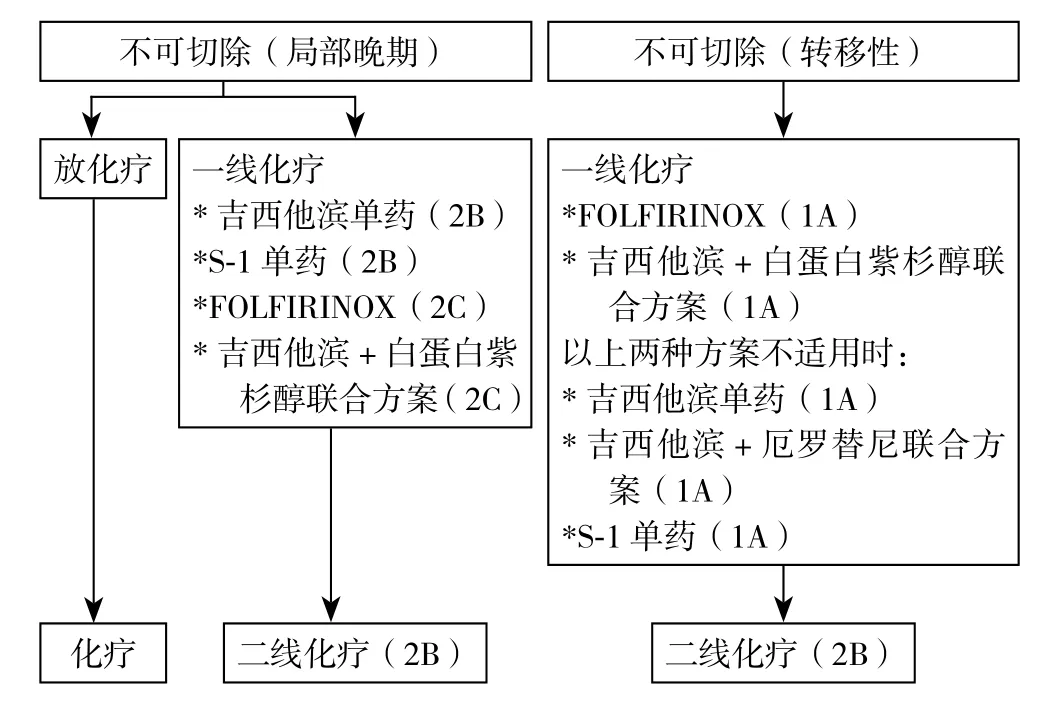
图3 胰腺癌化疗流程图Figure 3 Algorithm for chemotherapy of pancreatic cancer
[1]Hidalo M. Pancreatic cancer[J]. N Engl J Med, 2010, 362(17):1605–1617. doi: 10.1056/NEJMra0901557.
[2]Ducreux M, Cuhna AS, Caramella C, et al. Cancer of the pancreas:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2015, 26(Suppl 5):v56–68. doi: 10.1093/annonc/mdv295.
[3]中华医学会外科学分会胰腺外科学组. 胰腺癌诊治指南(2014版)[J]. 中华消化外科杂志, 2014, 13(11):831–837. doi:10.3760/cma.j.issn.1673–9752.2014.11.001.Pancreatic Surgery Group of Surgery Branch of Chinese. Guideline for the diagnosis and treatment of pancreatic adenocarcinoma(2014 edition)[J]. Chinese Journal of Digestive Surgery, 2014,13(11):831–837. doi:10.3760/cma.j.issn.1673–9752.2014.11.001.
[4]Yamaguchi K, Okusaka T, Shimizu K, et al. Clinical Practice Guidelines for Pancreatic Cancer 2016 From the Japan Pancreas Society: A Synopsis[J]. Pancreas, 2017, 46(5):595–604. doi:10.1097/MPA.0000000000000816.
