吡喹酮聚乳酸乙醇酸微球的制备和表征
2017-03-23操冰冰赵海燕罗玲何建丹王少兵
操冰冰+赵海燕+罗玲+何建丹+王少兵

摘要:采用O/W溶剂挥发法,以聚乳酸乙醇酸(PLGA)为基质材料制备了吡喹酮(PZQ)微球,并用HPLC、SEM、XRD和FTIR对药物进行了含量测定、形态观测,以及对药物在微球中的物理状态和药物与材料间是否存在相互间的作用力进行考察。结果表明:PZQ微球的包封率高达94.8%,微球外观圆整,表面多孔,结晶型的PZQ以无定型或分子状态分散于微球中,药物与聚合物材料PLGA没有相互间的作用力。载药微球包封率高,改变工艺条件对微球包封率影响很小,说明PLGA是一种合适包裹PZQ的载体材料。
关键词:吡喹酮;聚乳酸乙醇酸;O/W溶剂挥发法;包封率
中图分类号:R965 文献标识码:A 文章编号:1674-9944(2017)2-0127-03
1 引言
吡喹酮(praziquantel)為一高效广谱抗寄生虫药物,是迄今为止治疗血吸虫病最有效的药物和治疗包虫病的首选药物之一[1]。该药在口服时代谢较快,生物半衰期短(1~3 h),需频繁给药或加大给药剂量才能维持有效的治疗浓度[2]。针对此特点,将吡喹酮设计成缓控释制剂采用非口服给药,可以避免首过效应,提高其生物利用度。
聚合物微球具有控制药物释放、减小毒副作用甚至可能起到靶向的功能[3]。溶剂挥发法是最常用的微球制备方法,通常将药物溶解、分散或乳化于聚合物有机溶液,然后加到含有乳化剂的连续相中,持续搅拌不断挥发有机溶剂,从而得到固化的微小球状实体[4]。可用作微球的聚合物聚乳酸(PLA)[5]、聚乳酸乙醇酸(PLGA)[6]、聚己内酯(PCL)[7]、壳聚糖[8]和聚丙烯酰胺[9]等。其中,PLGA具有良好的生物降解性和生物相容性,具有较好的成囊和成膜性能[10],已被FDA批准为药物辅料收录于美国药典。
本研究将PZQ制备成PLGA微球后非口服给药,不仅可以有效避免肝的首过效应,而且还可以极大程度地提高PZQ的生物利用度,减少给药的次数,并且克服了PZQ口服用药的肝脏首过效应、生物半衰期短等不足。
2 实验部分
2.1 实验材料
PZQ(纯度 99%,上海嘉辰化工有限公司);PLGA(50∶50,分子量 5.5万,济南岱罡生物工程有限公司);聚乙烯醇(88%水解度,上海威呈化工有限公司);乙腈(色谱纯,美国天地);其它试剂均为市售分析纯。
2.2 微球的制备
采用O/W溶剂挥发法制备PZQ-PLGA载药微球:取50~250 mg PLGA分别溶于1 mL的二氯甲烷中,得到不同浓度的PLGA聚合物溶液,然后将一定量的微粉化药物(使理论载药量分别为10%、20%和40%)溶于聚合物溶液中。将所得溶液逐滴加入到200 mL 1% PVA水溶液中,在室温下以400 r/min搅拌速度机械搅拌4 h。减压过滤,以超纯水洗涤3次,每次10 mL,冷冻干燥 24 h,得到微球。
2.3 色谱条件
戴安UltiMate3000高效液相色谱仪,色谱柱:DikmaPlatisil ODS(250 mm × 4.6 mm, 5 μm),流动相为甲醇-水(71∶29),柱温30 ℃,紫外可变波长检测器,检测波长263 nm,流速1.0 mL/min,进样量 20 μL。
2.4 载药量测定
精密称取 20.0 mg 载药微球置于 10 mL容量瓶中,加 1.2 mL乙腈,超声使微球溶解,后加甲醇沉淀 PLGA并定容至刻度,摇匀,吸取1 mL溶液转移至离心管中以10000 r/min离心 15 min,得到样品溶液。取上清液测定微球中吡喹酮的含量。
2.5 微球形态
取少许微球均匀平铺于双面导电胶上,用洗耳球吹掉未固定牢固的微球,采用扫描电镜(SU-8010, Hitachi, Japan)观察微球表面形态。
2.6 粒径测定
将微球配制成混悬液,加入到激光粒度分布仪(HYL-1076型,山德瑞克仪器有限公司)样品池中,检测得出微球粒径。
2.7 X射线衍射
将干燥的微球均匀地平铺到样品槽内,X射线衍射仪(D8, Bruker, Germany)的工作电压设定为40 kV,工作电流设定为20 mA,以0.2°/min的速度扫描,扫描角度范围在5~70°,得到样品的衍射图谱。
2.8 红外光谱分析
将药物与微球分别均匀分散在KBr中,样品和KBr的比例为300∶2,采用压片法制成透明薄片,用傅立叶红外光谱仪(NICOLET 6700, Thermo Scientific , America)检测,扫描范围在400 ~4000 cm-1。
3 结果与讨论
3.1 微球制备
以载药量和包封率为评价指标,考察了药物与聚合物质量比、聚合物浓度、乳化速度等工艺参数的影响。
3.1.1 搅拌速度的影响
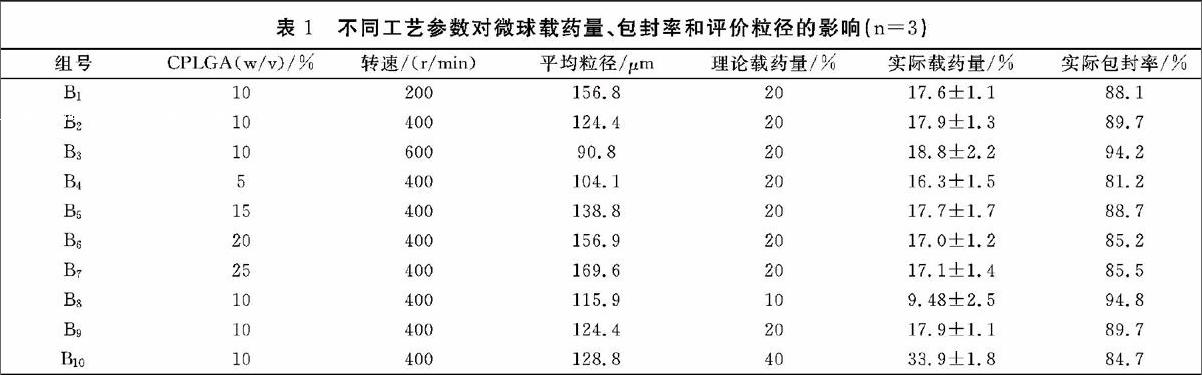
固定其它工艺参数,考察不同搅拌速度(200 r/min、400 r/min、600 r/min)对载药量和包封率的影响,结果发现随着搅拌速度的增加,粒径明显减小,但载药量和包封率没有显著变化(表1 B1、B2、B3)。理论上而言,微球粒径减小会促使更多药物朝水相中泄露导致包封率降低,但吡喹酮的包封率没有显著降低,这可能因为两方面原因:一是药物的水溶性太低致使药物朝水相泄露能力低;二是水相油相体积比较大导致乳滴快速固化,从而导致药物朝水相泄露差异较小。
3.1.2 聚合物浓度的影响
固定为理论载药量为20%、搅拌速度为400 r/min,考察了不同聚合物浓度5%、10%、15%、20%和25%(w/v)对载药量包封率的影响。结果表明,聚合物浓度为5%时药物包封率为81.2%,当聚合物浓度为10%时药物包封率提高为89.4%,但随着聚合物浓度继续提高,包封率没有显著变化(表1B2、B4-B7),于是优选PLGA聚合物浓度为10%。
3.1.3 不同投药量的影响
固定搅拌速度为400 r/min,PLGA聚合物浓度为 10%(w/v),考察了不同的投药量对粒径和包封率的影响,结果见表1(B8、B9、B10)。表中数据表明,随着投药量增加,平均粒径也增加,但包封率逐渐降低,说明投药量增加会导致更多药物泄露到水相中。
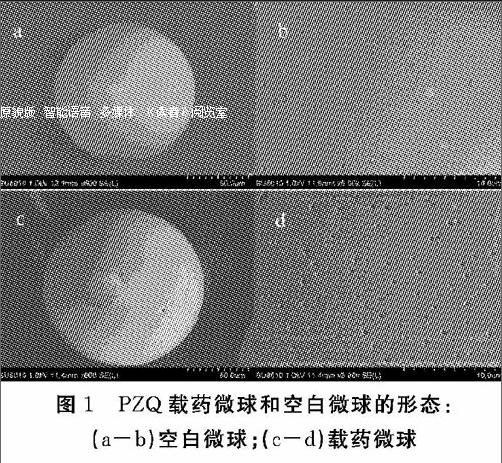
3.2 微球形态
载药微球和空白微球一样,都是表面光滑(图1 c和a),但在高放大倍数下可以观察到表面有许多细小的凹陷或孔隙(d和b),这些孔隙可能是微球固化过程中有机溶挥发所形成[31]。
3.3 X射线衍射分析
PZQ、PLGA和不同载药量微球的XRD结果如图2。PZQ在6~28°具有明显的特征衍射峰,与文献[11]报道一致,但在各个載药微球中都缺少药物特征衍射峰,提示PZQ是以无定型或分子状态分散于微球中。
4 红外光谱分析
PZQ-PLGA微球的红外图谱如图3所示,对于PZQ药物,分子的特征官能团羰基—C=O的伸缩振动在1630 cm-1,—CH、—CH2、—CH3伸缩在2900~3000 cm-1,—C—N伸缩振动在1000~1350 cm-1。对于PLGA空白微球,—CH、—CH2、—CH3伸缩在2850~3000 cm-1,—C=O的伸缩振动在1700~1800 cm-1,C—O伸缩在1050~1250 cm-1,—OH伸缩振动在3200~3500 cm-1。物理混合物(17.9%)和载药微球的红外图谱是各成分红外图谱的简单叠加,这表明药物和材料之间没有相互间作用力。
4 结论
研究采用O / W 法制备了PZQ-PLGA微球,通过对乳化速度、聚合物浓度和投药量的研究与优化,筛选出较满意的制备工艺,最佳制备条件下得到的微球包封率较高、表面圆整多孔。红外光谱研究表明PZQ与PLGA没有发生基团反应, XRD证实表面药物以无定型形态存在于微球中,并且药物的加入没有使PLGA的晶型发生变化。
参考文献:
[1]Urrea-Paris M A,Moreno M J,Casado N,et a1.Echinococcus granulosus:Praziquantel treatment against the metacestode stage[J].Parasitology Research, 1999,85(12):999~1006.
[2]Anadol D, Ozgelik U, Kiper N, et a1.Treatment of hydatid disease.Paediatr[J].Drugs, 2001, 3(2):123~135.
[3]Urrea-Paris,M,MorenoM,Casado N,et al.Relationship between the efficacy of praziquantel treatment and the cystic differentiation in vivo of Echinococcusgranulosusmetacestode[J].Parasit01.Res,2002,88(1):26~31.
[4]Ridtitid W,Ratsamemonthon K,Mahatthanatrakul W,et al.Pharmacokinetic interaction between ketoconazoleand praziquantel in healthy volunteers[J].J.Clin.Pharm.Ther,2007,32(6):585~593.
[5]Viswanathan N B, Tomas P A,Pandit J K, et al. Preparation of non-porousmicrospheres with high entrapment efficiency of proteins by a (water-in-oil)-in-oilemulsion technique [J]. J. Control. Release, 1999, 58 (1): 9~20.
[6]Carrasquillo K G, Stanley A M, Aponte-Carro J C, et al. Non-aqueous encapsulationof excipient-stabilized spray-freeze dried BSA into poly(lactide-co-glycolide)microspheres results in release of native protein [J]. J. Control. Release, 2001, 76 (3):199~208.
[7]Diwan M, Park T G. Pegylation enhances protein stability during encapsulation inPLGA microspheres [J]. J. Control. Release, 2001, 73 (2-3): 233~244.
[8]Choi H S, Seo S A,Khang G, et al. Preparation and characterization of fentanyl-loaded PLGA microspheres: in vitro release profiles [J]. Int. J. Pharm, 2002, 234(1-2): 159~203.
[9]Buntner B, Nowak M,Kasperczyk J, et al. The application of microspheres fromthe copolymers of lactide and ε-caprolactone to the controlled release of steroids [J].J. Control. Release, 1998, 56 (1~3): 159~167.
[10]蔡 晴,貝建中,王身国.乙交酯/丙交酯共聚物的体内外降解行为及生物相容性研究[J].功能高分子学报,2000,13(3):249~254.
[11]Bastian P,Bartkowski R,Khler H, et al. Chemo-embolization of experimentalliver metastases. Part I: distribution of biodegradable microspheres of different sizesin an animal model for the locoregional therapy [J]. Eur. J. Pharm. Biopharm., 1998,46 (3): 243~254.
Preparation and Characterization of Praziquantel Loaded PLGA Microspheres
Cao Bingbing,Zhao Haiyan,Luo Ling,He Jiandan,Wang Shaobing
(School of Pharmaceutical Sciences, South-Central University for Nationalities, Wuhan,Hubei 430074,China)
Abstract: This paper aimedto prepare and characterize PZQ loaded PLGA microspheres. The PLGA microspheres were prepared by O/Wemulsion-solvent evaporation method.The drug content,drug release in vitro,the morphology of the microspheres,the physical state of the drug in the microspheres and the interaction between drugs and materials were determined respectivelyby HPLC,SEM, XRD and FTIR.The encapsulation efficiency of microspheres wasas high as 94.8%,the morphology of microspheres wereround and the surface of microspheres were porous.The crystalline PZQformed as amorphous or molecular state in the microspheres.There was no molecular interaction between PZQ and PCL, whichcould solve the problem of first pass effect and fast metabolism in vitro.The encapsulation efficiency of drug loaded microspheres was high and the influence of process conditions on the encapsulation efficiency was very small,which indicated that PLGA was a suitable carrier material for PZQ.
Key words: PZQ;PLGA;O/W emulsion-solvent evaporation method;encapsulation efficiency
