长链共轭聚席夫碱的合成与红外发射率性能研究
2017-03-22尤玲丽徐国跃曾祥雄
尤玲丽,徐国跃,孟 雪,李 卫,刘 宁,曾祥雄
长链共轭聚席夫碱的合成与红外发射率性能研究
尤玲丽1,2,徐国跃1,2,孟 雪1,2,李 卫1,2,刘 宁1,2,曾祥雄1,2
(1. 南京航空航天大学材料科学与技术学院,江苏 南京 210016;2. 江苏省先进无机功能复合材料协同创新中心,江苏 南京 210016)
应用溶液缩聚法,分别合成了4种不同结构(主链未含杂环和含有杂环)的长链共轭聚席夫碱;产物通过元素分析仪、核磁共振仪、紫外-可见光谱仪和红外光谱仪进行结构表征;分别测量了聚席夫碱的室温电导率和8~14mm红外发射率。结果表明芳香杂环改性的长链共轭聚席夫碱具有较高的室温电导率和较低的红外发射率。
席夫碱;共轭结构;电导率;红外发射率;芳香杂环改性
0 引言
随着现代科学技术的迅速发展,低探测技术在军事以及民用的重要性越来越显著,红外低探测技术作为其中重要内容,一直是世界各国竞相研究的热门课题。红外低探测技术可采取的措施包括:变更红外辐射波段、减弱红外辐射强度和改变红外辐射的传输过程3个方面[1-3]。其中减弱红外辐射强度较其他两种措施更易实现,即在目标表层进行热红外伪装涂料的涂覆。
粘合剂、颜填料和涂装工艺等因素对热红外伪装涂料的发射率有一定的影响,其中填料对其影响不容忽视[4-6]。金属填料由于其高反射性,对热红外伪装涂料的发射率有明显的降低作用[4-7],却无法很好地实现涂料对红外光和雷达波及可见光的兼容作用;多数无机填料由于在热红外辐射波段TIR有着宽频段的强烈的吸收[8],对涂料发射率的降低并没有很好地效果;有机填料因为其特有的繁杂的C2N2O构造,在热红外波段有明显的强吸收频谱,所以在热红外伪装涂料中亦较少使用[9-10];近年来,导电高分子材料材料由于宽范围的其可调节的电导率,引起了各国科研工作者的极大兴趣。其中的导电席夫碱材料由于长链共轭结构及亚胺(C=N)基团,具有一定的研究价值。
研究表明席夫碱电导率的变化会引起红外发射率的变化[11],电导率较高的席夫碱具有较低的红外发射率。延长共轭长度、引入金属离子能够有效起到提高电导率,降低红外发射率的作用[12]。此外,主链芳香杂环改性也可提高导电率。本文合成了四种长链共轭聚席夫碱,研究了主链引入芳杂环对聚席夫碱电导率和红外发射率的影响,望有助于探究席夫碱材料未来在热红外伪装涂料中的发展。
1 试验材料及方法
1.1 试验材料及设备
试验药剂:乙二醛水溶液40%(CP),对苯二甲醛,对苯二胺,2,6-二氨基吡啶,DMAC等,均为分析纯。
试验仪器:DF-Ⅱ集热式磁力加热搅拌器,元素分析仪,Bruker DXR 500型核磁共振仪,Cary 300型UV-Vis吸收光谱仪,Nexus 870型傅里叶变换红外光谱仪,四探针电导测试仪,IR-Ⅱ型红外发射率测量仪。
1.2 试验方法
1.2.1 乙二醛缩对苯二胺聚席夫碱的合成
称取0.02mol(2.16g)对苯二胺溶于100mL DMAC,加入至250mL三口烧瓶中,再向其中加入0.02mol(2.90g)乙二醛40%水溶液。N2保护下,80℃搅拌反应12h。反应的进行过程伴随着溶液颜色变化,由黄色变成橙红色。反应完成后,向烧杯中加入100ml蒸馏水,在玻璃棒不断地搅拌下,将烧瓶中的液体缓慢地倒入其中,混合液中逐渐有橙红色沉淀生成。将混合液进行抽滤处理,最后用蒸馏水和无水乙醇分别将滤饼洗涤2遍。50℃真空干燥12h至恒重,得橙红色粉末,计算产率为83.6%,其合成原理如图1所示。
1.2.2 对苯二甲醛缩对苯二胺聚席夫碱的合成
称取0.02mol(2.16g)对苯二胺溶于100mL DMAC,加入至250mL三口烧瓶中,再向其中加入0.02mol(2.68g)对苯二甲醛。N2保护下,80℃搅拌反应12h。反应的进行过程伴随着溶液颜色变化,由黄色变成橙黄色。反应完成后,向烧杯中加入100mL蒸馏水,在玻璃棒不断地搅拌下,将烧瓶中的液体缓慢地倒入其中,混合液中逐渐有橙黄色沉淀生成。将混合液进行抽滤处理,用蒸馏水和无水乙醇分别将滤饼洗涤2遍。50℃真空干燥12h至恒重,得橙黄色粉末,计算产率为71.6%,其合成原理如图2所示。
1.2.3 乙二醛缩2,6-二氨基吡啶聚席夫碱的合成
称取0.02mol(2.18g)2,6-二氨基吡啶溶于100mL DMAC,加入至250mL三口烧瓶中,再向其中加入0.02mol(2.90g)乙二醛40%水溶液。N2保护下,80℃搅拌反应12h。反应的进行过程伴随着溶液颜色变化,由黄色变成暗红色。反应完成后,向烧杯中加入100mL蒸馏水,在玻璃棒不断地搅拌下,将烧瓶中的液体缓慢地倒入其中,混合液中逐渐有红棕色沉淀生成。将混合液进行抽滤处理,用蒸馏水和无水乙醇分别将滤饼洗涤2遍。50℃真空干燥12h至恒重,得红棕色粉末,计算产率为79.1%,其合成原理如图3所示。
1.2.4 对苯二甲醛缩2,6-二氨基吡啶聚席夫碱的合成
称取0.02mol(2.18g)2,6-二氨基吡啶溶于100mL DMAC,加入至250mL三口烧瓶中,再向其中加入0.02mol(2.68g)对苯二甲醛。N2保护下,80℃搅拌反应12h。反应的进行过程伴随着溶液颜色变化,由黄色变成黄绿色。反应完成后,向烧杯中加入100mL蒸馏水,在玻璃棒不断地搅拌下,将烧瓶中的液体缓慢地倒入其中,混合液中逐渐有黄绿色沉淀生成。将混合液进行抽滤处理,用蒸馏水和无水乙醇分别将滤饼洗涤2遍。50℃真空干燥12h至恒重,得黄绿色粉末,计算产率为87.5%,其合成原理如图4所示。

图1 乙二醛缩对苯二胺聚席夫碱L1合成示意图

图2 对苯二甲醛缩对苯二胺聚席夫碱L2合成示意图

图3 乙二醛缩2,6-二氨基吡啶聚席夫碱L3合成示意图
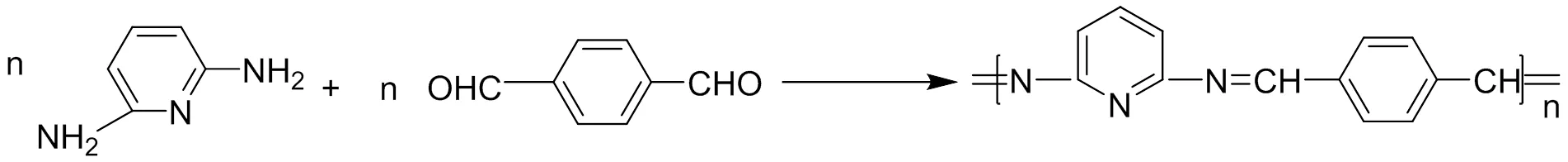
图4 对苯二甲醛缩2,6-二氨基吡啶聚席夫碱L4合成示意图
1.2.5 聚席夫碱L1、L2、L3、L4表征及性能测试
1)元素分析:用元素分析仪测定聚合物元素组成;
2)1H NMR光谱由Bruker DXR 500型核磁共振仪测试,溶剂为DMSO;
3)紫外-可见光谱:用Cary 300型UV-Vis吸收光谱仪测试;
4)红外光谱:采用溴化钾压片法,用Nexus 870型傅立叶变换红外光谱仪测试;
5)电导率的测定:20MPa压力下,将产物粉末压制成特定厚度的圆片,用四探针电导测试仪测试;
6)发射率的测试:用上海技术物理研究所研制的IR-Ⅱ型红外发射率测量仪。发射率测量仪开机后,先调整黑体温度为250℃,等到黑体温度稳定后,安装8~14mm滤光片对仪器进行校正,测量8~14mm波段的平均发射率。
2 试验结果与分析
2.1 聚席夫碱的元素分析
对聚席夫碱进行了C、H、N元素分析(如表1所示),对比各元素含量的测量值,测试结果与计算值接近,数据表明反应生成的聚合物具有与预想一致的结构。
2.2 聚席夫碱的核磁谱图分析
图5为聚席夫碱L1的核磁共振氢谱图(d6-DMSO)。其中,10.13ppm处的吸收峰是端基上醛基氢的吸收峰;8.42-8.13处的吸收峰是聚合物链上[-N=CH-]基团上的氢吸收峰;7.52-6.49ppm处归属于聚合物苯环上的氢化学位移;5.59ppm处的化学位移与聚合物端基上胺基氢的化学位移一致。
2.3 聚席夫碱的紫外光谱分析
利用Cary 300型UV-Vis吸收光谱仪测试聚席夫碱在200~800nm波段的紫外光谱,结果如图6~7所示。
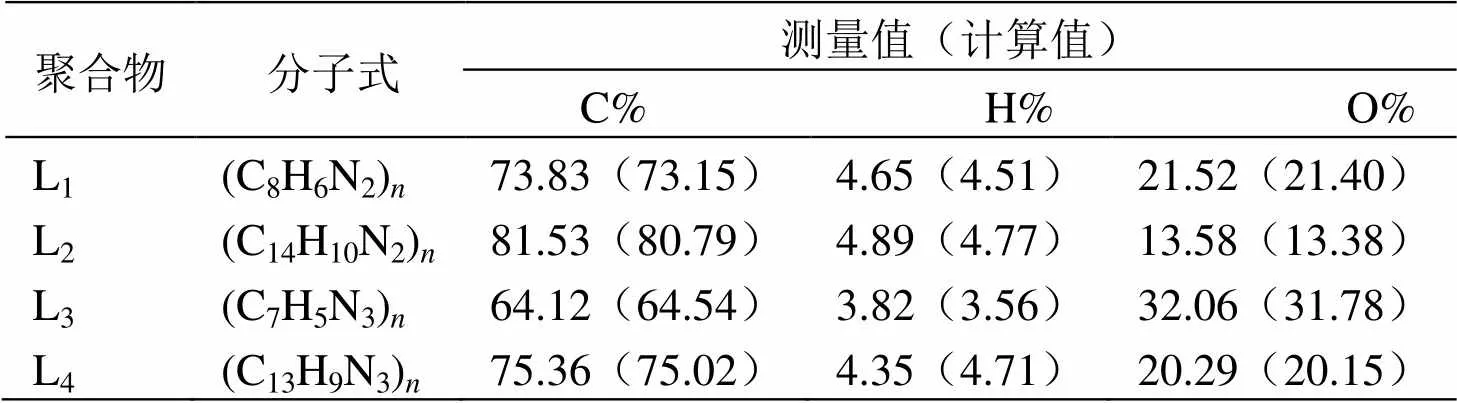
表1 席夫碱的元素分析

图5 聚席夫碱L1的核磁共振氢谱图(d6-DMSO)
Fig.5 The1H NMR of L1

图6 L1和L3的紫外光谱图
Fig.6 The UV spectra of L1&L3

图7 L2和L4的紫外光谱图
Fig.7 The UV spectra of L2&L4
根据图6和图7分析可知,长链共轭聚席夫碱在250~350nm波段内有较强的吸收峰,这是由于亚胺基-CH=N-的π-π*电子跃迁引起的;而在350~600nm波段内的吸收峰则是由于整个聚席夫碱共轭链中的π-π*跃迁引起的。
将聚席夫碱L3与L1,L4与L2的吸收峰位置分别比较可知,整个聚席夫碱共轭链中的π-π*跃迁波段吸收峰发生了红移,这主要是因为吡啶环的引入。吡啶环上存在缺电子的氮原子,当其被引入在聚席夫碱主链上时,由于氮原子的吸电子作用,导致聚席夫碱分子内电荷发生转移,拓宽了π电子的离域范围,进而降低了π→π*跃迁的禁带宽度[13]。
2.4 聚席夫碱的红外谱图分析
由图8和图9可以看出,单体的特征吸收峰——3200~3400cm-1(对应对苯二胺和2,6-二氨基吡啶中氨基的特征吸收峰)和1700cm-1(对应乙二醛和对苯二甲醛中羰基的特征吸收峰)在聚席夫碱的红外光谱图中并未出现,一个新的特征吸收峰在1600cm-1左右处出现,对应聚合反应生成聚席夫碱的亚胺(C=N)的特征伸缩振动吸收峰。这主要是由于单体缩聚生成了聚合物,氨基和醛基发生反应,所以其对应的特征吸收峰在聚席夫碱的红外谱图中变得非常弱,未能被观察到。

图8 L1和L3的红外光谱图
Fig.8 The IR spectra of L1&L3

图9 L2和L4的红外光谱图
Fig.9 The IR spectra of L2&L4
2.5 聚席夫碱电导率测量及分析
比对L1、L3及L2、L4的电导率可以发现:L1<L3,L2<L4(见表2);这主要是因为吡啶环的引入。吡啶环上存在缺电子的氮原子,当其被引入在聚席夫碱主链上时,由于氮原子的吸电子作用,导致聚席夫碱分子内电荷发生转移,拓宽了π电子的离域范围,从而降低了分子带隙,最终对聚合物电导率的提高起到帮助作用。

表2 席夫碱电导率
2.6 聚席夫碱红外发射率测量及分析
通过比较以上几种聚席夫碱的红外发射率可以发现,L1>L3,L2>L4(见表3);即芳杂环聚席夫碱的发射率比非芳杂环聚席夫碱发射率低。由前文可知,在聚席夫碱主链上引入缺电子的吡啶环基团,可以提高聚席夫碱的电导率,从而降低红外发射率。

表3 席夫碱8~14mm红外发射率

图10 席夫碱在8~14mm红外光谱图
图10是聚席夫碱在8~14mm波段的红外光谱图,可以看出纯芳香族聚席夫碱在8~14mm波段均有较强的吸收峰,当在其主链引入吡啶环后,聚席夫碱在8~14mm波段强吸收减弱,因而红外发射率呈降低趋势。
根据Hugan-Rubens近似理论[14],材料反射率约等于1-(8εw/a)1/2,即对于席夫碱材料来说,电导率越高,红外发射率一般越低,且以上实验结果也是与这个规律相吻合的,因此可以将提高席夫碱电导率作为降低其红外发射率的研究方向。
3 结论
1)本文通过溶液缩聚法,将胺与醛反应,合成了4种长链共轭聚席夫碱。
2)实验结果表明:在长链共轭聚席夫碱主链上引入缺电子的吡啶环基团,可以提高聚席夫碱的电导率,即可以对主链进行芳香杂环改性来提高聚合物的电导率。
3)共轭性芳杂环聚席夫碱有更低的红外发射率,其中对苯二甲醛缩2,6-二氨基聚席夫碱在8~14mm波段的红外发射率为0.671。
4)席夫碱类材料的电导率和红外发射率存在一定关系,电导率较高的席夫碱具有较低的红外发射率。
[1] 徐劲峰, 郭芳方, 徐政. 六角晶系钡铁氧体纳米晶的制备和表征[J]. 同济大学学报, 自然科学版, 2004, 32(7): 929-933.
Xu Jingfeng, Guo Fangfang, Xu Zheng. Synthesis and Characterization of Hexagonal Ba-ferrite Nanocrystals[J]., 2004, 32(7): 929-933.
[2] 王智勇, 刘俊能. 超细金属粉微波电磁性能的研究[J]. 航空材料学报, 1994, 14(3): 7-13.
Wang Zhiyong, Liu Junneng. Study on microwave electromagnetic properties of ultrafinemetal particles[J]., 1994, 14(3): 7-13.
[3] Yoshiaki Sawada, Yoshiteru Kageyama, Masashi Iwata, et al. Systhesis and magnetic properties of ultrafine iron particles prepared by pyrolysis of carbonnyl iron[J]., 1992, 31(12A): 3858-3861.
[4] 李新华, 陈雷, 孟晓雄, 等. 国外涂料型红外隐身材料研制现状和发展方向分析[J]. 红外技术, 1994, 16(1): 5-11.
Li Xinhua, Chen Lei, Meng Xiaoxiong. Development status quo of camouflage coatings and their future prospects[J]., 1994, 16(1): 5-11.
[5] Han Jingping. The Application Technique of the Stealth Coatings[J]., 2000.
[6] 张昭明. 几种红外隐身涂料的配制与性能探讨[J]. 南京理工大学学报, 1993(4): 71- 76.
Zhang Zhaoming. Preparation and properties of Infrared camouflaging[J]., 1993(4): 71-76.
[7] 张梅, 崔占臣, 蔡红莉, 等. 织物用热红外伪装涂料在8~14mm波段红外发射率的研究[J]. 天津工业大学学报, 2002, 21(2): 33-36.
Zhang Mei, Cui Zhancheng, Cai Hongli, et al. Study on infrared emissivity of thermal camouflage coating in 8~14 μm for fabrics[J]., 2002, 21(2): 33-36.
[8] 潘逴, 赵振声, 何华辉. 低红外发射率材料的研究[J]. 华中科技大学学报自然科学版, 2003, 31(7): 28-30.
Pan Chuo, Zhao Zhensheng, He Huahui. Research on low Infrared emissivity material[J]., 2003, 31(7): 28-30.
[9] HUGO GERD. Camouflage paint with low emission in heat radiation range and mfr. Process: 4418215[P]. 2015-11-30.
[10] BACH WOLFGANG, ASSFALG ALFONS. Materials for multispectral camouflage in the visual, IR and micro/millimetre-wave range: 3606691[P]. 1987-09-03.
[11] Nastasi M, Parkin D M, Gleiter H. Mechanical Properties and Deformation Behavior of Materials Having Ultra-Fine Microstructures[J]., 1993: 233.
[12] 胡映雪, 庄海燕, 徐国跃, 等. 不同结构席夫碱及其铁盐的合成与红外隐身性能研究[J]. 材料开发与应用, 2016, 31(1): 55-60.
Hu Yingxue, Zhuang Haiyan, Xu Guoyue, et al. The Synthesis and Infrared Stealth Performance of Schiff-bases of Different Structures and Their Iron Compounds[J]., 2016, 31(1): 55-60.
[13] Shi Shengyi. Synthesis and characterization of some novel conjugated polyoxadiazoles with Schiff base structure[J]., 2007, 14(4): 305-312.
[14] Chen Yuan, Liu Chongbo, Gong Yunnan, et al. Syntheses, crystal structures and antibacterial activities of six cobalt(II) pyrazole carboxylate complexes with helical character[J]., 2012, 36(1): 6-14.
Synthesis and Infrared Emissivity Propertiesof Long-chain Conjugated Polymer Schiff Bases
YOU Lingli1,2,XU Guoyue1,2,MENG Xue1,2,LI Wei1,2,LIU Ning1,2,ZENG Xiangxiong1,2
(1.,,210016,;2.,210016,)
In this paper, different structures of long-chain conjugated polymer Schiff bases (with heterocyclic aromatic or not) were synthesized via solution polycondensation. The synthetic products were characterized by UV and IR respectively. Beyond that, their electrical conductivity and infrared emissivity in 8-14mm were measured. Results show that long chain conjugated structure Schiff bases modified with heterocyclic aromatic have higher electrical conductivity and lower infrared emissivity, that is to say, they have the better infrared stealth performance.
Schiff-bases,conjugated structure,electrical conductivity,infrared emissivity,heterocyclic aromatic
TQ628.1
A
1001-8891(2017)03-0254-05
2016-08-17;
2017-01-04.
尤玲丽(1991-),女,湖北省十堰市人,硕士研究生,主要从事功能材料的研究。
江苏高校优势学科建设工程资助项目;国家自然科学基金项目(51403102);江苏省自然科学基金项目(BK20140811)。
