遗传标记在罗非鱼良种选育研究中的应用与展望
2017-03-20颉晓勇钟金香赵金良
颉晓勇,钟金香,赵金良
(1.广东省渔业生态环境重点实验室,中国水产科学研究院南海水产研究所,广东 广州510300;2. 广东省水产技术推广总站,广东 广州,510220;3.上海海洋大学,上海,201306)
遗传标记在罗非鱼良种选育研究中的应用与展望
颉晓勇1,钟金香2,赵金良3
(1.广东省渔业生态环境重点实验室,中国水产科学研究院南海水产研究所,广东 广州510300;2. 广东省水产技术推广总站,广东 广州,510220;3.上海海洋大学,上海,201306)
综述了在近些年中传统遗传标记罗非鱼良种选育相关研究中的应用情况,探讨了多种分子标记联合分析的必要性,展示了罗非鱼选育群体基于SSR/AFLP分别计算的Nei(1978)相似性系数比率稳定分布于0.942 07~0.963 70之间,而群体间SSR/AFLP遗传距离比率全都远大于1,具有良好的区分度。综合多种因素,推荐SSR作为罗非鱼良种选育群体遗传多样性水平的常规监测手段。并指出基于DNA序列测定与生物信息学技术开发的新型分子标记类型应当作为未来罗非鱼良种选育研究的重点方向。
罗非鱼;遗传标记;良种选育;综述
罗非鱼优良品种在育种过程中,群体遗传性状不可避免地受到保种规模、环境因素等生产条件变迁的影响。对于育种群体数量有限的罗非鱼选育过程中群体,在传代过程中极有可能出现管理不当、近交衰退、瓶颈效应等导致选育良种出现种质退化的风险。因此,进行不同遗传多样性方法对比,将为选择适宜的遗传多样性评估方法,展开对于优良品种传代过程中群体的常规遗传多样性水平监测建立必要的技术基础。
罗非鱼优良品种育种群体的遗传多样性是其遗传信息的总和。遗传多样性分析通常采用不同类型遗传标记工具,分析对象包括一个群体内不同个体或者种内不同群体,具体则以群体内及群体间的遗传变异总和来进行评价。当前研究报道中应用较为广泛的遗传标记主要包括四种类型,分别为形态学标记(morphological marker)、细胞学标记(cytologicalmarker)、生化标记(biochemical marker)、和分子标记(molecular marker)。形态标记主要是针对罗非鱼的外部形态特征,通常以肉眼观测即可简单区分,或者通过形态测量的方法进行。细胞标记主要是染色体的核型和带型,检测对象主要是分裂时期的染色体。生化标记是在蛋白质多态的基础上发展起来的,主要包括同工酶和贮藏蛋白。这三类标记都是生物内在遗传基因表达的结果,是对基因差异的间接反映,而且表达过程中易受到环境条件的影响,可以统称为基因表达结果类遗传标记。
1 基因表达结果类标记
1.1 形态标记
形态标记主要是针对肉眼可见的或仪器测量动物的外部形态,以其遗传待征为标记,具有简单、方便、易操作性的优势。这种方法在传统的遗传育种过程中仍然得到大量应用,育种工作者可以直接根据罗非鱼的体长、体高、体宽等,以及相对的生长速度差异等性状来进行优良品种的选择。郭金涛等[1]通过6个可数性状、10个可量性状及24个框架性状,比较分析了尼罗罗非鱼(Oreochromis niloticus♀)×萨罗罗非鱼(Sarotherodon melanotheron♂)杂交后代F1、F2形态性状的遗传与变异特征,建立了不同群体的可数性状、可量与框架性状的判别公式,其杂交F1形态遗传了双亲的形态特征,且有一定的偏母遗传。唐瞻杨等[2]以尼罗罗非鱼不同月龄个体为研究对象进行了形态性状主成分及其判别分析,基于不同阶段生长指标主成份差异,得到了尼罗罗非鱼形态指标的增长规律,并判定了其最佳生长季节体格与月龄的关系。
1.2 细胞标记
细胞标记是对经过固定、压片、染色等程处理过的染色体,主要包括染色体相对长度、着丝点位置、臂比值、臂指数等指标,分析染色体核型和带型及缺失、重复、易位、倒位等。李思发等[3]对尼罗罗非鱼和萨罗罗非鱼正反杂交子代的头肾细胞的核型进行了比较,发现4种遗传型罗非鱼具有相同的染色体二倍数(2n=44)和总臂数(NF=50),但各具不同的染色体类型,正反杂交子代表现为介于双亲之间的混合类型。朱华平等[4]采用体腔注射PHA-空气干燥法对橙色莫桑比克罗非鱼(Oreochromismossambicus)和荷那龙罗非鱼(O.hornorum)染色体数量、形态和核型进行了分析,结果显示两种罗非鱼染色体核型公式均为2n=44,6sm+24st+14t,NF=50,用常规染色体染色的方法难以区分,表明这两种罗非鱼的常规核型差异不显著,在分类地位上非常接近。
1.3 生化标记
生化标记主要指血型、血清蛋白及同工酶等,是鉴定外源DNA和研究物种起源及进化方面的有效工具。同工酶是生物体内催化同一化学反应但具有不同分子结构的蛋白质分子,同工酶标记表现为共显性,需要的实验材料少,操作简便,检测结果较为稳定,目前仍是生物群体遗传特性研究中应用较多的一种分析方法。同工酶作为基因表达的产物,是一种可靠的遗传标记。李思发等[3]采用同工酶电泳方法检测了尼罗罗非鱼和萨罗罗非鱼正反杂交子代的肾、肝、眼、肌肉、心中乳酸脱氢酶等4种同工酶的表型差异,推测核型和同工酶方面的差异可能是导致这两种不同属罗非鱼生殖隔离的遗传原因。杨淞等[5]采用聚丙烯酰胺凝胶垂直电泳法分析了酯酶(EST)、超氧化物歧化酶(SOD) 和乳酸脱氢酶(LDH) 3种同工酶在荷那龙罗非鱼(Oreochromis hornorum)和莫桑比克罗非鱼(O.mossambicus)肝脏、心脏、肌肉、脑和肾脏5种器官组织中的表达情况,表明两种罗非鱼的这3种同工酶均具有明显的组织特异性,且EST-7和EST-8仅分别存在于莫桑比克罗非鱼的心脏和脑器官中,可作为鉴别两种罗非鱼的标记。
2 DNA分子标记
遗传多样性的表现方式多种多样,通常以遗传变异程度的高低进行衡量。遗传多样性的本质则是遗传物质DNA分子的多态性。与基于基因表达结果类遗传标记相比,DNA 分子标记是对个体间核苷酸序列变异的直接分析,是遗传变异的直接反映,相较而言具有独特的遗传稳定性、可靠性和准确性。
目前罗非鱼良种选育研究报道中应用的DNA标记技术已有多种,主要包括针对核基因对象的限制性片段长度多态性(RFLP)、随机扩增多态性DNA(RAPD)、扩增片段长度多态性(AFLP)、简单重复序列(SSR)、源于表达序列标签 (EST)库的SSR(EST-SSR)和单核苷酸多态性(SNP) 等,以及针对细胞器基因(包括片段)序列多态性等,这些DNA 标记技术各具特色,各有所用。有关这些技术的特征详见另文介绍。
2.1 不同种类DNA标记对比分析
采用不同种类标记对进行对比研究的报道在植物学领域相对较多,而动物学尤其是在鱼类方面比较少。如Russell et al[6]采用RFLPs,RAPDs,SSRs,AFLPs四种方法对大麦进行遗传差异分析,发现得到的基因多样性指数分别为0.322,0.521,0.566,0.937;遗传相似度估计值分别为0.843,0.879,0.829,0.924。Patzak 等[7]对啤酒花(Humulus lupulus L.)遗传变异采用四种分子标记系统进行了分析;Uptmoor等[8]对高梁(Sorghum bicolor)采用RAPD、AFLP、SSR三种多态性标记进行了研究;Belaj等[9]对橄榄采用RAPD、AFLP、SSR分析,认为分辨能力(discriminating capacity)AFLP为0.99,SSR为0.90,RAPD为0.85;区分功效(discriminating power)为AFLP>SSR>RAPD。
2.2 基于不同标记方法的联合分析
2.2.1 不同标记联合分析群体遗传多样性 在之前的绝大多数罗非鱼遗传分析报道中,通常都是仅采用1种或2种遗传多样性分析手段对同一套育种动物群体进行分析评价,原因主要可能是由于受到实验方法和技术手段等的限制。但是近年来,随着实验操作技术的改进和自动化程度的提高,同时采用表型、等位酶等基因表达结果类遗传标记分析方法,以及多种DNA分子标记手段,对同一套试验材料和进行综合评价,以求获得对研究材料更为深入的理解,正在逐渐成为一种发展趋势[10],而且通过不同类型研究方法得到的结果有些情况下可能比较吻合,有些却会展现出较大差异。因此,如何对不同方法得到的结果进行综合评价,是遗传多样性分析中出现的新课题。
任何遗传多样性的研究方法都是从特定的角度进行探讨,各自有其理论上或者实际应用上的优点和缺点。但毫无疑问的是任何一种检测遗传多样性的方法本身都存在一定程度上的局限性,目前来说还找不到一种可以完全替代其他方法的技术,也即没有一种方法可以完美解决所有问题。因此,可以说用任何一种遗传标记方法分析得到的遗传多样性参数结果都具有一定的片面性,无论该分析手段多么先进。如果要想更深入、全面、准确地了解罗非鱼良种选育群体的遗传多样性状况,只有尽可能地采取多种遗传多样性分析方法进行联合分析,以实现不同方法间的相互弥补和综合从而获得完整的遗传多样性信息。
2.2.2 不同标记分析群体遗传多样性时的横向比较研究 李莹莹[11]综合研究了牡丹遗传多样性分析与品种鉴定中分子标记的应用情况,发现同时应用两类不同分子标记方法对牡丹资源进行横向对比的报道几乎为空白,新型目的基因分子标记研究对传统DNA分子标记提供了补充,提出应当加强不同标记技术在牡丹资源研究中的联合应用。罗非鱼良种选育研究中不同类型分子标记间的横向对比研究同样接近于空白[12-13]。在新吉富罗非鱼选育群体mtDNA Cytb和D-loop基因序列特征分析的基础上,笔者基于学界对于两种技术所得到的遗传变异数据之间关系所知无几的严峻状况,开展了罗非鱼良种选育群体源于Cytb和D-loop基因的序列遗传变异和遗传结构对比分析,以期为针对不同种类经济动植物优良品种育种对象,选择不同的遗传标记分析方法,以及扩展研究结果之间横向比较提供方法上的参考,使得研究结果相比较更加逼近客观事实,加强研究结果的应用价值。
以新吉富罗非鱼选育群体F0、F6~F9共5代为材料,基于SSR方法和AFLP方法,按SSR/AFLP分别计算得到的5个选育群体间Nei(1978)相似性系数比率及遗传距离比率结果如表1所示。
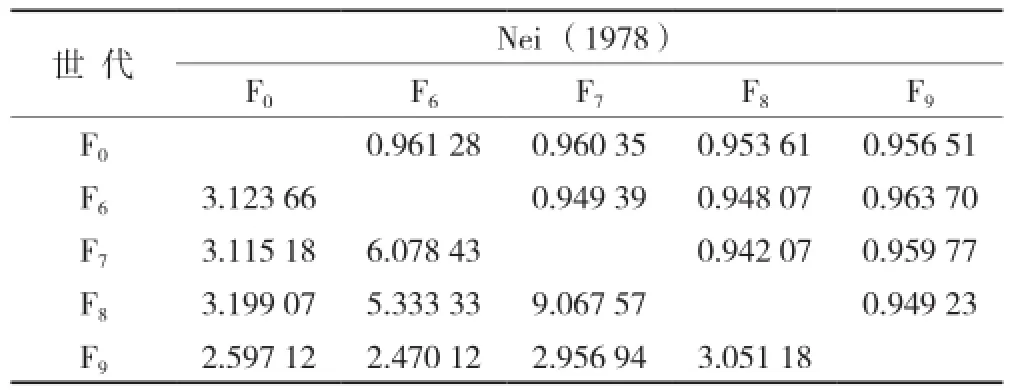
表1 群体间Nei相似性系数(1978)比率(右上角)及遗传距离比率(左下角)
从表1中可以看出群体间SSR/AFLP遗传相似性比率有很好的稳定性,群体间SSR/AFLP遗传距离比率全都远大于1,具有良好的区分度。众多类似研究也表明SSR具有多态性高、重复性好等特点,尤其是适用于其他标记类型揭示变异水平低的物种[14]。结合微卫星相比较更加便捷高效的优势,就建立优良品种选育群体的常规遗传多样性水平检测工具而言,SSR为更适宜于罗非鱼选育群体遗传多样性常规检测的分析方法。
2.2.3 不同标记联合用于建立遗传连锁图谱 联合应用不同遗传标记,目前已经建立一些具有重要经济性状养殖品种的遗传连锁图谱。Kocher[15]对于尼罗罗非鱼率先建立遗传连锁图谱,其作图群体采用的是来自一个母本的41个单倍体胚胎组成的家系,由62个微卫星标记和112个AFLP标记构成30个连锁群,平均23.5 cM,总图距为1 000~2 000 cM。Agresti[16]采用三杂交罗非鱼(以奥利亚罗非鱼和尼罗罗非鱼的雄性杂交子一代作父本,雌性莫桑比克罗非鱼作母本)构建作图群体,共得到214个分离的标记(包括60个微卫星位点,154个AFLP位点),组成24个连锁群。McConnell[17]报道了采用尼罗罗非鱼和奥利亚罗非鱼杂交子代为作图群体,得到9个微卫星标记构成4个连锁群。
3 展 望
各种遗传标记的大量应用在罗非鱼良种选育实践中发挥了重要作用。然而对于基因定位和QTL作图来说,现有文献中能提供的遗传连锁图谱精细度需要持续不断的大幅度提高,目前已经开发出来的遗传标记数量还远远不能满足罗非鱼遗传标记辅助育种生产实践的需求。
随着基因测序技术的飞速发展,DNA测序进入个体特异性测序新阶段。顺应国际研究潮流,未来罗非鱼育种遗传标记相关研究主要应当从以下几个方面来考虑。(1)DNA序列多态性技术。由于测序成本的大幅度下降,DNA序列多态性分析在操作上越来越简单易行,未来将成为遗传多样性分析的主要工具之一。一些细胞器如线粒体DNA[18-19],因其进化快速的特征而成为罗非鱼良种选育中DNA序列多样性分析的首选。(2)目前国际主要的生物信息数据库允许各研究机构随时提交各种序列,海量DNA序列信息被累积储存于各个大型公共数据库。因此,充分利用公开DNA序列信息开发新标记是相对而言更为经济有效的方法。比如与传统寻找微卫星的方法相比,Varshney于2005年指出EST-SSR更为简捷快速[20]。2003年开发的目标区域扩增多态性(TRAP)标记技术,具有简单、高通量的优势[21]。马庆男等[22]建立了罗非鱼TRAP分子标记反应体系,丰富了罗非鱼遗传多样性评价、种质鉴定、分子标记辅助育种等研究手段。1996年开发的cDNA-AFLP 技术[23],在研究cDNA差异显示的同时,还可以揭示基因的功能。2007年Begge提出功能标记的概念[24],即从影响特定遗传性状变异的基因功能域开发分子标记,可以预计其应用于标记辅助选择育种可有效提高选择效率。这些基于测序与生物信息学技术开发的分子标记技术必将在罗非鱼良种选育研究领域发挥重要的作用。
[1] 郭金涛,赵金良,甘远迪,等. 尼罗罗非鱼(♀)×萨罗罗非鱼(♂)杂交后代F1、F2形态性状的遗传与变异[J]. 中国水产科学,2014,21(2): 275-282.
[2] 唐瞻杨,肖 俊,李莉萍,等. 尼罗罗非鱼(Oreochromis niloticus)不同月龄性状的主成分与判别分析[J]. 海洋与湖沼,2012,43(2):288-293.
[3] 李思发,赵 岩,范武江,等. 尼罗罗非鱼和萨罗罗非鱼遗传生殖隔离的初步证据[J]. 动物学研究,2011,32(5):521-527.
[4] 朱华平, 卢迈新, 黄樟翰, 等. 橙色莫桑比克罗非鱼和荷那龙罗非鱼的染色体核型分析[J].淡水渔业,2009,39(5):18-22.
[5] 杨 淞,黄樟翰,叶 星,等. 荷那龙罗非鱼和莫桑比克罗非鱼3种同工酶的分析[J]. 大连水产学院学报,2006,21(2):122-126.
[6] Russell J R,Fuller J D,Macaulay M,et al. Direct comparison of levels of genetic variation among barley accessions detected by RFLPs,AFLPs,SSRs and RAPDs[J]. Theo Appl Genet,1997,95:714-722.
[7] Patzak J. Comparison of RAPD,STS,ISSR and AFLP molecular methods used for assessment of genetic diversity in hop (Humulus Lupulus L.)[J]. Euphytica,2001,121:9-18.
[8] Uptmoor R,Wenzel W, Friedt W, et al. Comparative analysis on the genetic relatedness of Sorghum Bicolor accesstions from Southern Africa by RAPDs, AFLPs and SSRs[J]. Theo Appl Genet,2003,106:1316-1325.
[9] Belaj A,Satovic Z,Cipriani G,et al. Comparative study of the discriminating capacity of RAPD,AFLP and SSR markers and of their effectiveness in establishing genetic relationship in olive[J]. Theo Appl Genet, 2003,107:736-744.
[10] 罗建勋,杨龙华,辜云杰,等. 云杉天然群体遗传多样性的综合评价[J].西北农林科技大学学报(自然科学版),2011,39(4):69-76.
[11] 李莹莹. 分子标记在牡丹遗传多样性分析与品种鉴定中的应用[J].生物技术,2014,24(3):87-91.
[12] 颉晓勇,李思发. 罗非鱼选育群体Cytb与D-loop序列变异信息对比分析[J].基因组学与应用生物学,2014,33(5):982-985.
[13] 颉晓勇,钟金香,李思发. 基于Cytb与D-loop的罗非鱼选育群体遗传结构对比分析[J]. 湖南农业科学,2014,(23):74-76.
[14] 颉晓勇,李思发,蔡完其. 吉富品系尼罗罗非鱼选育过程中遗传变异的微卫星分析[J].水产学报,2007,31(3):385-390.
[15] Kocher T D,Lee W J,Sobolewska H,et al. A genetic linkage map of a cichlid fish,the tilapia (Oreochromis niloticus) [J]. Genetics,1998,148: 1225-1232.
[16] Agresti J J,Seki S,Cnaani A,et al. Breeding new strains of tilapia:development of an artificial center of origin and linkage map based on AFLP and microsatellite loci[J]. Aquaculture,2000,185(1-2):43-56.
[17] McConnell S K,Beynon C,Leamon J,et al. Microsatellite marker based genetic linkage maps of Oreachromis aureus and O.niloticus(Cichlidae): extensive linkage group segment homologies revealed[J]. Anim Genet,2000,31:214-218
[18] 颉晓勇,李思发,蔡完其. 基于D-loop 序列的罗非鱼选育群体遗传变异分析[J]. 上海海洋大学学报, 2011,20(3):336-341.
[19] 颉晓勇,李思发. 基于细胞色素序列的罗非鱼选育群体遗传变异分析[J].暨南大学学报(自然科学与医学版),2014,35(5):439-444.
[20] Varshney R K,Graner A, Sorrells M E. Genic microsatellite markers in plants:features and applications[J]. Trends in Biotechnology,2005,23: 48-55.
[21] 杜晓华,王得元,巩振辉. 目标区域扩增多态性(TRAP):一种新的植物基因型标记技术[J]. 分子植物育种,2004,2(5):747-750.
[22] 马庆男,董在杰,朱文彬,等. 罗非鱼TRAP分子标记反应体系优化设计方案的比较[J]. 南方水产科学,2013,9(1):28-34.
[23] Bachem C W B,Van Der Hoeven R S,Debruijn S M,et al.Visualization of differential gene expression using a novel method of RNA fingerprinting based on AFLP-analysis of gene expression during potato tuber development[J].The Plant Journal,1996,9(5):745-753.
[24] Begge M,Xia X,Lubberstedt T. Functional markers in wheat[J]. Curr. Opin. Plant Biol.,2007,10(2):211-216.
(责任编辑:高国赋)
Application and Prospect of Genetic Markers in Tilapia Breeding
XIE Xiao-yong1,ZHONG Jin-xiang2,ZHAO Jin-liang3
(1. Key Lab. of Fishery Ecology and Environment, Guangdong Province, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, PRC; 2. Fishery Technical Extension Center of Guangdong, Guangzhou 510220, PRC; 3. Shanghai Ocean University, Shanghai 201306, PRC)
In this paper, the application of the traditional genetic marker tilapia breeding in recent years was reviewed. The necessity of the combined analysis of several molecular markers was pointed out. The similarity coefficient ratios of Nei (1978) calculated respectively by SSR/AFLP were between 0.942 07 and 0.963 70 in the tilapia breeding population, meanwhile the genetic distances ratios of Nei (1978) calculated by SSR/AFLP among populations were much larger than 1, which revealed the discrimination ability of SSR. Based on several factors, SSR was recommended as a routine monitoring method for genetic diversity of Tilapia breeding. And it was pointed out that the new type of molecular marker based on DNA sequencing and bioinformatics development should be the focus of the future study of tilapia breeding.
tilapia; genetic marker; breeding; riview
Q347
:A
:1006-060X(2017)02-0123-04
10.16498/j.cnki.hnnykx.2017.002.031
2016-11-03
国家“十五”攻关项目(2001BA505B0513);中央级公益性科研院所基本科研业务费专项资金(2007TS04)
颉晓勇(1976-),男,甘肃天水市人,副研究员,研究方向为水产动物种质资源与养殖技术研究。
