花生酰基载体蛋白硫酯酶(FATB2)基因的克隆与表达分析
2017-03-20李昊远郝翠翠潘丽娟陈明娜禹山林侯艳华迟晓元
李昊远,郝翠翠,潘丽娟,陈明娜,陈 娜,王 冕,王 通,禹山林,侯艳华,迟晓元*
(1. 哈尔滨工业大学(威海)海洋科学与技术学院,山东 威海 264209; 2. 山东省花生研究所,山东 青岛 266100; 3. 青岛科技大学海洋科学与生物工程学院,山东 青岛 266042)
花生(ArachishypogaeaL.)是世界四大油料作物之一,我国花生年产量约17 Mt,居世界首位,其中用于榨油的占40%左右[1]。花生中油脂含量44%~58%,高于大豆、油菜,仅次于芝麻[2]。花生种子中含有多种饱和脂肪酸和不饱和脂肪酸,其含量直接影响花生的品质和价值。选育营养健康的油用型花生新品种已经成为花生近年来研究的热点[3]。
在脂肪酸合成过程中酰基载体蛋白硫酯酶(FAT)是调节脂肪酸碳链延长的关键酶,它能催化水解硫酯键,使脂肪酸的合成终止,其活性影响植物中各种脂肪酸的含量[4]。在植物中,根据底物偏好性将FAT分为FATA和FATB两个家族,并均定位于叶绿体中[5]。但不同FAT对底物的选择不同,其中FATA基因家族对油酯-ACP(C18:1-ACP)的活性最高,直接决定着植物体内C18:1输出到质体外的水平,对C16:1-ACP和C18:0-ACP活性较低,对C16:0-ACP活性最低。FATB基因家族则主要倾向于以饱和脂肪酸为底物,但有报道称某些FATB对不饱和脂肪酸也有特异的活性[6]。作为一个家族,FATB具有广泛的底物特异性,可水解从C8到C18的脂酰-ACP。这种不同的底物特异性直接导致了植物油脂含量的差异[7-9]。
利用FAT的这个特性,许多研究者通过改变其底物特异性,使生物体积累更多的特殊脂肪酸[10-11]。前人将7种硫酯酶基因导入大肠杆菌中,使其过表达,产生游离脂肪酸的最高含量达到346.4 mg/L,约是野生型的13倍,同时也产生了野生型中并不存在的C12链长的脂肪酸[12]。在拟南芥基因组中含有两个FATA基因和一个FATB基因[13],其中FATB基因发生突变后,拟南芥各组织饱和脂肪酸的含量比野生型下降40%~50%,拟南芥突变体的生长受到抑制,植株变得 矮小,4周幼苗的高度只相当于同期野生型的一半。由此可见FATB在植物生长过程中具有极其重要的作用[14]。FATB除在脂肪酸合成中发挥着重要作用,还参与植物过敏反应和低温胁迫。拟南芥中AtFATB可通过影响游离脂肪酸数目和种类而影响超长链脂肪酸的合成,使感染位置的细胞不发生程序性死亡,植株也就因此失去了过敏反应的保护[15]。将蜡梅硫酯酶基因CpFATB转入苜蓿中,提高了苜蓿的越冬率,说明外源CpFATB基因有助于苜蓿抗寒性的提高[16]。
在其他植物中FATB的催化能力、底物偏好及异源表达得到了广泛的研究[17-19],但在花生中FATB基因相关研究报道较少。本研究从花生中分离得到了AhFATB2基因,基因登录号为KP109926,并采用荧光定量PCR分析了其时空表达特性、非生物胁迫和激素处理下的表达特性。对花生AhFATB2基因的研究为将来改良花生品种提供了基因资源。
1 材料与方法
1.1 植物材料
选用的花生品种为花育33号。播种花生种子于营养土与蛭石2:1(m/m)的混合土中,置于光照培养箱中培养,16 h(28℃)光照, 8h(22℃)黑暗。待花生幼苗生长到三叶期时,分别采集根、茎、叶、子叶和下胚轴,在花生盛花期采集花生花。待花生开花下针后,分别采集下针后12 d、24 d、36 d、48 d和60 d的种子。
花生生长到三叶期后进行多种非生物胁迫处理。水杨酸(SA,2 mmol/L)、过氧化氢(H2O2,10 mmol/L)、赤霉素(GA,100μmol/L)、乙烯利(ET,5 mmol/L)和脱落酸(ABA,100 μmol/L)、茉莉酸(JA,100 μmol/L)、盐(NaCl 200 mmol/L)、低温(4℃)、干旱(15% PEG6000)均处理0h、4h、8h、12h、24h、72h;对照组:ABA和GA以相同浓度乙醇作为对照,其他以清水作对照。除低温处理外,在进行处理时,应先将花生三叶期幼苗从土中小心取出,清洗去除根部泥土,再置于相应条件下接受处理。除低温、盐和干旱处理外,其余处理还需要用溶液涂抹花生叶片。在处理的不同时间段分别取花生幼苗的叶片,放入液氮中冷冻保存备用。
1.2 总RNA提取与cDNA合成、目的基因的扩增
在NCBI上搜索到拟南芥三个蛋白序列,分别是AtFATA1(NP_189147.1),AtFATA2(NP_193041.1)和AtFATB2(NP_172327.1)。利用Bioedit软件从花生cDNA文库(共计36 741条EST序列)中搜索与上述三个拟南芥的氨基酸序列相似性较高的序列,作为候选基因。最终从已知的花生cDNA文库中找到了1个可能编码AhFATB2基因的全长序列。根据此序列,使用Primer 5软件设计基因全长引物。引物序列为FATB2-F: 5’-ATGGTTGCTACTGCTGCTAC-3’和FATB2-R: 5’-TCAGTTTTCTGCTGGAAAAA-3’。
参照陈娜等[20-21]的方法提取花生叶片总RNA并进行反转录。以cDNA为模板,通过PCR技术扩增获得目的基因。PCR反应条件如下:94℃ 2 min;94℃ 30 s,58℃ 30 s,72℃ 2 min,35个循环;72℃ 10 min。用琼脂糖凝胶电泳验证得到的扩增产物,并进行胶回收,将回收的产物测序。将测序得到的序列进行拼接,得到AhFATB2基因全长序列,提交到GenBank中。
1.3 序列分析
采用NCBI网站(http://www.ncbi.nlm.nih.gov)的ORF finder工具查找基因的开放读码框;根据在线网站ExPASy中的ProtParam工具(http://www.expasy.org/tools/protparam.html)分析蛋白质的基本物理化学参数;应用DAS跨膜预测网站(http://www.sbc.su.se/~miklos/DAS)分析蛋白的跨膜结构;使用Proscale工具进行亲疏水性预测;应用Target P软件(http://www.cbs.dtu.dk/services/TargetP)对蛋白的亚细胞定位进行预测;应用ExPASy网站的SCRATCH Protein Predictor Tool和PredictProtein预测蛋白的二级结构。
1.4 多序列比对与系统发育分析
利用NCBI网站的BlastP工具分别对克隆得到的基因进行基因序列的相似性及同源性查找,并利用这些序列进行基因同源性比较。结合Clustal X和BioEdit软件将下载序列与AhFATB2序列进行比对,通过比对来寻找序列之间的相似区域和保守性位点,寻找可能的进化关系。
为了更好地分析确定AhFATB2蛋白的进化关系,利用已知AhFATB2蛋白的氨基酸序列在phytozome 12.1(http://www.phytozome.org/)和peanutbase(http://peanutbase.org/home)数据库中与拟南芥(Arabidopsisthaliana,At)、大豆(Glycinemax,Gm)、蒺藜苜蓿 (Medicagotruncatula,Mt)、小立碗藓(Physcomitrellapatens,Sph)、团藻(Volvoxcarteri,Vocar)、花生野生种(Arachisipaensi,Ai和Arachisduranensis,Ad)等物种的基因组数据进行BLAST,搜索FAT基因。利用MEGA 5.1将AhFATB2和不同物种的FATs进行比对,采用Neighbour-Joining(距离邻接法)方法构建系统发育树。
1.5 荧光定量PCR
采用Roche的LightCycler 2.0 instrument system来进行PCR反应。反应方法和条件参照陈娜等[20-21]的方法。采用Actin11为内参基因,3次重复,实验数据使用2-△△Cp方法分析[22]。 荧光定量采用如下引物: AhFATB2-F: 5'- TTCTCCATTCGATCTTACG-3';AhFATB2-R: 5'-TATCAGGTTCTTCTTACACAT-3';qACT11-F: 5'-TTGGAATGGGTCAGAAGGATGC-3';qACT11-R: 5'-AGTGGTGCCTCAGTAAGAAGC-3'。
2 结果与分析
2.1 AhFATB2基因的克隆
图1所示,扩增得到的AhFATB2基因全长1245 bp,编码414个氨基酸,琼脂糖凝胶电泳检测发现扩增得到的条带与目的基因大小相符。
2.2 AhFATB2蛋白理化性质及结构分析
理化性质结果显示:AhFATB2蛋白的理论分子量是45.5 kDa;理论等电点为7.74。带负电的氨基酸有48个(Asp + Glu),带正电的氨基酸有49个(Arg + Lys);在酵母和大肠杆菌中体内表达的半衰期分别大于20 h和10 h。不稳定系数是42.09,属于不稳定蛋白。
用Proscale工具对AhFATB2进行亲疏水性预测,正值越大表示越疏水,负值越大表示越亲水,介于+0.5到-0.5之间为两性氨基酸。图2所示,多肽链第394位的Glu(E)亲水性最强(-2.722),

图1 AhFATB2基因的核苷酸及氨基酸序列 Fig.1 Nucleotide sequence and deduced amino acid sequence of AhFATB2
第96位的Ile(I)和97位的Thr(T)疏水性最强(2.100),AhFATB2蛋白的亲水性区域较大,故AhFATB2属于亲水性蛋白。该蛋白由20种氨基酸组成,其中Gly (G)、Ser (S)最多,都有36个(9.0%),Cys(C)最少,只有3个(0.7%)。应用在线网站ExPASy上的SCRATCH Protein Predictor Tool和PredictProtein对AhFATB2蛋白进行二级结构预测。结果显示,AhFATB2蛋白由15.7%的α螺旋、32.3%的β-折叠和52%的不规则卷曲组成。
跨膜预测结果显示AhFATB2蛋白含有至少一个跨膜结构域(图3),可能为一个与膜结合的蛋白。亚细胞定位预测表明AhFATB2蛋白可能主要定位于叶绿体上。
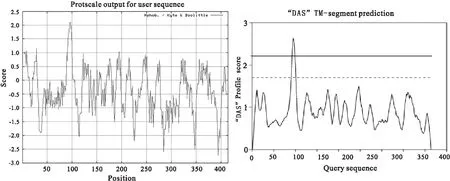
图2 AhFATB2蛋白亲疏水性分析Fig.2 Hydrophilic and hydrophobic characteristics analysis of AhFATB2图3 AhFATB2蛋白跨膜结构域预测Fig.3 Transmembrane domain prediction of AhFATB
注:破折线表示宽松阈值,实线表示严谨阈值。Note: Dash line for loose cut off and solid line for strict cut off.
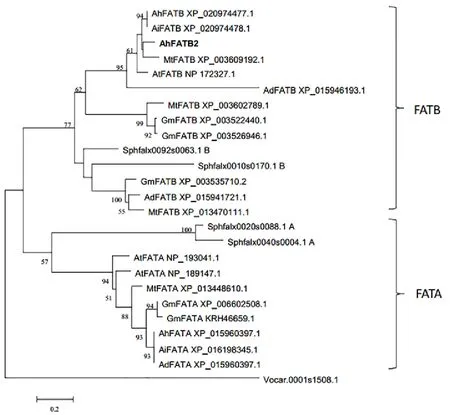
图5 AhFATB2与其他物种FAT蛋白的系统发育分析 Fig.5 Phylogenetic analysis of FATs in various species
2.3 AhFATB2蛋白同源性分析
通过多序列比对分析(图4),AhFATB2氨基酸序列与GmFAT、AhFATB、MtFATB氨基酸序列相似性较高,分别为78%、77%和77%;与ZmFATB、CnFATB的氨基酸序列相似性相对较低,分别为57%、61%。因此,AhFATB2编码蛋白与其他植物FATB蛋白序列具有较高的同源性,说明他们很可能来自于共同的祖先。

图4 花生与其他植物FATB蛋白的氨基酸序列比对 Fig.4 Comparison of FATB amino acid sequences among peanut and other species 注:acyl-ACP_thioesterase保守结构域用方框标出,催化位点用星号标出。
Note: The conserved acyl-ACP_thioesterase domain is boxed. The three critical catalytic residues (Asn, His and Cys) are labeled with a asterisk.(GenBank accession number:AhFATB, ADB79569.1;AtFATB, OAP14769.1;MtFATB, XP_003609192.1;GmFATB, NP_001237802.2;ClFATB, CAC19934.1;HaFATB, AAB88824.1;CoFATB, ACQ57189.1;ZmFATB, AIL28767.1;CnFATB, AEM72520.1;SmFATB, AIU99497.1;TcFATB, EOY30897.1;BnFATB, NP_001302816.1)
2.4 AhFATB2蛋白系统发育分析
将花生、拟南芥、大豆、蒺藜苜蓿、小立碗藓、团藻、野生种花生等植物中的FATs氨基酸序列进行比对,绘制系统发育树(图5)。AhFATB2(粗体标出)与花生、拟南芥、蒺藜苜蓿及野生种花生(Arachisduranensis,Arachisipaensis)的FATB聚在一起,说明它们的亲缘关系较近。从系统发育树可以看出,FAT的进化基本符合植物进化分类,不同植物的FATA和FATB两类蛋白分别聚在一起,藻类FAT位于系统发育树的根部,可能是FAT进化的祖先。
2.5 AhFATB2基因的表达特性分析
如图6所示,在花生不同组织中,AhFATB2基因在花和叶中的表达量较高,其中在花中的表达量最高,为其他组织表达量的4~5倍(图6A);在种子发育过程中,AhFATB2基因的表达量随时间呈现先降低后显著升高的趋势,在12~24 d中略有降低,24~60 d逐渐升高,60 d表达量达到最高(图6B)。
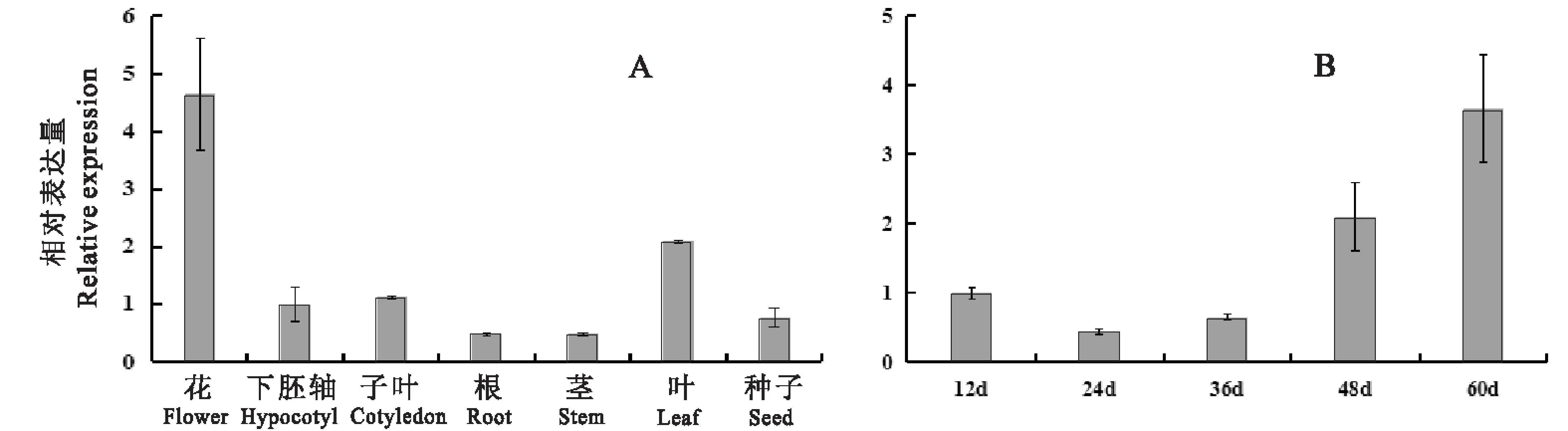
图6 AhFATB2基因在花生不同组织和种子不同发育时期的表达分析 Fig.6 Expression analysis of AhFATB2 in seven peanut tissues and at five stages of seed development
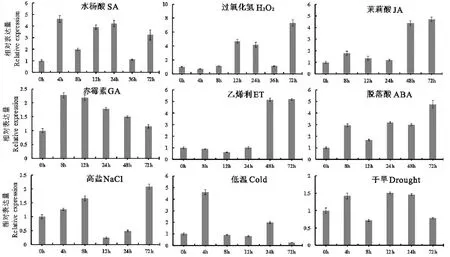
图7 AhFATB2基因在不同非生物胁迫及激素处理下的表达分析 Fig.7 Expression analysis of AhFATB2 under abiotic stresses and hormone treatment
如图7所示,不同逆境条件、不同时间处理后,AhFATB2基因表达量有明显差异。水杨酸处理后4h表达量上调4.6倍,之后基本保持在较高水平;过氧化氢处理后,0~8h无明显变化,8h后表达量逐步上调,72h表达量达最高,为0h对照的7.3倍;茉莉酸处理0~24h内无明显变化,48h时表达量显著上调,为0h对照的4.4倍,48~72h基本不变,稳定在较高水平;赤霉素处理后,表达量随即上调,8h时达到最高,为0h对照的2.3倍,随后表达量下降;乙烯利处理后,0~24h内无明显变化,48h时大幅上调,为0h对照的5.2倍,48~72h基本不变保持在较高水平;脱落酸处理后,表达量呈逐步上升趋势,72h达到最高,为0h对照的4.8倍;高盐处理后,0~8h表达量逐渐上调,12~24h显著下调,表达量为0h对照的1/3,72h表达量又显著上调,为0h对照的2倍;低温条件下,4h时表达量显著上调,为0h对照的4.6倍,而后显著下降;干旱条件下,0~72h内表达量没有显著变化。
3 讨论与结论
本研究从花生中克隆的AhFATB2基因编码414个氨基酸,多序列比对和进化树分析表明,AhFATB2与拟南芥、蒺藜苜蓿中的FATB亲缘关系最近,具有相同的酰基载体蛋白硫酯酶保守结构域和催化位点,说明它们在功能上也具有一定的保守性。AhFATB2基因在花中的表达量最高,其次是叶,在其他组织中表达水平较低,具有明显的组织特异性。不同种子发育时期的表达分析表明,AhFATB2基因的表达量逐渐升高,在60d达到最高,说明AhFATB2在种子发育的后期表达水平较高,可能与这一时期脂肪酸的大量产生有关[23]。
非生物胁迫如低温、高盐等严重影响花生的生长和产量[24]。本研究中,AhFATB2基因对多种非生物胁迫和激素处理均有响应,表达量有不同程度的上调,说明AhFATB2基因在花生抵御逆境胁迫过程中发挥一定的作用,这与前人研究结果一致[25],说明FATB基因可能参与了花生在低温和高盐逆境胁迫条件下的抗性调节。
[1] 王晓娟. 花生2016年市场形势及2017年展望[J]. 农产品市场周刊, 2017(4):33-34.
[2] 郝莉花, 陈复生, 刘昆仑,等. 不同品种花生油脂体粒径电位和蛋白质组成的分析[J]. 农业工程学报, 2016, 32(18):279-284.
[3] Wang M L, Chen C Y, Tonnis B, et al. Oil, fatty acid, flavonoid, and resveratrol content variability andFAD2Afunctional SNP genotypes in the U.S. peanut mini-core collection [J]. Journal of Agricultural & Food Chemistry, 2013, 61(11):2875-2882.
[4] Mayer K M, Shanklin A J. Identification of amino acid residues involved in substrate specificity of plant acyl-ACP thioesterases using a bioinformatics-guided approach [J]. BMC Plant Biology, 2007, 7(1). DOI: 10.1186/1471-2229-7-1.
[5] Dani K G S, Hatti K S, Ravikumar P, et al. Structural and functional analyses of a saturated acyl ACP thioesterase, type B from immature seed tissue ofJatrophacurcas[J]. Plant Biology, 2011, 13(3):453-461.
[6] Salas J J, Ohlrogge J B. Characterization of substrate specificity of plant FatA and FatB acyl-ACP thioesterases [J]. Archives of Biochemistry & Biophysics, 2002, 403(1):25-34.
[7] Rodríguezrodríguez M F, Salas J J, Garcés R, et al. Acyl-ACP thioesterases fromCamelinasativa: cloning, enzymatic characterization and implication in seed oil fatty acid composition [J]. Phytochemistry, 2014, 107(10):7-15.
[8] Morenopérez A J, Sánchezgarcía A, Salas J J, et al. Acyl-ACP thioesterases from macadamia (Macadamiatetraphylla) nuts: cloning, characterization and their impact on oil composition [J]. Plant Physiology & Biochemistry Ppb, 2011, 49(1):82-87.
[9] Jing F Y. Characterization of acyl-ACP thioesterases for the purpose of diversifying fatty acid synthesis pathway [J]. Teaching & Teacher Education, 2013, 35(24):1-12.
[10] Pollard M R, Anderson L, Fan C, et al. A specific acyl-ACP thioesterase implicated in medium-chain fatty acid production in immature cotyledons ofUmbellulariacalifornica[J]. Archives of Biochemistry & Biophysics, 1991, 284(2):306-312.
[11] Tan K W, Lee Y K. Expression of the heterologousDunaliellatertiolectafatty acyl-ACP thioesterase leads to increased lipid production inChlamydomonasreinhardtii[J]. Journal of Biotechnology, 2017, 247(4):60-67.
[12] 李玲玲, 刘强, 郑艳宁, 等. 利用工程大肠杆菌生产不同类型的游离脂肪酸[J]. 食品工业科技, 2012, 33(23):158-162.
[13] Mekhedov S, de Ilárduya O M, Ohlrogge J. Toward a functional catalog of the plant genome. A survey of genes for lipid biosynthesis [J]. Plant Physiology, 2000, 122(2):389-402.
[14] Bonaventure G, Ohlrogge J B. Disruption of theFATBgene inArabidopsisdemonstratesan essential role of saturated fatty acids in plant growth [J]. Plant Cell, 2003, 15(4):1020-1033.
[15] Raffaele S, Vailleau F, Léger A, et al. A MYB transcription factor regulates very-long-chain fatty acid biosynthesis for activation of the hypersensitive cell death response inArabidopsis[J]. Plant Cell, 2008, 20(3):752-767.
[16] 冯鹏, 孙力, 申晓慧, 等. 转CpFATB基因苜蓿后代抗寒性分析[J]. 中国农学通报, 2017, 33(9):31-36.
[17] Zhang X, Mai L, Agrawal A, et al. Efficient free fatty acid production inEscherichiacoliusing plant acyl-ACP thioesterases [J]. Metabolic Engineering, 2011, 13(6):713-722.
[18] Sanchez-Garcia A M P A J, Muro-Pastor A M, Salas J J, et al. Acyl-ACP thioesterases from castor (RicinuscommunisL.): An enzymatic system appropriate for high rates of oil synthesis and accumulation [J]. Phytochemistry, 2010, 71(9):860-869.
[19] Jing F, Cantu D C, Jarmila T, et al. Phylogenetic and experimental characterization of an acyl-ACP thioesterase family reveals significant diversity in enzymatic specificity and activity [J]. Bmc Biochemistry, 2011, 12(1):44-60.
[20] 陈娜, 胡东青, 潘丽娟, 等. 花生中UDP-葡萄糖基转移酶基因的克隆及在非生物胁迫下的表达研究 [J]. 中国油料作物学报, 2014, 36(3): 308-315.
[21] 陈娜, 潘丽娟, 迟晓元, 等. 花生果糖-1,6-二磷酸醛缩酶基因AhFBA1的克隆与表达 [J]. 作物学报, 2014, 40(5): 934-941.
[22] Mekhedov K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method.[J]. Methods, 2012, 25(4):402-408.
[23] 陈高. 多不饱和脂肪酸生物合成途径相关酶基因的克隆及在集胞藻PCC6803中的表达研究[D]. 济南:山东师范大学, 2012.
[24] Wan L, Wu Y, Huang J, et al. Identification of ERF genes in peanuts and functional analysis ofAhERF008 andAhERF019 in abiotic stress response [J]. Functional & Integrative Genomics, 2014, 14(3):467-477.
[25] Zhang L H, Jia B, Zhuo R Y, et al. An acyl-acyl carrier protein thioesterase gene isolated from Wintersweet (Chimonanthuspraecox), CpFATB, enhances drought tolerance in transgenic tobacco (Nicotianatobaccum) [J]. Plant Molecular Biology Reporter, 2012, 30(2):433-442.
