一个与花生含油量相关的InDel标记的开发
2017-03-20石延茂王效华李双铃
徐 平,尹 亮,石延茂,任 艳,王效华,李双铃,袁 美
(山东省花生研究所/农业部花生生物学重点实验室,山东 青岛 266100)
花生是我国重要的油料作物、经济作物和出口创汇作物。我国花生总产量的55%用于榨油,占我国国产植物油总量的26%左右[1]。当前我国花生品种的含油量为45%~55%,平均含油量50.57%[2-3]。据测算,花生榨油原料中含油量每提高1个百分点相当于产量提高2个百分点,加工企业的效益则可提高7个百分点以上。因此,提高花生含油量,对增加油脂加工企业的经济效益,保障国家油脂安全具有重要意义[4]。传统的花生育种时间长、效率低,随着生物技术的发展,近年来可大大缩短育种年限的分子标记辅助选择育种方法已受到越来越多育种者的青睐。栽培花生种(ArachishypogaeaL.,AABB,2n=4×=40)为异源四倍体,可能由二倍体野生种杂交演化而来,基因组高度保守[5-6]。然而,由于单一杂交及多倍化,花生育种过程中高频使用少数骨干亲本,使得生产上应用的花生品种间遗传背景狭窄,遗传多样性降低,导致在花生栽培品种间开发有效稳定的分子标记难度增大。所以在花生栽培品种之间开发稳定的、含油量相关的分子标记对于高油花生的育种和种质资源的鉴定具有重要意义。
花生含油量是较为复杂的数量性状,受环境影响大。大多数学者认为花生含油量性状同时受到加性和非加性效应的控制[7]。随着分子生物学技术的发展,近年来花生含油量性状的分子标记研究取得了一定的进展,开发了一系列与花生含油量相关的SSR标记。Sarvamangala等利用SSR标记技术对花生的含油量进行了QTL定位,开发了与花生含油量相关基因紧密连锁的分子标记[8-10]。InDel(Insertion-Deletion)标记是指在近缘种或同一物种不同个体之间基因组同一位点的序列发生不同大小核苷酸片段的插入或缺失[11]。相较于SSR标记,InDel标记有更丰富的多态性,更高的特异性以及检测方便快捷的特点[12],并已经在水稻、玉米、结球甘蓝、黄瓜、番茄、辣椒等物种中开始应用[15-20]。在花生上,已有与抗病性和荚果性状相关的InDel标记的报道。Liu等[21]率先利用EST数据开发了48个花生的InDel标记,其中16个标记在118份材料中表现多态性,5个与晚斑病和番茄斑萎病毒病显著关联;Meng等[22]利用这48个InDel标记评估了54个花生品种的遗传多样性与5个荚果性状的相关性。但是,目前尚未见与含油量相关的InDel标记的报道。本试验在对49个花生栽培品种的转录组进行分析获得了61 942个InDel位点的基础上,通过关联分析发现29个InDel位点与花生含油量相关。基于这些位点,通过设计引物及比较测序,以及在171个花生品种组成的自然群体中的扩增验证,旨在开发用于分子标记辅助高含油量育种与种质评价的InDel标记。
1 材料与方法
1.1 试验材料
171个花生栽培品种,2016年均种植于山东省花生研究所试验基地(青岛莱西)。
1.2 试验方法
1.2.1 DNA提取
在花生苗期取健康植株上的无病虫害幼嫩叶片100 mg,保存于-80℃冰箱。基因组DNA提取使用植物基因组DNA提取试剂盒(DP305-2,北京天根生化科技有限公司),具体操作步骤参照试剂盒说明。
1.2.2 InDel引物的设计和合成
利用下载的花生二倍体野生种序列(https://www.peanutbase.org/download)和29个花生含油量相关的InDel位点信息,提取InDel位点两端各500 bp序列,使用primer3软件设计了29对引物,由北京华大基因有限公司(青岛)合成(表1)。
1.2.3 PCR反应及DNA片段分析
PCR扩增反应体系: 2μL 50 ng/μL DNA,0.4μL dNTPs,2μL PCR buffer 溶液,1.6μL MgCl2溶液,0.2μL Taq酶,11.8μL ddH2O和2μL InDel引物,总体积为20μL。PCR反应参数:94℃变性4 min;94℃变性30 s,55℃复性30 s,72℃延伸45 s,循环35次;25℃保存。PCR产物使用QIAxcel DNA High Resolution Kit(1200)(No.929002,QIAGEN INC)在QIAxcel Advanced system,全自动核酸分析系统(凯杰企业管理(上海)有限公司)上进行分析。
1.2.4 PCR产物目的片段的回收、T载体连接及测序
分别对花生栽培品种Peanut 16、Peanut 20和Peanut 21进行多态性引物的PCR扩增。目的片段的回收、纯化使用琼脂糖凝胶回收试剂盒(北京天根生化科技有限公司),具体操作步骤参照回收试剂盒说明。将回收的目的片段与pMD18-T载体(宝生物工程(大连)有限公司)连接后,使用热激法转化大肠杆菌Trans5α感受态细胞(北京天根生化科技有限公司),热激后加入200μL 无抗LB液体培养基,37℃震荡1 h,取培养的菌液 200μL 平铺于LB 固体培养基(含有氨苄青霉素)上,将培养皿倒置放于37℃恒温箱培养 16~20 h。每个差异片段挑选12个单克隆菌落,每个单克隆菌落在300μL LB液体培养基(含氨苄青霉素)中培养4 h(37℃恒温摇床中培养,转速300 r/min)。根据插入片段的大小,使用 M13引物(M13-47F:5'-CGCCAGGGTTTTCCCAGTCACGAC-3';M13-48R:5'-CACAGGAAACAGCTATGACCAT-3')进行阳性克隆的筛选。其反应体系为:2μL菌液,0.4μL dNTPs,2μL PCR buffer溶液,1.6 μL MgCl2,0.2 μL Taq酶,11.8 μL ddH2O和2 μL M13-47F/M13-48R通用引物,总体积 20 μL。PCR循环参数为:94℃变性 4 min;94℃变性 30 s,55℃复性30 s,72℃延伸45 s,循环30次;25℃保存。扩增产物使用1%琼脂糖凝胶(含核酸染料1×Super GelRed(10 000×),US Everbright INC生产)电泳,在凝胶成像仪中检测其扩增片段大小与原来差异片段大小相当即说明该单克隆为阳性,将每个差异片段的3个单克隆送华大基因有限公司(青岛)测序。使用Lasergene软件进行去载体序列和序列比对。

表1 InDel引物序列及其在染色体上的信息
1.2.5 粗脂肪含量测定及分子标记分析
171个花生栽培品种的粗脂肪含量测定按GB/T 14488.1-1993分析。7个含油量存在差异的品种用于引物多态性的初步筛选,171个丰富变异的花生品种用于多态性引物的进一步PCR扩增以及片段多态性分析。利用DPS 9.05软件[23]计算花生栽培品种的含油量和分子标记的二列相关系数,进而使用绘图软件Origin8 绘制不同标记类型对应含油量变异箱型图。
2 结果与分析
2.1 多态性InDel分子标记的开发
随机选取7个花生品种(Peanut 90、Peanut 91、Peanut 92、Peanut 93、Peanut 94、Peanut 95、Peanut 97)进行29对引物的多态性分析,结果显示在本研究设计的29对引物中,仅有1对引物(ID14-3)在不同品种中表现出多态性(图1)。引物ID14-3在7个品种中可扩增出2个片段大小不同的条带,分别记为a条带和b条带(分别命名为ID14-3a,ID14-3b),片段大小在250~300 bp之间。分别对a条带和b条带进行克隆测序,a条带大小为278 bp,b条带大小为272 bp。对这两条序列进行BLAST分析,结果表明b条带相较于a条带有多个位点的变异,从而造成了b条带比a条带小6 bp (图2)。
2.2 InDel分子标记与含油量的相关性分析
表2表明,171个花生品种平均含油量47.52%,Peanut 20含油量最高,达54.20%,Peanut 125含油量最低,为42.20%。利用ID14-3引物扩增检测了171份品种结果显示,63个花生品种可扩增检测到ID14-3a标记,108个花生品种可扩增检测到ID14-3b标记。含ID14-3a标记的63个花生品种平均含油量46.26%,含ID14-3b标记的108个花生栽培品种平均含油量48.33%(图3)。将ID14-3a标记赋值为1,ID14-3b标记赋值为2,利用DPS 9.05计算的二列相关系数ρ=0.51431(p=0.00000),相关性极显著,因此推测ID14-3b标记与花生栽培品种的高含油量相关。

图1 分子标记ID14-3在7个花生栽培种中的多态性分析Fig.1 Amplification pattern of ID14-3 primer among 7 peanut varieties

图2 不同花生品种ID14-3引物扩增序列的比对分析Fig.2 Alignment of sequences amplified by ID14-3 primer among different varieties 注: 框中标出的是序列插入/缺失位置。 Note: Rectangle show the position of Insertion/deletion. 表2 花生品种的含油量及其ID14-3标记的带型 Table 2 Oil content of peanut varieties and their pattern amplified by ID14-3 primer

品种编号SerialNo.含油量(%)Oilcontent带型Band品种编号SerialNo.含油量(%)Oilcontent带型Band品种编号SerialNo.含油量(%)Oilcontent带型BandPeanut151.85bPeanut5849.53bPeanut11544.81aPeanut244.16aPeanut5948.26bPeanut11649.62bPeanut350.61bPeanut6045.58bPeanut11746.83bPeanut447.72bPeanut6146.51aPeanut11848.09aPeanut549.34aPeanut6246.20bPeanut11945.46bPeanut647.82aPeanut6344.90aPeanut12047.13bPeanut745.48aPeanut6447.27bPeanut12145.54bPeanut848.67bPeanut6547.68aPeanut12243.92aPeanut948.27bPeanut6651.48bPeanut12347.23bPeanut1042.65bPeanut6746.08bPeanut12452.32bPeanut1148.94bPeanut6842.46aPeanut12542.20aPeanut1242.77bPeanut6946.65bPeanut12643.09aPeanut1348.28bPeanut7042.42aPeanut12745.25aPeanut1449.67bPeanut7146.68bPeanut12846.12bPeanut1547.51bPeanut7244.50aPeanut12947.85bPeanut1649.66bPeanut7349.91bPeanut13047.92bPeanut1745.37bPeanut7448.26aPeanut13145.61bPeanut1851.81bPeanut7544.80aPeanut13250.38bPeanut1949.56aPeanut7645.72aPeanut13345.95bPeanut2054.20aPeanut7743.57aPeanut13444.19bPeanut2151.46bPeanut7850.22bPeanut13545.53bPeanut2250.20bPeanut7953.54bPeanut13647.46bPeanut2346.85aPeanut8050.70bPeanut13745.56bPeanut2445.26bPeanut8145.23bPeanut13848.35bPeanut2544.04bPeanut8247.94aPeanut13946.34aPeanut2647.61bPeanut8345.02bPeanut14046.47aPeanut2752.03bPeanut8449.08bPeanut14143.03aPeanut2848.79bPeanut8546.28aPeanut14246.45aPeanut2952.59bPeanut8647.25aPeanut14350.97bPeanut3050.68bPeanut8752.01bPeanut14448.61bPeanut3146.15bPeanut8852.49bPeanut14546.63aPeanut3248.50aPeanut8949.32bPeanut14648.66bPeanut3343.44bPeanut9050.94aPeanut14749.78bPeanut3447.03bPeanut9146.66bPeanut14845.99aPeanut3550.97bPeanut9246.72aPeanut14947.95bPeanut3648.94bPeanut9349.04bPeanut15045.84bPeanut3748.44aPeanut9449.36aPeanut15148.22bPeanut3846.77bPeanut9551.51bPeanut15247.24aPeanut3948.04bPeanut9648.22aPeanut15344.24aPeanut4047.80aPeanut9746.96bPeanut15446.88bPeanut4143.88aPeanut9850.28bPeanut15547.74aPeanut4247.73aPeanut9949.93bPeanut15648.70aPeanut4351.12bPeanut10047.29bPeanut15745.28aPeanut4449.56bPeanut10148.49aPeanut15847.39bPeanut4549.15bPeanut10247.34bPeanut15950.19bPeanut4647.32bPeanut10348.77bPeanut16047.67bPeanut4744.34aPeanut10449.01bPeanut16150.36bPeanut4850.25bPeanut10545.36aPeanut16247.28aPeanut4944.19aPeanut10647.87aPeanut16347.96bPeanut5043.40aPeanut10747.05bPeanut16444.46aPeanut5149.53bPeanut10846.96aPeanut16547.00bPeanut5247.64aPeanut10946.40bPeanut16644.86aPeanut5342.56aPeanut11049.50bPeanut16746.32aPeanut5446.81bPeanut11152.28bPeanut16849.08bPeanut5548.89aPeanut11248.20bPeanut16947.48bPeanut5643.05aPeanut11348.02bPeanut17050.28bPeanut5750.89bPeanut11444.29aPeanut17147.32a
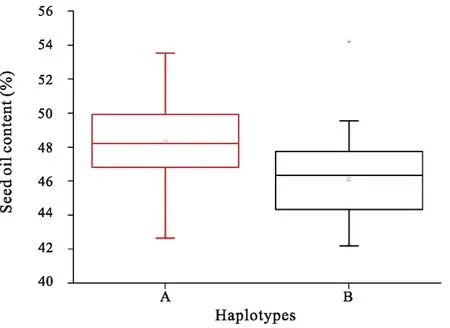
图3 InDel标记ID14-3b(A)和ID14-3a(B)对应花生品种的含油量差异箱型图Fig. 3 Box plot for oil content of peanut varieties with InDel marker ID14-3b (A) and ID14-3a (B)
3 讨 论
花生栽培品种之间基因组序列高度保守使得用于分子标记辅助育种的标记开发难度大大增加。本课题组前期利用转录组测序的海量数据获得的61942个InDel位点,以及2年2点共4个环境测定的含油量数据,经关联分析获得29个InDel位点与含油量显著相关(Wang等,待发表)。其中ID14-3位点在171个品种组成的自然群体中的分析显示,含ID14-3b标记的品种平均含油量比含ID14-3a标记的平均含油量高2个百分点,相关性分析显示标记与含油量极显著,因此推测ID14-3是与控制花生含油量相关的基因位点。
根据与花生含油量相关的29个InDel位点均设计了引物,对7个栽培品种进行筛选,最终仅有1个引物的扩增表现稳定的多态性,这可能与初筛的7个品种的基因型有关。此外,本研究所用的171个花生栽培品种不包含转录组分析用的49个栽培品种(Wang等,待发表),但是依然可以检测到ID14-3所在位点的多态性,表明该引物具有通用性,可用于花生含油量的分子标记辅助育种、遗传多样性和遗传图谱的构建等研究。
引物ID14-3是根据花生野生种B04染色体上127 849 985 bp位置的InDel位点设计而来。Wang等[24]对花生脂肪酸进行QTL定位,确定花生的B04染色体上存在2个与花生脂肪酸含量相关的QTL簇,其中一个QTL簇中的分子标记IPAHM108-2恰好位于ID14-3所在的InDel位点附近,进一步证明本研究开发的ID14-3a和ID14-3b标记与花生含油量相关,可为今后花生含油量的分子标记辅助育种和精细定位等提供标记基础。
[1] 禹山林,杨庆利,潘丽娟,等. 花生种子含油量的遗传分析[J]. 植物遗传资源学报,2009,10(3): 453-456.
[2] 袁美,李双铃,任艳,等. 正交设计法研究花生粗脂肪含量测定方法[J]. 花生学报,2007,36(4):33-35.
[3] 姜慧芳,段乃雄. 花生品种蛋白质含量、含油量及脂肪酸组成的分析[J]. 花生科技,1996(1):29-31,33.
[4] 姜慧芳,任小平,王圣玉,等. 野生花生高油基因资源的发掘与鉴定[J]. 中国油料作物学报,2010(1):30-34.
[5] Kochert G, Stalker H T, Gimenes M, et al. RFLP and cytogenetic evidence on the origin and evolution of allotetraploid domesticated peanut,Arachishypogaea(Leguminosae) [J]. American Journal of Botany, 1996, 83: 1282-1291.
[6] Kochert G, Halward T, Branch W D, et al. RFLP variability in peanut cultivars and wild species [J]. Theoretical and Applied Genetics, 1991, 81: 565-570.
[7] 江建华,肖美华,王晓帅,等. 花生含油量研究进展[J]. 中国农学通报,2012,28(33):1-6.
[8] Sarvamangala C, Gowda M V C, Varshney R K. Identification of quantitative trait loci for protein content, oil content and oil quality for groundnut (ArachishypogaeaL.)[J]. Field Crops Research, 2011, 122(1):49-59.
[9] 黄莉,赵新燕,张文华,等. 利用RIL群体和自然群体检测与花生含油量相关的SSR标记[J]. 作物学报,2011,37(11):1967-1974.
[10] 郭建斌. 花生含油量及脂肪酸组成的QTL分析[D]. 武汉:华中农业大学,2016.
[11] Weber J L, David D, Heil J, et al. Human diallelic insertion/deletion polymorphisms [J]. American Journal of Human Genetics, 2002, 71:854-862.
[12] 杨洁,赫佳,王丹碧,等. InDel标记的研究和应用进展[J]. 生物多样性,2016(2):237-243.
[13] 王林友,张礼霞,勾晓霞,等. 利用InDel标记鉴定水稻育种材料的籼粳属性[J]. 核农学报,2013,27(7):913-921.
[14] 桂君梅,王林友,范小娟,等. 基于InDel分子标记的籼粳杂交稻与粳粳杂交稻的杂种优势比较研究[J]. 中国农业科学,2016,49(2):219-231.
[15] 张体付,葛敏,韦玉才,等. 玉米功能性Insertion/Deletion(InDel)分子标记的挖掘及其在杂交种纯度鉴定中的应用[J]. 玉米科学,2012,20(2):64-68.
[16] 朱东旭,王彦华,赵建军,等. 结球甘蓝相对于大白菜连锁群特异InDel标记的建立及应用[J]. 园艺学报,2014,41 (8): 1699-1706.
[17] 张圣平,苗晗,程周超,等. 黄瓜果实苦味(Bt)基因的插入缺失(InDel)标记[J]. 农业生物技术学报,2011,19(4):649-653.
[18] 张录霞,甘中祥,李倍金,等. 利用InDel标记鉴定加工番茄杂交种纯度[J]. 分子植物育种,2016,14(6):1533-1537.
[19] 郭广君,孙茜,刘金兵,等. 基于辣椒基因组重测序的InDel标记开发及应用[J]. 江苏农业学报,2015,31(6) :1400-1406.
[20] 姜童,王辉,杨延杰,等. 干制辣椒雄性不育系与保持系间多态性InDel标记的筛选[J]. 北方园艺,2017(15):24-28.
[21] Liu L, Dang P M, Chen C Y. Development and utilization of InDel markers to identify peanut (Arachishypogaea) disease resistance [J]. Frontiers in Plant Science, 2015, 6. DOI: 10.3389/fpls.2015.00988.
[22] Meng S, Yang X L, Dang P M, et al. Evaluation of insertion-deletion markers suitable for genetic diversity studies and marker-trait correlation analyses in cultivated peanut (ArachishypogaeaL.) [J]. Genetics and Molecular Research, 2016,15(3). DOI: 10.4238/gmr.15038207.
[23] 唐启义. DPS数据处理系统[M]. 北京:科学出版社,2013.
[24] Wang M L, Khera P, Pandey M K, et al. Genetic mapping of QTLs controlling fatty acids provided insights into the genetic control of fatty acid synthesis pathway in peanut (ArachishypogaeaL.) [J]. PLos One 2015, 10(4). DOI: 10.1371/journal.pone.0119454.
