不同滴度轮状病毒对新生小鼠肝胆系统损伤的比较
2017-03-20林泽锋曾信豪张红付铭张锐忠夏慧敏
林泽锋 曾信豪 张红 付铭 张锐忠 夏慧敏
510120 广州医科大学附属广州市妇女儿童医疗中心小儿外科
·论著·
不同滴度轮状病毒对新生小鼠肝胆系统损伤的比较
林泽锋 曾信豪 张红 付铭 张锐忠 夏慧敏
510120 广州医科大学附属广州市妇女儿童医疗中心小儿外科
目的 比较不同滴度轮状病毒(Rhesus rotavirus,RRV)对新生小鼠肝胆系统损伤的差异。方法 新生小鼠出生24 h内,腹腔注射恒河猴轮状病毒(MMU18006病毒株)建立肝胆损伤动物模型;将80只BALB/c新生小鼠随机分成4组,每组20只,实验组分别注射不同滴度轮状病毒悬液,依次为高滴度(1×107PFU/ml)、中滴度(1×106PFU/ml)、低滴度实验组(2.5×105PFU/ml),正常对照组仅注射病毒培养液;观察小鼠体重、黄疸发生时间,于出生后第12天收取标本时,经小鼠胆囊行肝外胆道造影,镜下观察小鼠胆管情况,并收取血清和肝胆组织,分别进行肝功能检测和病理染色分析。结果 与正常小鼠相比,实验组小鼠均有不同程度的皮肤黄疸、体重增加缓慢、生存率下降、肝功能损伤。低滴度组表现较轻且皮肤黄疸、体重及肝功能可恢复正常;与低滴度组相比,高滴度组皮肤黄疸更明显,体重显著性降低且不可逆,生存率低(50%),肝功能指标TBIL、DBIL、TBA、ALT、ALP显著性升高。进一步胆道造影显示高滴度组闭锁率高(80%),低滴度组无闭锁。病理学分析显示高滴度组肝内胆管闭锁,汇管区大量炎症细胞浸润,而低滴度组肝内胆管形态正常,汇管区仅有少量炎症细胞浸润。结论 不同滴度轮状病毒对新生小鼠肝胆系统影响不同:高滴度易引起胆道闭锁,低滴度引起肝炎。
Fund programs: State Clinical Key Specialty Construction Project(Pediatric Surgery)(GJLCZD1301); Guangdong Provincial Science and Technology Plan Projects(2014A020212373)
胆道闭锁(Biliary atresia,BA)是发生于婴幼儿的进行性炎症性胆管病,是引起婴幼儿阻塞性黄疸常见疾病,最终导致肝外、肝内胆管的梗阻及肝硬化,预后差,病死率高[1]。在病程初期与新生儿肝炎临床表现相似、难以鉴别,但二者预后相差甚远,新生儿肝炎可完全恢复。相关研究提示二者皆与围生期病毒感染密切相关[2, 3],但由于致病因素的强弱不同以及遗传易感性等因素,其病程的转归与预后相差甚远。
Petersen等[4]使用恒河猴轮状病毒(Rhesus rotavirus,RRV)对出生24 h内的新生小鼠进行腹腔注射,成功建立了临床上胆道闭锁疾病研究的重要动物模型。该方法中使用的病毒滴度较高(常规病毒滴度1×106PFU/ml,20 μl/只),所以导致肝内肝外胆道出现持续的损伤,从而不能重建新的胆道系统,最终形成胆道闭锁,导致小鼠死亡。而低滴度的病毒液引起肝胆损伤的症状较轻,仅表现出一过性的肝炎症状,即模拟新生儿肝炎的病理变化。故采用不同滴度的轮状病毒悬液来建立肝胆系统损伤动物模型,为研究胆道闭锁和新生儿肝炎提供理想的研究手段。而目前国内的相关研究尚未见报道。
为验证此假说,本研究通过不同滴度的轮状病毒感染BALB/c新生小鼠建立肝胆损伤动物模型,对小鼠的生长情况及肝内外胆管进行观察,并进行病理学分析,为胆道闭锁与新生儿肝炎的病因学差异提供动物学证据。
1 材料与方法
1.1 材料
1.1.1 病毒和细胞:恒河猴轮状病毒(MMU18006病毒株),购置于美国菌种保藏中心(ATCC VR-1739TM)。猴肾MA-104细胞,由香港疾病防控中心馈赠。细胞培养液,最低必须培养基(Mminimum essential medium,MEM)。10%胎牛血清Eagle-MEM培养基作为细胞培养液。无胎牛血清Eagle-MEM培养基作为细胞维持液。
1.1.2 动物:BALB/c孕鼠、8周龄、无特定病原体级(SPF级),购自南方医科大学动物实验中心,饲养在中山大学动物实验中心超净生物层流架内。
1.1.3 主要设备:尼康光学解剖显微镜(Nikon SMZ-1000,日本)。
1.2 方法
1.2.1 病毒扩增和滴定: MA-104细胞培养于10%胎牛血清的Eagle-MEM培养基中,细胞生长成单层后用Hanks液洗涤3次,感染经10U/ml胰蛋白酶37℃预处理30 min的恒河猴轮状病毒,37℃吸附60 min,弃掉上清液,加含1U/ml胰蛋白酶的无胎牛血清的Eagle-MEM维持液,37℃ 5%CO2静止培养,待细胞出现明显病变后收获,将病毒悬液分装保存于-80℃冰箱备用;采用改良空斑形成法[5]测定病毒滴度,待病毒滴度达到107PFU时行动物实验。
1.2.2 建立新生小鼠肝胆损伤动物模型:将定时配种后的BALB/c孕鼠按单只每笼饲养在中山大学动物实验中心超净生物层流架内并进行隔离,将出生24 h内的80只BALB/c新生小鼠(1.6±0.15 g)按窝随机分成4组(高滴度实验组、中滴度实验组、低滴度实验组和正常对照组),每组20只,注射剂量为20 μl/每只。根据腹腔注射不同滴度轮状病毒悬液,将实验组依次分为高滴度实验组(1×107PFU)、中滴度实验组(1×106PFU)、低滴度实验组(2.5×105PFU);正常对照组仅注射病毒培养基(MEN液),剂量同实验组。每日记录小鼠体重,并观察无毛区皮肤颜色、大小便颜色。
1.2.3 标本取材:将存活至生后第12天的各组小鼠进行取材。收获时①拍照记录肝脏外观、胆囊外观、肝外胆道外观;②常规胆囊注射美兰进行肝外胆道造影:从胆囊底部注射美兰溶液,观察左右肝管和胆总管是否通畅,并拍照记录;③心脏采血进行肝功能分析;④部分肝脏及肝外胆道保存于10%福尔马林;⑤部分新鲜肝脏组织液氮保存。
1.2.4 病理学分析:用10%福尔马林固定新鲜小鼠肝组织,过夜后常规脱水、石蜡包埋、切片、H&E染色。采用SP染色法,进行小鼠肝组织CK19免疫组织化学染色,CK19(Rabbit-anti mouse)购自于Abcam公司。DAB显色试剂盒、anti-rabbit HRP二抗购自DAKO公司。通过显微镜下观察肝胆组织的病理改变。


注:各组小鼠体型与皮肤黄疸程度(A);各组体重变化曲线(B)和生存曲线(C);各组肝功能数据(D、E、F)图1 不同滴度轮状病毒对新生小鼠肝胆系统损伤的生存状况比较Note: Mice body size and degree of skin jaundice (Fig.1A); Weight change curve (Fig.1B) and survival curve (Fig.1C); Liver function level (Fig.1D、1E、1F)Fig.1 Comparison of living situation of hepatobiliary injury for newborn BALB/C mice which induced by different titers of rhesus rotavirus
2 结果
2.1 感染RRV后小鼠的生存状况 与正常对照组小鼠比较,实验组小鼠平均出生后第6天出现无毛区皮肤变黄,其中高滴度组黄疸严重,而低滴度组较轻(图1A)。小鼠体重变化曲线(图1B)显示:实验组生后第12天平均体重较正常对照组降低,高、中、低滴度实验组和正常对照组平均体重依次为(3.87±0.34)g、(3.69±0.69)g、(6.64±0.83)g、(7.93±0.95)g,正常对照组与高、中滴度组具有统计学差异(均为P<0.001),与低滴度组无统计学差异(P=0.061)。其中,高滴度组与低滴度组具有统计学差异(P<0.001)。与正常对照组比较,各实验组生后第6天体重增加缓慢,出现显著性差异;小鼠生后第9天时,与低滴度组平均体重(5.98±0.74)g比较,高滴度组平均体重(5.22±0.36)g显著性降低(P=0.046);小鼠生存曲线(图1C)显示:高滴度组生后第5天出现死亡,第12天存活率仅50%;低滴度组黄疸逐渐消退,体重缓慢增加,第12天存活率95%。从数据分析得出,病毒高滴度水平致小鼠皮肤黄疸更明显,体重显著性降低且不可逆,生存率低;病毒低滴度水平致小鼠皮肤黄疸轻、生存率高,体重和黄疸情况可恢复正常。
2.2 感染RRV后小鼠第12天的血清肝功能比较 肝功能数据显示,高、中、低滴度组的总胆红素(TBIL)、直接胆红素(DBIL)、总胆汁酸(TBA)、丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)水平(图1D、1F)与正常对照组相比,差异具有统计学意义(均为P<0.001)。其中,高、低滴度组肝功数据具有统计学差异(表1)。然而,实验组与正常组的肝脏蛋白质合成功能的数据无统计学意义(图1E)。从数据分析得出,RRV病毒滴度的高低与小鼠肝功能的损伤程度存在相关联系。
2.3 感染RRV后小鼠的肝脏表观及肝外胆管形态 解剖小鼠时可见与低滴度组(图2B)比较,高滴度组(图2D)的肝脏表面出现严重的片状坏死灶,而低滴度组的肝脏表面仅有少量的点状坏死灶;中滴度组(图2C)胆管呈纤维条索状闭锁,胆囊充盈,内用典型的白胆汁,肝脏有散在的点状坏死灶。经胆囊底部注射美兰,行肝外胆管造影显示:正常对照组(图2A)和低滴度实验组肝外胆管通畅、胆管形态正常,而高、中滴度实验组小鼠的肝外胆管则呈条索状,美兰造影显示不通畅,这说明肝外胆管发生了闭锁。
2.4 感染RRV后小鼠的肝内胆管发育情况 利用H&E和免疫组化染色观察肝内胆管发育情况。通过H&E染色观察,与正常对照组(图2E)比较,实验组的胆管上皮细胞周围出现不同程度的炎症细胞浸润(图2F、2G、2H)。通过CK19染色观察,与正常对照组(图2I)比较,实验组的肝内胆管正常结构消失,并伴有肝内小胆管代偿性增生,且增生的小胆管结构不完整,汇管区结构紊乱,少量纤维化(图2J、2K、2L)。与低滴度组相比,高滴度组肝组织的胆管畸形、炎症浸润更加明显。这提示了RRV是一种嗜胆病毒,对小鼠的胆管上皮造成持续性的炎症损伤。低滴度RRV对小鼠肝内胆管破坏轻,而高滴度RRV对小鼠肝内胆管破坏重,造成肝内小胆管代偿性增生,结构不完整、缺损、甚至闭锁。

表1 各组新生小鼠出生12天肝功能数据表±s)
注:与低滴度组相比,高滴度组差异有统计学意义:△表示P<0.05,*表示P<0.01
Note: Statistically significant difference of the high titer group when compared with the low titer group:△:P<0.05,*:P<0.01
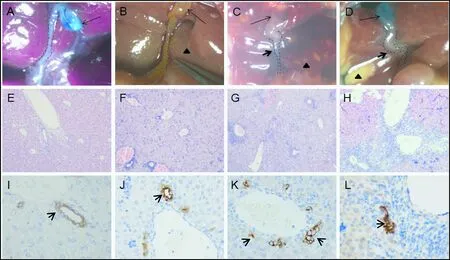
注:正常对照组(A、E、I)、低滴度组(B、F、J)、中滴度组(C、G、K)和高滴度组(D、H、L);胆囊(长箭头),胆道闭锁或狭窄部位(粗箭头),肝外胆管形态(虚线),肝脏表面炎症坏死灶(三角形);H&E染色(×100),肝内胆管CK19染色(短箭头,×400)图2 各组新生小鼠12天肝胆表观、炎症程度、胆管发育情况Note: The normal control group (A、E、I),low titer group (B、F、J),medium titer group (C、G、K) and high titer group (D、H、L). Gallbladder (long arrow),biliary atresia or stenosis (thick arrow),extrahepatic bile duct shape (dashed line),liver surface inflammatory necrosis (triangle). H&E staining(×100),intrahepatic bile duct CK19 staining (arrowhead,×400)Fig.2 The appearance of liver and extrahepatic bile duct, degree of inflammation, and the morphology of intrahepatic bile duct
3 讨论
胆道闭锁与新生儿肝炎二者在病程初期临床表现相似,但预后相差甚远,常需要作出明确的鉴别,二者可能经历同一疾病病理演变的过程,却在最初发病的时间和部位不同,导致疾病严重程度不同[6]。多数学者通过病理学的观察,认为胆道闭锁与新生儿肝炎的肝脏病理组织变化极为相似,只是一种炎症病变不同阶段的表现,且可同时存在[7]。新生儿肝炎是炎症过程的早期表现,而胆道闭锁是其终末阶段,经炎症持续性破坏,继而胆管出现瘢痕纤维化闭塞,胆管上皮细胞破坏,致使胆管发生闭锁,形成梗阻性胆汁淤积。为明确二者的关系,本研究在参考Petersen胆道闭锁模型的基础上,通过高、低滴度RRV诱导BALB/c新生小鼠肝胆损伤动物模型,能模拟出胆道闭锁、新生儿肝炎急性期的发病过程及基本病理变化。近年研究发现胆道闭锁有可能是在围生期(孕28周至出生后4周)时由嗜胆病毒(最可能为巨细胞病毒、轮状病毒或呼肠病毒)感染所激发,造成机体以胆管为中心的免疫功能紊乱,随之发生一系列病理改变,包括胆管周围炎症浸润、胆道上皮细胞凋亡、胆管堵塞闭锁和肝脏进行性纤维化等[8-10]。早期,有研究学者采用RT-PCR的分析方法比较胆道闭锁、新生儿肝炎患儿的肝胆组织轮状病毒RNA的基因表达量,二者具有统计学差异[11]。但由于致病因素的强弱不同以及遗传易感性等因素,其病程的转归及预后相差甚远。高滴度RRV诱导的胆道闭锁动物模型,因其存活率低,只能模拟出该疾病早期阶段的炎症过程,并不能形成终末阶段纤维化所致的肝硬化。因此,能否通过降低RRV的滴度来模拟新生儿肝炎的发生,并最终形成肝硬化。然而,新生小鼠的免疫系统能有效的清除RRV[12]。国内学者指出RRV感染后的BA动物模型有约25%小鼠在两周以后黄疸逐渐消退并恢复正常[13]。考虑到病毒引起的新生儿肝炎具有一定的自限性,预后较好[14-16],这与本研究观察到的现象符合。实际上,RRV感染新生小鼠后,胆管的纤维化和肝门部的炎症并不随病毒的清除而停止[13, 17],故解释了BA患儿可能早期存在病毒感染,但晚期被机体清除。新生儿的免疫系统虽能有效清除胎儿期或围生期感染的病毒,但残留的病毒蛋白能诱发胆道上皮细胞的自身免疫[18],介导炎症反应引起胆道上皮进行性的损伤,并阻碍胆管正常发育而导致纤维化闭锁。因此可通过高、低滴度RRV诱导的小鼠肝胆损伤模型,并结合胆道闭锁、新生儿肝炎的发病特点,进一步观察其中可能的机制及致病原因。
通过高、低滴度RRV诱导疾病模型来模拟出胆道闭锁与新生儿肝炎疾病发生、发展相似的过程,进而探讨二者的致病机制。本研究证实RRV病毒滴度的高低:①高滴度致小鼠皮肤黄疸更明显,体重显著性降低且不可逆,生存率低,而低滴度致小鼠皮肤黄疸轻、生存率高,体重和黄疸情况可恢复正常;②与小鼠肝功能损伤有直接的影响,高滴度易引起胆道闭锁,低滴度引起肝炎;③与小鼠肝外胆管狭窄、闭锁,肝内胆管破缺损、不完整和汇管区炎症程度有明显的影响。但在RRV侵袭胆管发育这一过程中,是如何通过激发或介导免疫炎症反应,导致胆道炎症乃至闭锁,均未得到进一步证实,并且低滴度RRV对新生小鼠肝胆系统的影响尚未见报道。通过本研究提示:RRV的病毒滴度高低直接影响了小鼠胆管发育及其炎症损伤的程度;高、低滴度RRV诱导的肝胆损伤动物模型与临床上的胆道闭锁、新生儿肝炎二者的发生、发展、预后具有相似的特征。
通过比较不同滴度RRV对新生小鼠肝胆系统损伤的差异,为胆道闭锁与新生儿肝炎的病因学差异提供动物学证据,为探索胆道闭锁、新生儿肝炎二者发病机制与临床治疗提供研究依据。
[1] Hartley JL, Davenport M, Kelly DA. Biliary atresia[J]. Lancet, 2009, 374(9702): 1704-1713. doi: 10.106/S0140-6736(09)60946-6.
[2] Xu Y, Yu J, Zhang R, et al. The perinatal infection of cytomegalovirus is an important etiology for biliary atresia in China[J]. Clin Pediatr (Phila), 2012, 51(2): 109-113. doi: 10.1177/0009922811406264.
[3] Mack CL, Sokol RJ. Unraveling the pathogenesis and etiology of biliary atresia[J]. Pediatr Res, 2005, 57(5 Pt 2): 87R-94R. doi: 10.1203/01.PDR.0000159569.57354.47.
[4] Petersen C, Biermanns D, Kuske M, et al. New aspects in a murine model for extrahepatic biliary atresia[J]. J Pediatr Surg, 1997, 32(8): 1190-1195. doi: 10.1002/jobm.201400330.
[5] Yin Y, Xu Y, Ou Z, et al. A simple and highly repeatable viral plaque assay for enterovirus 71[J]. J Basic Microbiol, 2015,55(4): 538-41. doi: 10.1002/jobm.201400330.
[6] Landing BH. Considerations of the pathogenesis of neonatal hepatitis, biliary atresia and choledochal cyst—the concept of infantile obstructive cholangiopathy[J]. Prog Pediatr Surg, 1974, 6: 113-139.
[7] Ohya T, Fujimoto T, Shimomura H, et al. Degeneration of intrahepatic bile duct with lymphocyte infiltration into biliary epithelial cells in biliary atresia[J]. J Pediatr Surg, 1995, 30(4): 515-518. doi: 10.1016/0022-3468(95)90120-5.
[8] Mack CL, Feldman AG, Sokol RJ. Clues to the etiology of bile duct injury in biliary atresia[J]. Semin Liver Dis, 2012, 32(4): 307-316. doi: 10.1055/s-0032-1329899.
[9] Muraji T, Suskind DL, Irie N. Biliary atresia: a new immunological insight into etiopathogenesis[J]. Expert Rev Gastroenterol Hepatol, 2009, 3(6): 599-606. doi: 10.1586/egh.09.61.
[10] Sokol RJ, Mack C. Etiopathogenesis of biliary atresia[J]. Semin Liver Dis, 2001, 21(4): 517-524. doi: 10.1055/s-2001-19032.
[11] Tyler KL, Sokol RJ, Oberhaus SM, et al. Detection of reovirus RNA in hepatobiliary tissues from patients with extrahepatic biliary atresia and choledochal cysts[J]. Hepatology, 1998, 27(6): 1475-1482. doi: 10.1002/hep.510270603.
[12] Bessho K, Bezerra JA. Biliary Atresia: Will Blocking Inflammation Tame the Disease?[J]. Annu Rev Med, 2011, 62(1): 171-185. doi: 10.1146/annurev-med-042909-093734.
[13] 王江, 郑珊, 卢丽娟, 等. 轮状病毒感染与胆道闭锁的相关性研究[J]. 临床小儿外科杂志, 2015, 14(6): 483-487. doi: 10.3969/j.issn.1671-6353.2015.06.009.
[14] 刘逦玮, 钱继红, 朱天闻, 等. 围生期巨细胞病毒感染5年临床总结[J]. 中国当代儿科杂志, 2016(2): 99-104. doi: 10.7499/j.issn.1008-8830.2016.02.001.
[15] Waters A, Jennings K, Fitzpatrick E, et al. Incidence of congenital cytomegalovirus infection in Ireland: implications for screening and diagnosis[J]. J Clin Virol, 2014, 59(3): 156-160. doi: 10.1016/j.jcv.2013.12.007.
[16] White AL, Hedlund GL, Bale JJ. Congenital cytomegalovirus infection and brain clefting[J]. Pediatr Neurol, 2014, 50(3): 218-223. doi: 10.1016/j.pediatrneurol.2013.11.005.
[17] 陈小爱, 杨继鑫, 冯杰雄. 胆道闭锁病因及其发病机制研究进展[J]. 中华实用儿科临床杂志, 2015(19): 1516-1518. doi: 10.3760/cma.j.issn.2095-428X.2015.19.021.
[18] Lu BR, Brindley SM, Tucker RM, et al. alpha-enolase autoantibodies cross-reactive to viral proteins in a mouse model of biliary atresia[J]. Gastroenterology, 2010, 139(5): 1753-1761. doi: 10.1053/j.gastro.2010.07.042.
Comparison of hepatobiliary injury for newborn BALB/c mice which induced by different titers of rhesus rotavirus
LinZefeng,ZengXinhao,ZhangHong,FuMing,ZhangRuizhong,XiaHuimin
DepartmentofPediatricSurgery,MunicipalWomen&Children’sMedicalCenter,GuangzhouMedicalUniversity,Guangzhou510120,ChinaCorrespondingauthor:ZhangRuizhong,Email:cowboy2006@163.com
Objective To compare the hepatobiliary injury difference of newborn BALB/c mice infected by different titers of rhesus rotavirus(RRV). Methods Neonatal mice(n=80) were randomly separated into 4 groups and were intraperitoneally inoculated with different titers of rotavirus: High titer group(1×107PFU/ml); Medium titer group(1×106PFU/ml); Low titer group(2.5×105PFU/ml); Control group (only culture medium) within the first 24 hours after birth. All mice were sacrificed at day 12 after RRV inoculation then the liver and blood samples were collected. Meanwhile, mice were observed daily for at least 12 days, including their weight, skin color and survival situation. Liver functions were examined by serum biochemical test and morphologic changes in the biliary tract were observed. Tissue sections underwent H&E staining and immunohistochemically analysis for the presence of CK19. ResultsCompared with the normal mice, the mice in the experimental group had different degrees of skin jaundice, weight lost, survival rate decreased, liver function damage. In the experimental group, the symptom of low titer group was light, and could be restored to normal, however, when compared with the low titer group, the mice in the high titer group were serious, their skin jaundice was more obvious, weight was significantly reduced and irreversible, survival rate was lower(50%),liver function of TBIL,DBIL,TBA,ALT,ALP were significantly increased.Further analysis showed that the high titer group had high bile duct obstruction rate (80%),with no case of obstruction in the low titer group. Histologic analysis also showed intrahepatic bile duct atresia in the high titer group, a large number of inflammatory cell infiltrated around the portal area, while the morphology of intrahepatic bile duct was almost normal and just a small amount of inflammatory cell infiltrated around the portal area in the low titer group.Conclusions Different titers of rotavirus had different effects on the newborn mice hepatobiliary system: high titer was easy to cause biliary atresia, and low titer caused hepatitis.
Rotavirus;Biliary atresia;Neonatal hepatitis
张锐忠,Email:cowboy2006@163.com
10.3760/cma.j.issn.1003-9279.2017.01.004
轮状病毒属;胆道闭锁;肝炎
2013年国家临床重点专科建设项目(小儿外科)(GJLCZD1301);广东省省级科技计划项目(2014A020212373)
2016-06-02)
