浅谈高考电化学解题技巧
2017-03-20廖华强
廖华强
摘 要:电化学是高考考试的重要内容,本文以2016年全国高考电化学试题为例,从拆、写、装、算四个角度分析电化学习题的解题方法,旨在找到操作性较强的解题技巧,进而提高学生灵活应用所学知识解决问题能力。
关键词:高考 电化学 解题技巧
中图分类号:G633.8 文献标识码:C 文章编号:1672-1578(2017)03-0109-02
电化学是化学知识在生活中应用比较广泛的知识点,一直以来都是高考的重点考察内容。学生若能顺利解决电化学题目,有利于增加其对化学知识的兴趣,增强其学习化学的自信心。但电化学题目题型多样,涉及范围较广,对化学相关知识要求较高,经常是学生们感觉到比较吃力的一类题型。本文以2016年全国高考电化学试题为例,介绍拆、写、装、查四个方面的解题方法,进而提高学生灵活应用所学知识解决问题的能力。
1 拆——辨别装置类型、标注电极种类、分析带电粒子移动、反应类型
解好电化学的题目,首先要先会拆,接负载的为原电池,接电源的为电解池;一般情况下较活泼金属当负极,较不活泼电极为正极等,达到“脑中有图”。例如,带电粒子在电化学装置中的移动如下图所示:
从图中很容易得出:负极:失去电子,化合价升高,氧化反应;阴极:得到电子,化合价降低,还原反应;阳极:失去电子,化合价升高,氧化反应;正极:得到电子,化合价降低,还原反应。
例1.[2016海南] 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法正确的是( )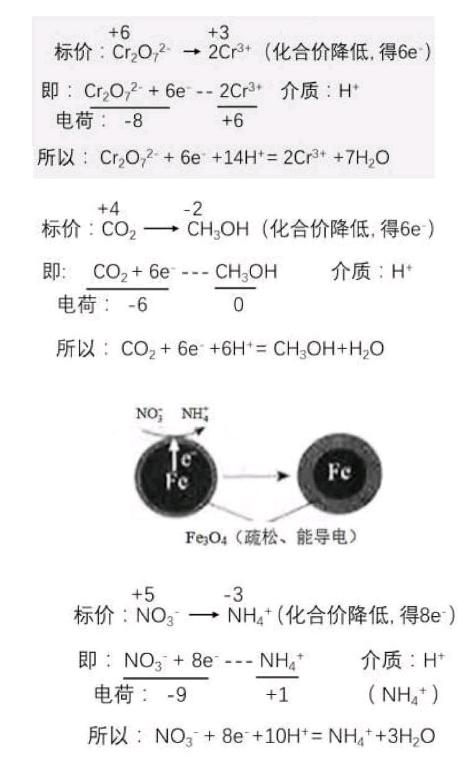
A. Zn为电池的负极
B. 正极反应式为2FeO42-+ 10H++6e-=Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度不变
D. 电池工作时向负极迁移
分析:A、D:拆-原电池:活泼金属Zn-负极,阴离子OH-向负极迁移。
2 写——写出电极反应方程式:重点关注电解质环境和电荷守恒
解好电化学的题目,其次要会写,写电极反应方程式,常见流程为:化合价的标注→得失电子(注意原子个数)→电荷守恒(用电解质溶液中的离子配)。
例1.[2016江苏卷](1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+其电极反应式为____。
分析:
例2.[2016浙江卷] 28.(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在____极,该电极反应式是_____。
分析:
例3.[2016北京卷](1)Fe还原水体中NO3-的反应原理如右图所示。①作负极的物质是____。②正极的电极反应式是____。
分析:
3 装——总反应方程式、电极反应产物判断、组合装置等
电化学知识点在考试中又常以总反应的形式出现,要求从整体上把握装置的电极产物以及原电池充放电过程。解决这类题目时,需要学生认真审题,如交换膜类型,电池充放电过程等。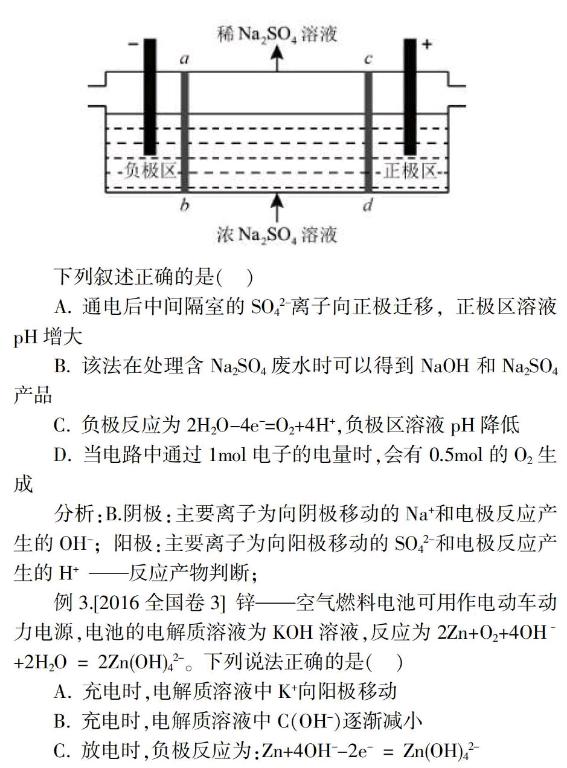
例1.[2016全国卷2]Mg—AgCl电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是( )
A. 负极反应式为Mg—2e-=Mg2+
B. 正极反应式为Ag++e-=Ag
C. 电池放电时Cl-由正极向负极迁移
D. 负极会发生副反应 Mg+2H2O=Mg(OH)2+H2↑
分析:该电池工作原理应该为2Mg+O2+2H2O=2Mg(OH)2,因此,正极应该是O2+4e-+2H2O=4OH-,Mg为活泼金属,会与水发生副反应Mg+2H2O=Mg(OH)2+H2↑。
例2.[2016全国卷1]三室式电渗析法处理含Na2SO4废水的原理如下图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。
下列叙述正确的是( )
A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和Na2SO4产品
C. 负极反应为2H2O-4e-=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
分析:B.阴极:主要离子为向阴极移动的Na+和电极反应产生的OH-; 阳极:主要离子为向阳极移动的SO42-和电极反应产生的H+ ——反应产物判断;
例3.[2016全国卷3]锌——空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O = 2Zn(OH)42-。下列说法正确的是( )
A. 充电时,电解质溶液中K+向阳极移动
B. 充电时,电解质溶液中C(OH-)逐渐减小
C. 放电时,负极反应为:Zn+4OH--2e- = Zn(OH)42-
D. 放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
分析:拆、写:放电——原电池,Zn:负极Zn+4OH--2e-=
Zn(OH)42-,充电-电解池,K+向阴极移动;
装:充电方程式与放电刚好相反,所以反应生成OH-,
C(OH-)逐渐增大。
4 算——定量计算电子转移和反应产物
化学是一门需要计算的学科,计算题在电化学中出现频率很高,总体上要求学生根据电子转移的数目来计算反应的产物,需掌握好物质的量的四个基本计算公式。
例1.[2016四川卷]某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:
Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是( )
A. 放电时,Li+在电解质中由负极向正极迁移
B. 放电时,负极的电极反应式为LixC6-xe-= xLi++C6
C. 充电时,若转移1mole-,石墨C6电极将增重7xg
D. 充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+
分析:算:石墨C6电极在阴极方程式为:xLi++C6+xe-= LixC6,因此若转移1mole-,石墨C6电极将增重7g。
总之,电化学题干虽然多样,若能从拆、写、装、算四方面有计划的训练,可以较好的提高学生的解题实际操作能力,达到比较好的教学效果。
参考文献:
[1] 王维臻.电化学认识模型及其在高三原电池复习教学中的应用[J].化学教育,2014.01.
[2] 陈键.高中電化学教材编写顺序探析——基于“解题程序”教学顺序的视角[J].化学教育,2014.19.
