广西莪术SSR—PCR反应体系优化和引物筛选研究
2017-03-17杨妮苏伟敏靳雅慧王建
杨妮+苏伟敏+靳雅慧+王建


摘要:以广西莪术(Curcuma kwangsiensis S.G.Lee et C.F.Liang)嫩叶为材料,采用单因素和正交试验设计建立和优化SSR-PCR反应体系和反应程序,对最适宜退火温度(Tm)进行筛选优化,对17对已公布的姜黄属通用性引物进行扩增试验,筛选出多态性好、条带清晰的引物。结果表明,建立了适合广西莪术SSR分析的反应体系和扩增程序,即在15 μL体系中,DNA模板为30 ng/μL,3 μL,Mix(包含DNTP、Mg2+、1×buffer、Taq酶)为5 μL,ddH2O为6 μL,引物为各0.5 μL时,分析效果较好,扩增程序为94 ℃预变性5 min;94 ℃变性30 s,根据不同引物的退火温度复性30 s,72 ℃延伸1.5 min,共35个循环;最后72 ℃延伸5 min;反应结束后,4 ℃保存。同时筛选出在试验材料中能产生较清晰主带的引物共12对,初步验证了应用SSR分子标记分析在广西莪术遗传多样性的可行性。
关键词:广西莪术(Curcuma kwangsiensis S.G.Lee et C.F.Liang);SSR;PCR反应体系优化;引物筛选
中图分类号:R283.6;R282.5 文献标识码:A 文章编号:0439-8114(2016)23-6271-05
DOI:10.14088/j.cnki.issn0439-8114.2016.23.067
Abstract: The single factor analysis and orthogonal experimental design were used to establish and optimize SSR-PCR reaction system andprocedures of Curcuma kwangsiensis S.G.Lee et C.F.Liang,and optimum annealing temperature(Tm) optimization. The 17 published universal primers of Curcuma longa L. were used for amplification test,screened polymorphic and clear bands of primers. The results showed that the establishment of a suitable Curcuma kwangsiensis S.G.Lee et C.F.Liang SSR analysis of the reaction system and amplified procedure,namely in 15 μL system,DNA template 30 ng/μL,3 μL,Mix(containing DNTP,Mg2+,1×buffer,Taq enzyme) of 6 μL,ddH2O to 5 μL,primers for the 0.5 μL,the analysis is better,amplification program was 94 ℃ for 5 min,94 ℃ denaturation 30 s,depending on the primer annealing temperature annealing 30 s,72 ℃ extension 1.5 min,35 cycles,and finally 72 ℃ for 5 min,after completion of the reaction,4 ℃ preservation. While filtering out the test material can produce clearer master with a total of 12 primer pairs validated the application of SSR markers in Curcuma kwangsiensis S.G.Lee et C.F.Liang feasibility analysis of genetic diversity.
Key words: Curcuma kwangsiensis S.G.Lee et C.F.Liang;SSR;SSR-PCR reaction system;primers screening
廣西莪术(Curcuma kwangsiensis S.G.Lee et C.F.Liang)为姜科姜黄属植物,以干燥根茎入药,其味辛、苦,性温,具有行气破血、消积止痛的作用,是临床上较为常用的活血化瘀药物[1]。莪术挥发油有较好的抗肿瘤、抗炎、抗菌、抗病毒作用[2],尤其在治疗肿瘤方面莪术具有很大的开发潜力[3-5]。广西莪术习称“桂莪术”,是广西主产道地药材,产区面积大,是中国药典规定品种,但长期以来广西莪术的品种选育和改良未受到足够的重视,广西莪术育种侧重于常规技术,在分子水平上的研究有待开展[6]。近年来,随着分子标记技术在植物遗传育种中的应用,研究者在药用植物分子生物学研究领域已取得显著成绩[7,8],其中一个重要的方向是应用DNA分子标记技术研究药用植物的遗传多样性、系统发育和遗传连锁作图[9,10]。
微卫星(Microsatellites)或简单序列重复(SSRs)是以1~6个碱基为基本单元的串联重复序列,具有数量丰富、多态性高、信息含量丰富、共显性遗传等优点,是一种较为理想的分子标记技术[11]。近年来,SSR在药用植物遗传育种中成为研究药用植物遗传结构,进行分子标记辅助育种和种质资源保护研究的重要工具。由于SSR是一种基于PCR技术的分子标记,其反应条件中的诸多因素都会对结果产生影响,为保证SSR-PCR的重复性,建立和优化其反应体系是十分必要的。本研究主要目的是建立并优化一种适用于广西莪术SSR分子标记研究的PCR反应体系和反应程序,筛选适用于广西莪术遗传多样性分析的具有丰富多态性的SSR引物,以期为加快广西莪术SSR分子标记的开发和分子遗传育种的研究进程奠定科学基础。
1 材料与方法
1.1 材料
采自广西南宁市仙湖种植基地的同一批莪术药材,4个有效样本,经广西中医药大学药用植物教研室王建教授鉴定为姜科植物广西莪术。
1.2 试剂
2% CTAB提取缓冲液、PVP(聚乙烯吡咯烷酮,BASF)、RNase A;氯仿-异戊醇(24∶1)、平衡酚-氯仿(1∶1)、异丙醇、TE Buffer、无水乙醇、75%冰醋酸,MixPCR Mix购自博瑞克生物技术公司,试验试剂均为国产分析纯。
1.3 仪器
FA1004型电子天平(上海精科天平仪器厂),Biospec-nano型紫外-可见分光光度计(广州科能仪器设备有限公司),Mini spin型高速离心机(德国艾本德公司),9700型PCR扩增仪(北京利超兴业科技有限公司)。
1.4 DNA提取方法
取广西莪术健康嫩叶0.5~1.0 g,采用改良的CTAB法提取基因组DNA[12]。并用紫外分光光度计检测DNA质量和浓度。所用仪器为岛津紫外可见分光光度计(BioSpec-nano),取DNA样品1 μL进行测定,检测所提取样品DNA的纯度和浓度,再分别计算产率。每个样品重复3次,取平均值。DNA产率=DNA浓度×提取液体积/原材料质量。
1.5 PCR扩增反应体系优化
1.5.1 引物筛选 所用引物为已公布的姜黄属17对通用引物[13],EST SSR-01~EST SSR-17,引物信息见表1。引物由上海生工生物技术有限公司合成。
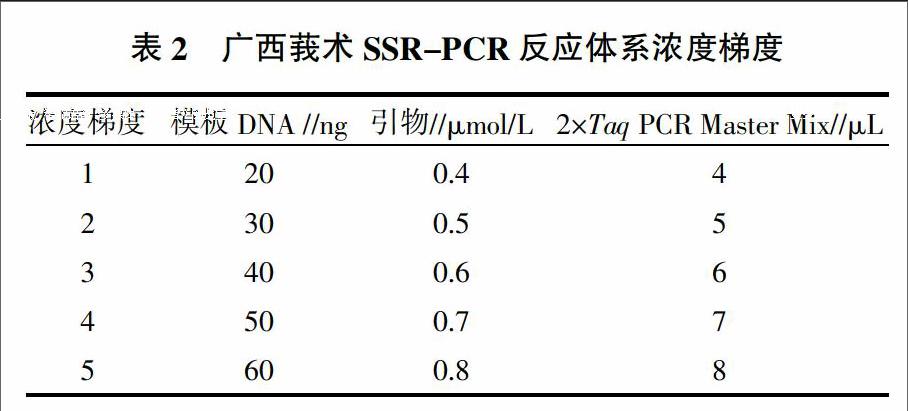
1.5.2 PCR反应体系单因素浓度梯度分析 在其他试验条件一定的情况下,对PCR反应体系的DNA模板浓度、引物用量,2×Taq PCR Master Mix用量进行浓度或用量梯度试验,分析不同处理条件对SSR引物扩增结果的影响。反应体系浓度梯度见表2。反应体系:DNA模板3 μL,Mix(包含DNTP、Mg2+、1×buffer、Taq酶)5 μL,ddH2O 6 μL,引物F、R各0.5 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 8 min。PCR产物扩增完成后于4 ℃保存备用。
1.5.3 PCR反应体系优化正交试验 采用L9(34)正交试验(表3),对DNA模板浓度、引物浓度、2×Taq PCR Master Mix含量进行筛选。试验各组合反应体系均加ddH2O补足至15 μL。试验设3次重复。正交试验能减少重复试验次数,具有方法科学、试验结果反映全面情况等优点[8]。
1.6 PCR扩增程序优化
1.6.1 SSR-PCR扩增程序的单因素试验 PCR扩增程序的关键因素包括变性时间、退火时间、延伸时间、循环次数,对其进行梯度试验,分析不同处理条件对SSR引物扩增结果的影响(表4)。
1.6.2 SSR-PCR扩增程序优化的正交试验 扩增程序参照文献[14]进行设计,94 ℃预变性5 min;94 ℃变性30 s,55 ℃(按特定引物特定温度)退火30 min,72 ℃延伸45 s,共35个循环;72 ℃延伸10 min,4 ℃保存。影响SSR-PCR扩增的关键因素变性时间、退火时间、延伸时间、循环次数作为筛选因素设计正交试验,采用优化后的反应体系进行PCR扩增,扩增程序优化选用L16(44)正交试验(表5)。
1.6.3 退火温度筛选 在建立并优化后的SSR-PCR反应体系基础上,利用梯度PCR对退火温度进行优化筛选。设定退火温度为51、53、55、57、59、61 ℃。
1.6.4 引物多态性筛选 采用优化的反应体系和扩增程序进行PCR反应扩增,从17对公布的姜黄属通用引物中,初步筛选获得在试验材料中能产生较清晰条带的引物,观察产生多态性条带的情况,筛选出能产生多态性的引物。
1.7 PCR扩增产物的聚丙烯酰胺凝胶电泳
7%变性聚丙烯酰胺凝胶电泳检测:PCR扩增产物中加入3 μL Loading Bufer(98%甲酰胺,10 mmol/L EDTA,0.05%溴酚蓝,0.05%二甲苯青)。每样品各取1 μL上样于7%变性聚丙烯酰胺凝胶上,在恒定200 V电泳1.0 h。用扫描仪扫描凝胶,得到分析图片。
2 结果与分析
2.1 DNA 模板质量检测
对所提取DNA质量,紫外可见分光光度计(BioSpec-nano)进行检测纯度和浓度,检测结果表明,试验提取的DNA OD260/OD280值在1.8~2.0之间,浓度在50 μg/mL左右,质量符合PCR反应需要。
2.2 模板浓度对PCR体系扩增的影响
在SSR-PCR扩增反应中,DNA模板浓度是一个重要的影响因子[15]。DNA模板质量浓度过低,无法扩增出清晰条带或者扩增不稳定,模板浓度过高,则出现非特异性扩增,均无法达到很好的扩增效果。本试验设置了20~60 ng/μL 5个NDA模板浓度进行优化,扩增结果见图1。从图1可以看出,模板浓度在20~50 ng/μL时均可以成功扩增出条带,模板浓度为30、40 ng/μL时最为稳定;当模板浓度低于30 ng/μL时扩增条带较浅,而当模板质量浓度大于50 ng/μL时,无法扩增出条带。因此,在单因素研究中,最佳模板浓度为30~40 ng/μL。
2.3 SSR-PCR正交反应体系的优化结果
根据L9(33)正交试验设计的9个反应体系进行优化,依照SSR-PCR反应扩增条带清晰度强弱、出带情况,得出2、3、4、5反应体系扩增出的条带比较清晰(圖2),而反应体系2扩增效果最优。即DNA模板为30 ng/μL,3 μL,Mix(包含DNTP、Mg2+、1×buffer、Taq酶)为5 μL,正反引物各0.5 μL,ddH2O补足至15 μL(即加入ddH2O 6 μL)时,分析效果较好。
2.4 SSR-PCR 反应程序正交试验结果
SSR-PCR反应程序L16(44)正交设计的16个组合扩增结果如图3所示。随着变性时间、退火时间、延伸时间以及循环次数的变化组合,不同处理条件下PCR扩增条带的深浅不一,效果参差不齐。结合前期研究以及正交试验结果得出反应程序6为最佳方案,即变性时间30 s,退火时间30 s,延伸时间45 s,循环次数35。
2.5 退火温度筛选结果
从图4可以看出,退火温度对SSR-PCR扩增有明显的影响,退火温度低于53 ℃时,主带不明显,且扩增产生许多浅色的杂带;当退火温度高于57 ℃时,扩增条带稳定性变差;在退火温度为55 ℃时条带的稳定性和重复性较好,扩增效果较好,这与理论[16]上的值[Tm=2(A+T)+4(G+C)]相一致。因此,选取55 ℃为该引物最佳退火温度。
试验初期对多种引物退火温度进行了优化,发现退火温度53 ℃以下,杂带多,扩增效率差,退火温度65 ℃以上,则无法扩增出清晰条带,扩增效率下降。而大部分引物在退火温度为54~56 ℃可以得到清晰具有多态性的条带。为了加快广西莪术SSR标记的开发速度,本研究对引物退火温度统一设定为55 ℃。这不仅一定程度上减少了杂带的干扰,也为了保证引物在不同种质中目标条带的扩增效率。
2.6 SSR-PCR引物筛选结果
从姜黄属17对SSR引物中初步筛选出14对可用于广西莪术的SSR引物,占全部引物的82.35%,并对利用这14对引物对4份莪术材料统一进行PCR扩增,采用优化的反应体系和扩增程序,进一步筛选获得在试验材料中能产生较清晰条带的引物共有12对,这些引物是有效引物,适用于广西莪术材料。图5、图6为引物SSR-01~SSR-16在4种种质资源上进行PCR扩增后扫描得到的电泳图。
3 小结与讨论
SSR-PCR反应体系和反应程序的建立、优化及退火温度和引物的筛选是SSR多态性标记开发和应用的基础。由于本研究中SSR-PCR反应体系所含组分多,且均可能对扩增的特异性、敏感性以及产量变化产生影响,因此建立一套良好的反应体系是保证分子标记开發稳定性的基础。SSR反应体系优化的方法较多,常规的方法是进行多次单因素试验,缺点在于当一种组分浓度发生变化时,其余几种组分浓度往往靠经验确定,因此难以确定最佳组合[16]。正交试验反应体系设计可有效地解决单因素试验次数繁多、工作量大、试验周期长等问题,将各因素、各水平之间的组合均匀搭配、合理安排,同时PCR扩增产生高度特异灵敏度,因此具有科学性和可行性。本试验采用正交试验,优化后的SSR-PCR反应体系在后续SSR分析中得到了验证。
PCR反应时,退火温度是影响PCR特异性的较重要因素[17]。在理想状态下,退火温度足够低,以保证引物同目的序列有效退火,同时还要足够高,以减少非特异性结合。退火温度和时间取决于引物长度及碱基组成及其浓度,还有序列的长度[18]。GC含量越高退火温度越高,引物设计时的Tm值减去5~8 ℃即是引物的退火温度,本研究设计的引物序列长16~25 bp,G+C含量40%~60%,发现合适的温度在55~58 ℃,退火时间一般是30 s。为了加快试验进度,因此将55 ℃做为最理想退火温度。SSR引物的筛选需要经过PCR扩增和聚丙烯酰胺凝胶电泳,根据出带情况,经过重复试验,筛选出具有多态性,条带清晰的引物,才能满足种质资源多态性分析要求。
参考文献:
[1] 国家药典委员会.中华人民共和国药典,一部[M].北京:中国医药科技出版社,2010.
[2] 李宝石,夏宁俊,朱超林.中药莪术对肿瘤相关信号通路影响研究进展[J].辽宁中医药大学学报,2015,17(2):188-191.
[3] 王 艳,刘杰书.莪术抗宫颈癌作用的研究进展[J].中国民族民间医药,2014(21):25-26.
[4] 王 建,赵应学.不同种质类型广西莪术挥发油成分多样性研究[J].药物分析杂志,2010,30(6):1072-1075.
[5] 陈 喆,何仁锋,姜梦莹,等.近5年我国药用植物遗传连锁图谱构建的研究进展[J].中草药,2015,48(3):435-442.
[6] 向巧彦,黄夕洋,李 虹.广西药用植物两面针遗传多样性的ISSR分析[J].广西科学,2013(5):541-549.
[7] 杨先国,谷陟欣,卢 捷.4种紫珠属药用植物RAPD多态性分析[J].亚太传统医药,2015(7):28-31.
[8] 毛 帅,刘朝奇,向婷婷.基于DNA水平的中国药用植物分子鉴定方法[J].中国实验方剂学杂志,2015(5):238-242.
[9] 段永红,渠云芳,王长彪.药用植物苦参SSR-PCR体系的优化与验证[J].中国农业大学学报,2014(5):95-100.
[10] 杨林栋.分子标记技术及其在大白菜遗传育种中的应用[J].安徽农业科学,2015,43(4):30-33.
[11] 王 娟,侯艳芳,白 准.广西莪术DNA条形码通用序列的筛选[J].中华中医药杂志,2015,30(1):100-103.
[12] 冯 图,黎云祥.几种药用植物基因组DNA提取方法研究[J]. 毕节学院学报,2011,29(8):98-101.
[13] SIJU S,DHANYA K,SYAMKUMAR S,et al.Development,characterization and cross species amplification of polymorphic microsatellite markers from expressed sequence tags of turmeric(Curcuma longa L.)[J].Mol Biotechnol,2010,44:140-147.
[14] 朱晓敏,王弦云,陈龙灿.杜仲SSR-PCR反应体系建立及引物筛选[J].安徽农业大学学报,2013,40(3):387-392.
[22] 陶银龙,王佐元,丁文勇.5个温郁金居群遗传多样性的RAPD 分析[J].绍兴文理学院学报,2013,33(9):53-57.
[15] 郭 敏,李 毅,马彦军.山生柳SSR-PCR反应体系优化[J].草业科学,2012,29(5):741-747.
[16] 郑丽珊.香蕉SSR分子标记的开发[D].海南儋州:华南热带农业大学,2005.
[17] 王丽鸳,姜燕华,段云裳.茶树EST-SSRs分布特征及引物开发[J].植物遗传资源学报,2009,10(4):511-516.
[18] HUSSAIN Z,TYAGI R K,SHARMA R,et al. Genetic diversity in in vitro-conserved germplasm of Curcuma L. as revealed by RAPD markers[J].Biologia Plantarum,2008,52(4):627-633.
