减毒鸡白痢沙门菌△aroA株的构建与致病性分析
2017-03-17程伊洛邵华斌罗青平刘国平张腾飞
程伊洛+邵华斌+罗青平+刘国平+张腾飞

摘要:以鸡白痢沙门氏菌c79-3强毒株为亲本,通过λ-red同源重组系统构建鸡白痢沙门菌aroA基因缺失株△aroA,并进行了测序验证和毒力试验。结果表明,aroA基因缺失株的生长速度较亲本株缓慢,且该缺失株具有良好的遗传稳定性;相比野生菌株,aroA基因缺失株的毒力发生了下降,雏鸡攻毒死亡率较亲本株低。本研究获得的减毒鸡白痢沙门氏菌aroA基因缺失株△aroA,为进一步研究鸡白痢沙门氏菌aroA基因的功能和后续减毒活疫苗开发奠定了基础。
关键词:鸡白痢沙门氏菌;λ-red同源重组;aroA基因;生物学特性;活疫苗
中图分类号:S852.65 文献标识码:A 文章编号:0439-8114(2016)23-6195-05
DOI:10.14088/j.cnki.issn0439-8114.2016.23.049
Abstract:The △aroA mutant was constructed by the λ-red recombinant based on c79-3 virulent strain and was confirmed by PCR and sequencing. The growth characteristics and genetic stability of the mutant strain was tested. The results showed that the growth rate of △aroA mutant was slow than the parent strain and was stable. The pathogenecity tests on one day-old chicks. The results showed that compared with wild strains, the virulence of aroA gene deletion mutant was decreased, and the attack rate of chicken was lower than that of the parent strain. In conclusion,we successfully obtained △aroA mutant strain and this study provided basic data for further study of the functions of the aroA gene and live attenuated vaccine.
Key words: Salmonella pullorum; λ-red recombinant system; aroA gene; biological characteristic; live vaccine vector
沙門氏菌属包含2 500多种血清型,其中包括了肠炎沙门氏菌、鼠伤寒沙门氏菌等人畜共患血清型以及具有宿主高度专一性的鸡白痢沙门氏菌血清型。鸡白痢(pullorumdisease,PD)是由对家禽具有高度的适应性的鸡白痢沙门氏菌(Salmonella pullorum)引起的一种多发性传染病[1]。鸡白痢沙门氏菌可水平传播,易感染三周龄以下的雏鸡,且有较高的致死率[2]。此外,它还能持续感染脾脏和生殖道数月时间,引起产蛋和后代的垂直感染[3]。鸡白痢在发达国家已经被根除,但仍在世界范围内特别是发展中国家引起巨大的经济损失[4,5]。鸡群长时间高水平感染和抗生素滥用导致细菌的耐药性持续增加,导致鸡白痢更加难以控制。一个好的控制鸡白痢沙门氏菌感染的方法有巨大的应用前景[6]。
疫苗的应用也能很好的控制和预防沙门氏菌的感染[7]。目前在国际上得到应用的沙门氏菌疫苗主要有鸡伤寒沙门氏菌、鼠伤寒沙门氏菌、鸡肠炎沙门氏菌苗等。在欧洲禽类养殖国家,沙门氏菌疫苗的应用在防治沙门氏菌感染方面起到了非常重要的作用。许多研究表明减毒活疫苗的效果要优于灭活苗,由于沙门氏菌是一种兼性胞内寄生菌,特异性细胞免疫是控制它的关键。与灭活苗相比,减毒活疫苗能优先刺激机体产生细胞免疫,具有更高的效率[8]。然而在中国,尚未有自主研发且匹配中国流行菌株的沙门氏菌疫苗产品。因此,研发针对鸡白痢的减毒活疫苗对中国禽类养殖具有重大意义。本研究以野生强毒株C79-3为亲本,通过λ-red同源重组系统[9,10]构建芳香族氨基酸合成相关基因aroA缺失株△aroA,达到干扰细菌代谢,降低毒性的效果,从而为研发更加安全有效的减毒活疫苗奠定基础。
1 材料与方法
1.1 菌株、质粒、试验动物
鸡白痢沙门氏菌强毒株c79-3;Red同源重组所需质粒pKD3、pKD46、pcp20由扬州大学彭大新教授馈赠;1日龄白来航雏鸡由购自北京梅里亚维通实验动物技术有限公司的SPF鸡胚自孵。
1.2 主要试剂和培养基
甘油、氨苄青霉素(Ampicillin)、氯霉素(chloramphenicol)购于美国Sigma公司;普通Taq DNA聚合酶、PrimerSTAR Max DNA高保真聚合酶、DNA片段回收试剂盒、DNA Marker均购自大连宝生物工程有限公司;LB肉汤/琼脂培养基为美国BD公司产品。
1.3 鸡白痢沙门氏菌aroA基因缺失株构建
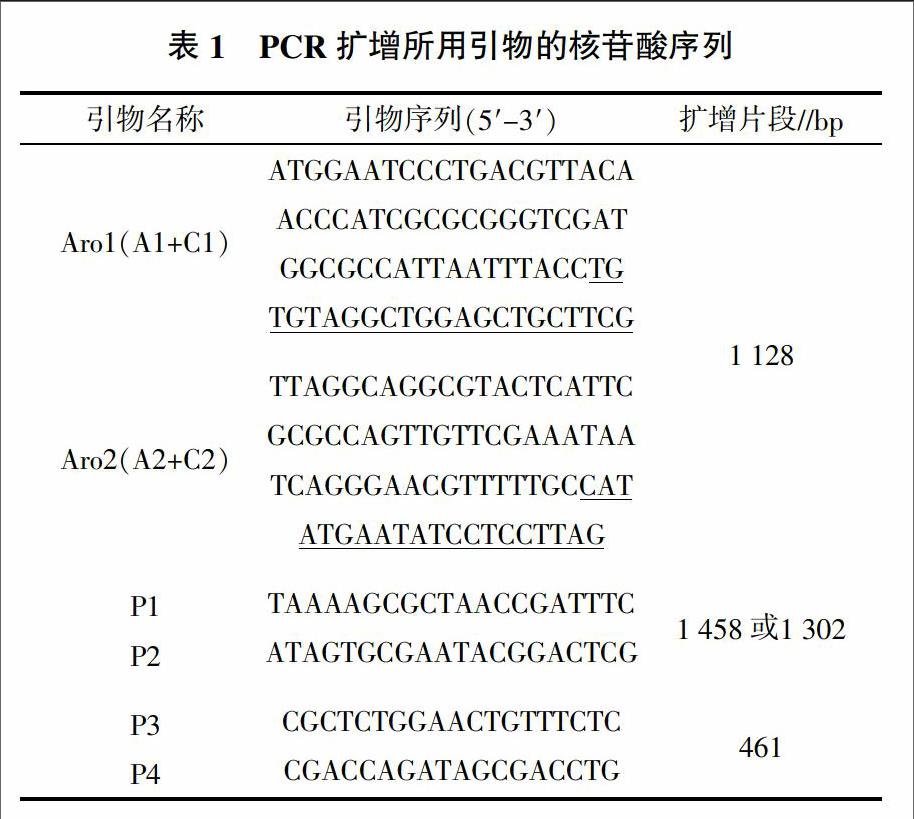
1.3.1 引物设计 参考Genebank中的鸡白痢沙门氏菌(NC_011274)aroA基因序列,用Primer 5设计一对敲除引物Aro1和Aro2(表1)。其中,Aro1由 56 bp的aroA基因上游同源序列A1和扩增质粒pKD3氯霉素抗性基因的上游引物C1(下划线所示)组成,Aro2由57 bp的与aroA基因下游同源的序列A2和扩增质粒pKD3氯霉素抗性基因的下游引物C2(下划线所示)序列组成。另外,从aroA基因两侧设计引物P1、P2;aroA基因中间设计上游引物P3和下游引物P4,如表1所示,用于aroA基因缺失构建过程中的PCR验证。
1.3.2 同源打靶片段的制备 以质粒pKD3为模板,Aro1和Aro2为引物,用PrimerSTAR Max DNA高保真酶进行PCR扩增,扩增条件:98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸20 s(35個循环)。经琼脂糖凝胶电泳检测扩增并测序成功后,将扩增成功的PCR产物用双蒸水稀释100倍当做模板进行2次PCR扩增(确保PCR产物经胶回收后无质粒残留),利用DNA片段回收试剂盒回收打靶片段,回收后的DNA片段溶于灭菌后的纯水中。
1.3.3 重组酶的诱导表达与感受态细胞的制备 将转化了pKD46的c79-3菌株接种氨苄抗性LB培养基,30 ℃培养过夜;次日按1∶100转接到50 mL含氨苄青霉素浓度为50 μg/mL LB培养基,30 ℃培养至DD600=0.2左右时,加入终浓度为30 mmol/L的L-阿拉伯糖继续培养1 h,诱导使质粒pKD46上Exo、Bet和Gam三个发挥重组作用的蛋白得到充分表达。取出培养基冰上预冷10 min,5 000 r/min 4 ℃离心10 min弃培养基;用预冷的10%甘油离心洗涤3次,最后重悬细胞于500 μL预冷的10%甘油中,分装每管100 μL备用,命名为c79-3/pKD46。
1.3.4 打靶片段电转化 将约800 ng同源臂引物扩增纯化得到的氯霉素抗性基因片段加入制备好的感受态细胞c79-3/pKD46中,轻弹混匀后加入 1 mm电转杯,静置30 min后,选择200 Ω,25 μF, 1 800 V电击条件用伯乐电转仪作电转化,电击时间为(5.0±0.5) ms。电击后迅速加入800 μL预冷的LB肉汤培养基,200 r/min 37 ℃培养2 h后3 000 r/min离心5 min收集菌体,涂布于含氯霉素浓度为50 μg/mL的LB平板,30 ℃倒置培养,18 h后挑选氯霉素抗性克隆,并进行PCR验证。
1.3.5 质粒pKD46去除 用接种环沾取经PCR鉴定重组成功的菌株,在不含任何抗生素的LB平板上划线后倒置于43 ℃温箱中培养过夜。次日用10 μL枪头挑取单克隆,先在含氨苄青霉素的平板上轻点后再以同一枪头的同一部位于含氯霉素平板上轻点,37 ℃条件下倒置过夜培养,挑选对氨苄青霉素敏感而对氯霉素具有抗性的克隆,命名为△aroA∶∶Cm。
1.3.6 FLP位点专一性重组 将上述消除质粒pKD46的阳性克隆用“1.3.3”中方法制成感受态细胞,选择“1.3.4”中相同电击条件电转质粒pcp20, 30 ℃培养6 h后,升温到43℃培养过夜,热诱导质粒pcp20上FLP专一性重组酶表达,消除△aroA∶∶Cm上的氯霉素片段,pcp20为温敏质粒,升温后也逐渐丢失。用接种环蘸菌液在无抗性LB琼脂培养基上划板,用枪头沾取单菌落点到氯霉素抗性LB平板和无抗LB平板上,过夜培养后无抗LB平板上长出菌落而氯霉素平板上无菌落生长的表示氯霉素抗性基因已被FLP重组酶成功消除。用鉴定引物做PCR对氯霉素抗性消失的克隆进行鉴定,最终获得aroA基因缺失株△aroA。
1.4 △aroA遗传稳定性的鉴定
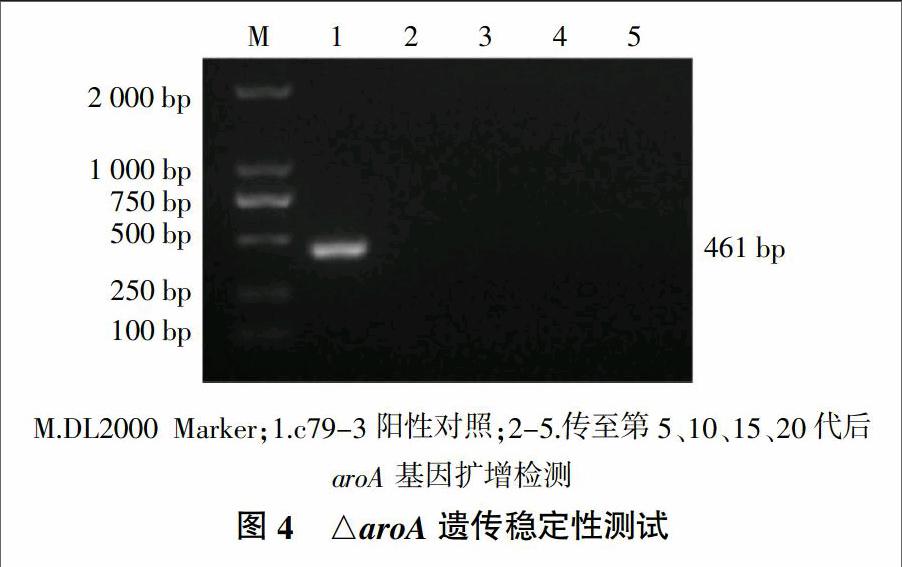
用LB琼脂平板对鸡白痢沙门菌株c79-3和△aroA进行连续传代培养至20代,分别选取第5、10、15、20代菌落为模板,用aroA基因内部特异性引物P1、P2进行PCR扩增,用野生c79-3作阳性对照,通过扩增条带的有无鉴定△aroA菌株的遗传稳定性。
1.5 △aroA的生长特性研究
以无抗LB琼脂平板同时划线培养c79-3、aroA基因缺失株△aroA,同时挑取鸡白痢沙门氏菌c79-3、△aroA分别接种于LB肉汤培养基中震摇过夜,次日分别转接于40 ml的LB肉汤培养基中,调节初始OD600 nm均为0.05,37 ℃、180 r/min连续振荡培养14 h,每隔1 h取出100 μL菌液测定OD600 nm的值,通过生长曲线绘制与平板上c79-3和△aroA的菌落大小同时判断两种菌株生长速度。
1.6 △aroA对雏鸡的毒力试验
将20只1日龄白来航雏鸡随机分为A、B两组,分别接种鸡白痢沙门菌株c79-3和△aroA菌株。A组10只,以3.4×107CFU的剂量口服接种c79-3;B组10只,以3.2×107CFU的剂量口服接种△aroA(两组的活菌数由攻毒的菌液作活菌计数得到)。连续观察2周,观察小鸡症状并统计死亡情况,从而评价菌株对雏鸡的毒力。
2 结果与分析
2.1 鸡白痢沙门氏菌aroA基因缺失株△aroA的鉴定
以质粒pKD3为模板,通过Aro1和Aro2引物,扩增出中间为氯霉素抗性基因,两翼与aroA基因上下游序列同源的1 284 bp长同源臂DNA片段(图1)。用aroA基因两侧特异性引物P1,P2扩增交换后的△aroA∶∶Cm基因组,以野生株c79-3基因组为对照,结果见图2。以野生株c79-3为模板的扩增出了1 458 bp的条带,而以△aroA∶∶Cm基因组为模板扩增出了1 302 bp的aroA基因同源臂和Cm抗性基因替换片段。用aroA基因内部特异性引物P3,P4扩增抗性片段消除后的△aroA基因组,以野生株c79-3基因组为对照,结果见图3,以c79-3基因组为模板扩增出了大小为461 bp的部分aroA基因特异性条带,而以△aroA基因组为模板未扩增出aroA基因特异性条带。且以aroA基因两侧引物P1、P2扩增测序结果也进一步证实鸡白痢沙门菌aroA基因缺失株△aroA构建成功。
2.2 △aroA的遗传稳定性
分别以平板代传代培养到第5、10、15、20的△aroA和c79-3的基因组为模板,通过aroA基因内部特异性引物P3、P4进行PCR扩增,测定△aroA的遗传稳定性。由图4可知,野生株c79-3的PCR产物点样显示出大小为461 bp的特异性条带,而在传代的△aroA菌株PCR产物中均没有特异性条带扩出。说明在传至第20代时,aroA基因没有回复,证明△aroA具有良好的遗传稳定性。
2.3 △aroA的生长特性
LB划线培养的c79-3和△aroA生长速度有差异,同时划线培养的野生株在LB平板上菌落明显大于aroA基因缺失株(图5),生长曲线显示,在初始的8 h內野生株和aroA基因缺失株生长速度基本一致,在8 h之后野生株生长速度大于缺失株,说明aroA基因的缺失影响鸡白痢沙门菌c79-3的生长(图6)。
2.4 △aroA对雏鸡的毒力试验
A组攻毒c79-3的10只雏鸡在第四天死亡4只,死亡率为40%,雏鸡出现萎靡,下痢等症状;B组攻毒△aroA的10只雏鸡未发生死亡(图7),症状较A组轻,说明aroA基因缺失后,其毒性发生下降。
3 讨论
本试验利用λ-red同源重组技术构建了鸡白痢沙门氏菌株c79-3的aroA基因缺失株△aroA。生长特性鉴定结果表明,aroA基因缺失后在LB平板上生长速度变慢,同时接种的aroA缺失株菌落明显小于野生株,需20 h方可见明显单菌落。在LB肉汤里生长测定生长曲线时,前8 h通过OD600 nm判断野生株和缺失株生长速度没有差异,在8 h后野生株生长速度超过aroA基因缺失株。推测平板划线结果与生长曲线测定前期有差异可能是在平板上生长时初期菌落较小,肉眼无法辨别出差异有关,后期随着菌落继续生长,出现了野生株菌落大于缺失株,与生长曲线结果相一致。aroA编码5-烯醇丙酮酞莽草酸-3-磷酸合成酶,该酶催化芳香族氨基酸的合成,参与代谢途径过程[11-12],其生长特性变慢可能是由于aroA基因的缺失导致芳香族氨基酸合成受阻,影响了细菌的生长。毒力试验结果表明,aroA基因缺失后,鸡白痢沙门菌对雏鸡的的致病性显著下降,推测由于aroA基因的缺失,鸡白痢沙门氏菌的生长与环境适应能力受限,从而使得菌株的毒力下降。
随着分子克隆技术越来越成熟,由aroA缺失导致的芳香族氨基酸营养缺陷得到越来越多的关注。Malcova[13]在肠炎沙门氏菌、Sebkova[14]在肠炎、鼠伤寒沙门氏菌上构建aro基因的缺失弱毒苗,结果表明芳香族氨基酸合成相关基因的阻断获得的减毒菌株在鸡、小鼠等动物体上使用能获得较好的免疫保护效果。本试验以强毒株C79-3为亲本,通过λ-red同源重组系统成功构建了鸡白痢沙门氏菌aroA基因缺失株,致病性相比亲本株有明显下降,然而后期试验显示高剂量感染突变菌株仍能造成少量雏鸡死亡。杨林等[15]的研究显示不同亲本菌株缺失aroA基因后致病性的下降程度具有一定的差异,本试验构建的aroA缺失株并未完全丧失致病性,可能与本试验所用的亲本株毒力较强有关。可见单独缺失鸡白痢沙门氏菌强毒菌株c79-3的aroA基因,其致弱效果还未达到弱毒疫苗的要求,可以在保持较好免疫原性的前提上,尝试在△aroA基础上继续缺失其它营养性基因或毒力基因,获得具有更高免疫原性的减毒活疫苗候选株。本试验为下一步研究鸡白痢沙门氏菌aroA基因缺失株的功能和基于aroA基因缺失的鸡白痢沙门氏菌减毒活疫苗奠定了基础。
参考文献:
[1] LUTFUL KABIR S M. Avian colibacillosis and salmonellosis:A closer look at epidemiology, athogenesis, diagnosis, controland public health concerns[J].Int J Environ Res Public Health,2010, 7(1):89-114.
[2] BARROW P A,FREITAS NETO O C. Pullorum disease and fowl typhoid-newthoughts on old diseases: A review[J].Avian Pathol,2011,40(1):1-13.
[3] WIGLEY P, HULME S D, POWERS C,et al.Infection of the reproductive tract and eggs with Salmonella enterica serovar pullorum in the chicken is associated with suppression of cellular immunity at sexual maturity[J].Infect Immun,2005,3(5):2986-2990.
[4] JONES M A, WIGLEY P, PAGE K L,et al.Salmonella enterica serovar Gallinarum requires the Salmonella pathogenicity island 2 type III secretion system but not the Salmonella pathogenicity island 1 type III secretion system for virulence in chickens[J].Infect Immun,2001,9(9):5471-6.
[5] KANG M S, KWON Y K, KIM H R,et al.Differential identification of Salmonella enterica serovar Gallinarum biovars Gallinarum and Pullorum and the biovar Gallinarum live vaccine strain 9R[J].Vet Microbiol,2012,60(3-4):491-5.
[6] PAN Z, WANG X, ZHANG X,et al.Changes in antimicrobial resistance among Salmonella enterica subspecies enterica serovar Pullorum isolates in China from 1962 to 2007[J].Vet Microbiol,2009,36(3-4):387-392.
[7] LIU H, CHEN L, WANG X,et al.Decrease of colonization in the chicks' cecum and internal organs of Salmonella enterica serovar Pullorum by deletion of cpdB by Red system[J].Microb Pathog,2015,80:21-6.
[8] DARWIN K H,MILLER V L.Molecular basis of the interaction of Salmonella with the intestinal mucosa[J].Clin Microbiol Rev,1999,12(3):405-428.
[9] MUNIYAPPA K,RADDING C M.The homologous recombination system of phage λ. Pairing activities of β protein[J]. J Biol Chem,1986,261(16):7472-7478.
[10] POTEETE A R.What makes the bacteriophage λ Red system useful for genetic engineering:Molecular mechanism and biological function[J].FEMS Microbiol Lett,2001,201(1):9-14.
[11] 郭東春,卢 艳,刘家森,等.多杀性巴氏杆菌aroA基因缺失突变株的构建及鉴定[J].微生物学报,2012,52(4):526-531.
[12] HOMCHAMPA P,STRUGNELL RA,ADLER B.Molecular analysis of the aroA gene of Pasteurella multocida and vaccine potential of a constructed aroA mutant[J].Molculer Microbiology,1992,6(23):3585-3593.
[13] MALCOVA M,KARASOVA D,RYCHLIK I. AroA and aroD mutations influence biofilm formation in Salmonella Enteritidis[J].FEMS microbiology lett,2009,291(1):44-49.
[14] SEBKOVA A,KARASOVA D,CRHANOVA M,et al.Aro mutations in Salmonella enterica cause defects in cell wall and outer membrane integrity[J].J Bacteriol,2008,190(9):3155-3160.
[15] 杨 林.沙门菌多重PCR检测方法的建立及鸡白痢沙门菌aroA缺失株的构建[D].江苏扬州:扬州大学,2014.
