运用GT/PCL纳米纤维电纺膜在猪皮下构建组织工程化软骨的实验研究
2017-03-16霍莹莹周广东郑蕊
霍莹莹 周广东 郑蕊
·论著·
运用GT/PCL纳米纤维电纺膜在猪皮下构建组织工程化软骨的实验研究
霍莹莹 周广东 郑蕊
目的探讨运用GT/PCL电纺材料为支架,在大动物皮下构建组织工程化软骨的可行性。方法成年大白猪耳廓软骨获取种子细胞,分别以GT/PCL电纺材料(实验组)和传统PGA/PCL(对照组)支架材料构建软骨。细胞-材料复合物在体外培养3周后,回植入自体猪皮下。分别于回植前、体内培养3周时行组织学检测、湿重和力学强度检测,比较两组的软骨形成情况。结果体外培养3周后,两组均可见软骨组织形成,均可见明显未降解材料,对照组软骨基质分泌更为旺盛;体内培养3周后,实验组形成成熟的软骨组织,对照组未见明显软骨形成,基本为纤维组织所替代;实验组力学强度明显大于对照组。结论GT/PCL电纺材料可以作为支架,在大动物皮下成功构建组织工程化软骨组织,是一种具有临床应用前景的支架材料。
组织工程化软骨纳米纤维电纺膜聚乙酸聚乳酸炎症反应
支架材料是影响组织工程化软骨构建的关键问题之一。胶原(Gelatine,GT)/聚己内酯(Polycaprolactone,PCL)纳米纤维电纺膜作为一种新型材料,在组织工程领域已引起广泛关注。我们之前的研究显示,GT/PCL纳米纤维电纺膜作为支架材料,可以成功在体外和裸鼠体内构建组织工程化软骨[1-2]。大动物实验是进入临床试验的重要前期准备。一些常用的支架材料可以在体外和免疫豁免动物体内成功构建出软骨组织,但由于大动物皮下血运丰富、免疫环境复杂,这些材料在大动物体内实验中常引起严重炎症反应,影响软骨形成[3-5]。因此,为了进一步验证其大动物皮下成软骨的可行性,本研究以聚乙酸(Polyglycolic acid,PGA)/聚乳酸(Polylactic acid,PLA)支架材料为对照,以GT/PCL(50∶50)纳米电纺材料(G5P5)为实验组,复合自体软骨细胞进行软骨构建,并回植于猪自体皮下,比较两者在大动物皮下的软骨形成能力。
1 材料与方法
1.1 实验动物
杂交猪3只(上海甲干生物科技有限公司),雌雄不限,体质量50~60 Kg。实验过程均依照动物实验保护指南进行。每只杂交猪选取腹部近后肢平坦处回植,左侧为细胞-GT/PCL材料复合物(n=5),右侧为细胞-PGA/PCL材料复合物(n=5),实验重复3次。
1.2 实验材料
胰蛋白酶(Hyclone公司,美国);Ⅱ型胶原酶(Worthington公司,美国);高糖DMEM培养基(Gibco公司,美国);胎牛血清(Hyclone公司,美国);无纺PGA纤维(组织工程国家工程中心);GT/PCL纳米纤维电纺膜(上海儿童医学中心转化医学研究所)。
1.3 细胞的获取与扩增
剪取猪耳廓软骨,洗净,切成1 mm×1 mm×1 mm大小,加入5倍体积的0.25%胶原酶摇床消化过夜;75 μm孔径滤网过滤,离心,PBS漂洗2遍,以含10% FBS的高糖DMEM配成细胞悬液,按2×106个/皿(直径10 cm培养皿)接种细胞,置入5%CO2、37℃培养箱培养。细胞达90%融合时进行传代[6]。本实验所用细胞均为第二代软骨细胞。
1.4 细胞-GT/PCL复合物的制备
用7 mm直径的角膜环钻将G5P5纳米纤维电纺膜处理成直径7 mm的圆形膜片,真空冷冻干燥机进行过夜冷冻干燥处理,紫外灯下消毒30 min后备用。根据本实验室的前期研究成果,运用“三明治”法构建细胞-材料复合物[7]。将第2代软骨细胞用软骨细胞培养液制备成6×107cells/mL浓度的细胞混悬液,用显微镊将G5P5纳米纤维电纺膜按照“膜片-细胞悬液-膜片”的方式在培养皿中层层叠加,每层约加入8 μL细胞悬液,共叠加10层,约80 μL,然后将构建的细胞-材料复合物放入培养箱中培养,小心加入含10%FBS的高糖DMEM至覆盖复合物,放入5%CO2、37℃培养箱中培养。3~4 d换液一次,换液时应轻轻吸除培养液[1]。体外培养3周后,将细胞-GT/PCL复合物植入自体大白猪腹部的皮下。
1.5 细胞-PGA/PCL复合物的制备
15 mg无纺PGA纤维制成直径7 cm大小圆片,将1%PLA二氯甲烷溶液均匀滴在PGA纤维上,使PGA/PLA混合材料总质量达到16.5 mg[8]。75%乙醇消毒,PBS冲洗3次。将第2代软骨细胞用软骨细胞培养液制备成6×107cells/mL浓度的细胞悬液,均匀滴在PGA/PLA支架上,每块材料可吸水80 μL。在37℃、5%CO2及饱和湿度条件下培养4 h,加入软骨组织培养液(含10%FBS、1%青霉素及链霉素的DMEM)继续培养,隔天换液。体外培养3周后,将细胞-PGA/PLA复合物植入自体大白猪腹部皮下。
1.6 组织学检查
每组分别于回植前(体外培养3周)、体内培养3周时,各取5个样本,大体观察。然后,将标本以4%多聚甲醛固定,石蜡包埋,切片,行HE及油红-O染色,观察组织结构及细胞外基质分泌情况。免疫组织化学染色检测Ⅱ型胶原的表达情况[7,9]。
1.7 湿重与力学强度检测
将构建物轻轻夹出,在滤纸上吸干表面水分后用精密天平称重,每组5个标本。用生物力学分析仪(Instron 5542-C8609,美国)对各组构建软骨进行单轴向、非限定性压缩的生物力学分析。通过应力-应变力学测试来测定组织弹性模量和抗压强度,每组5个样本[1]。
1.8 统计学分析
样本的各项定量指标均以(x±s)表示,应用SPSS13.0对数据进行统计学分析,P<0.05认为差异有统计学意义。
2 结果
2.1 构建的软骨组织大体和组织学观察
软骨细胞分别与实验组、对照组支架材料复合,构建直径7 mm的圆柱形细胞材料复合物(图1A、B),体外培养后植入自体大白猪腹部皮下(图1C)。
体外培养3周后,构建的软骨组织从外观上看,均为有一定弹性的软骨样组织,直径、大小无明显改变(图2A、E)。组织学显示,两组均有软骨陷窝形成,实验组软骨层较薄,并被条带状材料所分割(图2B-D),对照组软骨基质分泌更为旺盛,细胞基质更均匀,大量纤维状残余材料分布其中(图2F-H)。
体内培养3周后,实验组继续发育成熟,大小无明显回缩(图3A),组织学可观察到大量基质分泌,有成熟的软骨陷窝形成,同时可见明显的条带状材料残余(图3B-D)。对照组样本较体外培养时缩小(图3E),质软,组织学未见软骨陷窝形成,未见明显材料残余(图3F-H)。
2.2 体内培养3周后构建组织的湿重和力学强度经过3周的体内培养,实验组和对照组样本湿重统计未见明显差异(图4A);实验组力学强度明显大于对照组(图4B),有统计学差异(P<0.01)。
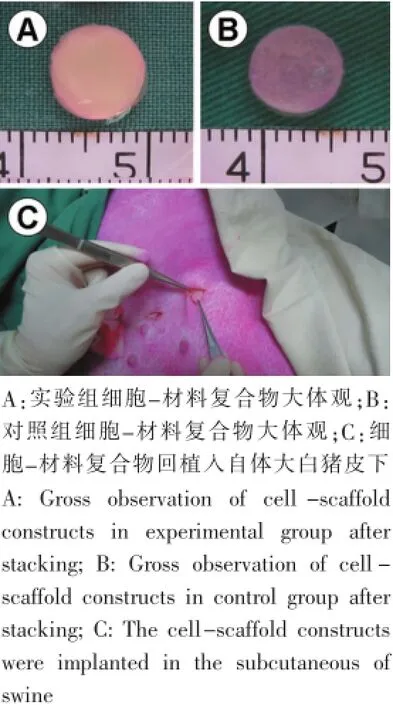
图1 细胞-材料复合物的构建和回植Fig.1Engineering cartilage in vitro and during implantation

图2 体外培养3周构建组织大体观与组织学观察(标尺:500 μm)Fig.2Gross and histological observation of tissue harvested in each group after cultured for 3 weeks(scale bars:500 μm)

图3 体内培养3周构建组织大体观与组织学观察(标尺:500 μm)Fig.3Gross view and histological observation of tissue harvested in each group after implanted for 3 weeks(scale bars:500 μm)

图4 体内培养3周构建组织湿重和力学强度检测Fig.4Wet weight and Young's modulus of tissue harvested in each group after implanted for 3 weeks
3 讨论
我们的前期研究已证实电纺膜是一种优良的组织工程支架材料,可在体外和裸鼠体内构建出成熟的三维软骨组织[1-2]。大动物皮下因复杂的免疫环境,很多常用的支架材料均未能成功构建软骨[10-11]。本研究证明,电纺膜可在大动物皮下构建软骨,并且软骨陷窝成熟,基质相对均匀,是优良的支架材料。
大动物皮下复杂的免疫环境,是造成很多支架材料不能用于软骨构建的主要原因。GT/PCL电纺材料和PGA/PCL材料在成分和结构上有很大不同,且进入大动物皮下培养时均有大量材料残余。因此,我们分析造成这种巨大差异的原因如下。
首先是支架材料的成分,实验组G5P5纳米纤维电纺膜为GT∶PCL=50∶50的混纺材料,其中Gelatin是一种天然的水溶性的生物可降解高分子材料,具有良好的组织相容性,在体内酶、盐等的作用下可自行降解,降解后的低分子产物可被组织吸收,或者通过排泄系统排出体外,而不会产生异物排斥现象或炎症反应,也无细胞毒性;而PCL则是经美国FDA认证、批准的一种医用可降解生物材料,具有低免疫原性及无毒性[12],且降解缓慢,产物为CO2和H2O,对人体无毒[13-15],对照组PGA/PCL支架中的90%的成分为PGA,降解产物为乳酸,可引起微环境pH值变化,易引起炎症反应,对软骨细胞造成破坏。
其次,是支架材料的降解速度。支架材料的降解速度和组织形成相适应,是评价组织工程支架的一个重要指标。降解速度的不同可造成降解产物的不同的聚集程度,是影响组织形成的重要原因。PGA/ PCL支架中90%的成分为PGA,PGA降解速度快,约8周可降解完全,体外培养中,降解的乳酸可随更换培养液去除,不易对软骨细胞造成破坏,而在大动物皮下,快速的降解可造成乳酸堆积于组织周围,更易受到免疫攻击,造成严重的炎症反应[3-4]。而G5P5纳米纤维电纺膜为完全混合混纺材料,Gelatin降解速度快,体外培养中几乎可以完全降解,而PCL完全降解则需要2年以上[13]。因此,在免疫环境中,G5P5纳米纤维电纺膜不易引起炎症反应。
再次,是纳米电纺膜特殊的结构特征。大动物皮下具有丰富的血管组织,和关节软骨的免疫豁免环境不同,幼稚的软骨样组织极易受到免疫攻击,很难发育成熟。而我们的实验结果显示,回植前实验组细胞基质不多,组织极不成熟,而体内培养后软骨组织迅速成熟,几乎和前期研究在免疫缺陷动物中的组织成熟度相当[1]。电纺膜的结构特点为超细纤维,且在形态和尺寸上能仿生天然细胞外基质的纳米纤维结构[15]。成熟的软骨基质具有免疫保护作用,其致密的网状结构可包裹软骨细胞不被免疫系统识别[5]。因此,根据电纺膜仿生细胞外基质的结构特点,我们推测其具有和软骨基质类似的免疫保护作用,软骨细胞可以在其保护下不被免疫系统识别,从而进一步发育成熟,这也可以解释体外培养3周时实验组未见明显成熟软骨组织,而体内培养后软骨成熟迅速,电纺膜材料也未见明显降解。当然,这种推论还需要后期进一步的实验证实。
4 结论
GT/PCL复合纳米纤维电纺膜可成功用于大动物皮下环境的软骨构建。与PGA/PCL材料相比,具有体外培养时间短、软骨形成成熟的优势,是一种优良的软骨组织工程支架材料,其作用机制有待进一步深入研究。
[1]Xue J,Feng B,Zheng R,et al.Engineering ear-shaped cartilage using electrospun fibrous membranes of gelatin/polycaprolactone [J].Biomaterials,2013,34(11):2624-2631.
[2]Zheng R,Duan H,Xue J,et al.The influence of Gelatin/PCL ratio and 3-D construct shape of electrospun membranes on cartilage regeneration[J].Biomaterials,2014,35(1):152-164.
[3]Shieh SJ,Terada S,Vacanti JP.Tissue engineering auricular reconstruction:in vitro and in vivo studies[J].Biomaterials,2004, 25(9):1545-1557.
[4]Bichara DA,O'Sullivan N,Pomerantseva I,et al.The tissueengineered auricle:past,present,and future[J].Tissue Eng Part B Rev,2012,18(1):51-61.
[5]Fujihara Y,Takato T,Hoshi K.Immunological response to tissueengineered cartilage derived from auricular chondrocytes and a PLLA scaffold in transgenic mice[J].Biomaterials,2010,31(6): 1227-1234.
[6]Luo X,Zhou G,Liu W,et al.In vitro precultivation alleviates post-implantation inflammation and enhances development of tissue-engineered tubular cartilage[J].Biomed Mater,2009,4(2): 25006.
[7]Gong YY,Xue JX,Zhang WJ,et al.A sandwich model for engineering cartilage with acellular cartilage sheets and chondrocytes [J].Biomaterials,2011,32(9):2265-2273.
[8]Liu Y,Zhang L,Zhou G,et al.In vitro engineering of human ear-shaped cartilage assisted with CAD/CAM technology[J]. Biomaterials,2010,31(8):2176-2183.
[9]陶然,刘浥,殷宗琦,等.利用软骨细胞膜片技术在山羊皮下构建软骨样组织的研究[J].组织工程与重建外科,2013,9(2):61-65.
[10]Luo X,Liu Y,Zhang Z,et al.Long-term functional reconstruction of segmental tracheal defect by pedicled tissue-engineered trachea in rabbits[J].Biomaterials,2013,34(13):3336-3344.
[11]Bichara DA,Pomerantseva I,Zhao X,et al.Successful creation of tissue-engineeredautologousauricularcartilageinan immunocompetent large animal model[J].Tissue Eng Part A, 2014,20(1-2):303-312.
[12]Chong EJ,Phan TT,Lim IJ,et al.Evaluation of electrospun PCL/ gelatin nanofibrous scaffold for wound healing and layered dermal reconstitution[J].Acta Biomater,2007,3(3):321-330.
[13]Mas EJ,Vidaurre A,Meseguer DJ,et al.Physical characterization of polycaprolactone scaffolds[J].J Mater Sci Mater Med,2008,19 (1):189-195.
[14]Migneco F,Huang YC,Birla RK,et al.Poly(glycerol-dodecanoate), abiodegradablepolyesterformedicaldevicesandtissue engineering scaffolds[J].Biomaterials,2009,30(33):6479-6484.
[15]Zhang Y,Ouyang H,Lim CT,et al.Electrospinning of gelatin fibers and gelatin/PCL composite fibrous scaffolds[J].J Biomed Mater Res B Appl Biomater,2005,72(1):156-165.
The Construction of Tissue Engineered Cartilage by Using GT/PCL Nanofibres Membranes in Porcine Model
ObjectiveTo investigate the possibility of the tissue engineered cartilage construction with electrospun gelatin/polycaprolactone(GT/PCL)membranes in subcutaneous of porcine model.MethodsEngineered cartilage was constructed by auricular chondrocytes of porcine as seed cells with GT/PCL membranes(experimental group)and PGA/PLA material(control group)as scaffold.Then the engineered cartilage was implanted subcutaneously in the abdominal wall of swine after cultured 3 weeks in vitro.The samples of the two groups were collected at two time points:3 weeks in vitro and 3 weeks in vivo.Histological observation,wet weight and mechanical strength test were used to evaluate the chondrogenesis.ResultsAfter 3 weeks cultured in vitro,cartilage phenotype and undegraded scaffolds were observed in two groups by histological analysis.And the extracellular matrix in control group seems more uniform than the experimental group. However,After 3 weeks cultured in vivo,mature cartilage were only formed in the experimental group,and fibrous tissue substitute for cartilage was observed in the control group.In addition,the engineered cartilage in experimental group showed better mechanical strength.ConclusionGT/PCL membranes could be successfully used in the construction of tissue engineering cartilage in subcutaneous of large animal.It could be a kind of promising scaffold for cartilage tissue engineering.
Tissue engineered cartilage;Electrospun nanofibres membranes;Polyglycolic acid;Polylactic acid; Inflammatory response
R318.1
A
1673-0364(2017)01-0001-04
HUO Yingying1,2,3,ZHOU Guangdong2,3,ZEHNG Rui1,2,3.
1 Department of Dermatology,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China;2 Shanghai Key Laboratory of Tissue Engineering,Shanghai 200011,China;3 National Tissue Engineering Center of China,Shanghai 200241,China.Corresponding author:ZEHNG Rui (E-mail:zhr1224@126.com).
2016年9月30日;
2016年12月22日)
10.3969/j.issn.1673-0364.2017.01.001
国家自然科学基金(81401532)。
200011上海市上海交通大学医学院附属第九人民医院皮肤科(霍莹莹,郑蕊);200011上海市上海市组织工程研究重点实验室(霍莹莹,周广东,郑蕊);200241上海市组织工程国家工程中心(霍莹莹,周广东,郑蕊)。
郑蕊(E-mail:zhr1224@126.com)。
