丹参对3T3-L1细胞成脂分化与增殖的影响
2017-03-16林怀安余力王健张波郑丹宁周佳
林怀安 余力 王健 张波 郑丹宁 周佳
丹参对3T3-L1细胞成脂分化与增殖的影响
林怀安 余力 王健 张波 郑丹宁 周佳
目的观察丹参对3T3-L1细胞成脂分化和增殖的影响,为丹参应用于自体脂肪移植提供实验依据。方法将含有不同终浓度丹参注射液的完全培养液(0.6 g/L、0.3 g/L、0.15 g/L、0.075 g/L、0.04 g/L、0.02 g/L)分别加入诱导分化的3T3-L1细胞,待细胞分化至成熟脂肪细胞时,利用CCK-8法检测细胞增殖活力;利用油红O染色法、Image-pro plus 6.0软件观察脂肪细胞内脂质的聚积;利用甘油三酯GPO-POD法测定脂肪细胞的脂质含量。结果丹参可促进3T3-L1细胞增殖,且呈一定的时间、剂量依赖关系:加药时间点越早,对3T3-L1细胞增殖的促进作用越大;丹参浓度越大,对3T3-L1细胞增殖的促进作用越大。丹参同时也促进了3T3-L1细胞的成脂分化,增加细胞内脂质的聚积,并呈一定的剂量依赖关系。结论丹参能够促进3T3-L1细胞的成脂分化以及增殖,使成熟脂肪细胞的数量增加。
丹参3T3-L1细胞增殖细胞分化
自体脂肪移植用于软组织的填充与修复重建,具有取材简便、来源丰富、生物相容性良好、无排异反应等优点。临床上各种提高脂肪移植存活率的方法,其结果仍然不尽如人意[1]。
为提高自体脂肪移植的存活率,达到理想的填充结果,针对移植脂肪组织的存活机制进行了大量研究,由脂肪来源干细胞(Adipose derived stromal/ stem cells,ADSC)主导的“脂肪细胞再生”理论,以及加快移植脂肪组织的血运重建,是提高移植脂肪存活率的关键因素[2]。ADSC是脂肪组织特有的前体细胞,其抗缺血、缺氧能力强,能克服移植早期的缺血状态,待血氧充足时,可分化为成熟的脂肪细胞,促进脂肪组织的更新[3]。在脂肪移植术后,促进低分化ADSC增殖,并向成熟的脂肪细胞转化,尽可能地保持脂肪移植组织的体积和重量,从而提高脂肪移植的存活率。
现代药理研究发现,丹参具有扩张血管、改善微循环、防止心肌缺血和心肌梗死等作用,被广泛用于心血管疾病的治疗。研究证实,其活性成分不但可以直接保护内皮细胞,还可以通过增加内皮祖细胞的数量以促进血管内皮的修复[4]。同时,丹参可促进多种细胞的分化增殖[5]。3T3-L1小鼠前脂肪细胞株具有ADSC的生理、生化特性及细胞形态,经诱导可分化为成熟的脂肪细胞,被广泛应用于体外脂肪细胞分化的研究[6]。因此,本实验通过观察不同浓度的丹参对3T3-L1细胞增殖与成脂分化的影响,探讨丹参注射液对ADSC增殖与分化的作用,为进一步的动物实验和临床应用提供依据。
1 材料与方法
1.1 主要试剂与器材
小鼠3T3-L1细胞(ATCC细胞库,美国);丹参注射液(正大青春宝药业有限公司);DMEM高糖培养基、胎牛血清(Hyclone公司,美国);0.25%胰蛋白酶(Gibco公司,美国);1-甲基-3-异丁基-黄嘌呤、地塞米松、合成人胰岛素、青链霉素(Sigma公司,美国);细胞增殖/毒性检测试剂盒(同仁化学研究所,日本);油红O染液、甘油和甘油三酯测试盒(南京建成生物工程研究所)。
超净工作台(苏州安泰空气技术有限公司);恒温CO2培养箱(FormaScientific公司,美国);倒置相差显微镜(Nikon公司,日本);100 mm培养皿、离心管(FALCON公司,美国);Image Pro Plus 6.0软件(Media Cybernetics公司,美国);酶联免疫检测仪(Thermo公司,美国)。
1.2 方法
1.2.1 3T3-L1细胞培养与分化
将3T3-L1细胞培养于完全培养基(高糖DMEM,含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素),于37℃、5%CO2下培养。细胞生长融合至80%时,以0.25%胰酶消化,1∶4传代。取第5代细胞用于成脂分化,调整细胞密度至2×104cells/L,接种于培养板,待细胞融合48 h后,将培养基更换为含有诱导液A(0.5 mmol/L IBMX,1 μmol/L DEX,10 μg/mL INS)的完全培养基(为诱导分化的第0天)。48 h后,换成含有诱导液B(高糖DMEM,含10 μg/mL INS)的完全培养基(为诱导分化的第2天)。48 h后,再换回不含诱导液的完全培养基,隔2天换液一次。
1.2.2 CCK-8细胞增殖活力分析
将3T3-L1细胞培养于完全培养基,调整细胞密度至2×104cells/L,接种于96孔培养板,每孔100 μL。在诱导分化至第4天、第6天、第8天时,实验组分别加入含有不同终浓度(0.6 g/L、0.3 g/L、0.15 g/L、0.075 g/L、0.04 g/L、0.02 g/L)丹参注射液的完全培养液进行干预。对照组加入不含丹参的完全培养液。隔2天换液一次,各组均设6个复孔。在诱导分化的第9天、第10天、第11天于每孔加入含有10%CCK-8溶液的PBS溶液100 μL,37℃孵育2 h,用酶标仪测定450 nm处的吸光度值。
本文通过对研究区域生态重建现场调查,获取研究区原始资料和数据,通过分析植物群落特征,结合现场植被样方调查数据,选取合适的评价指标因子,建立一套合理的评价体系,对研究区生态重建效果进行定量评价,从而为矿山生态重建下一步规划设计提供科学依据。
1.2.3 油红O染色
将3T3-L1细胞培养于完全培养基,调整细胞密度至2×104cells/L,接种于6孔培养板,每孔2 mL。第4天,实验组分别加入含有不同终浓度丹参注射液的完全培养液,对照组加入不含丹参的完全培养液。第9天时,PBS溶液冲洗3次,4%多聚甲醛固定30 min,PBS冲洗细胞3次,油红O室温染色15 min,PBS冲洗多余油红O染液3次,镜下观察并拍照,以Image-pro plus 6.0软件分析油红O染色阳性面积。
1.2.4 甘油三酯含量测定
将3T3-L1细胞培养于完全培养基,调整细胞密度至2×104cells/L,接种于24孔培养板,每孔500 μL。第4天,实验组分别加入含有不同终浓度丹参注射液的完全培养液,对照组加入不含丹参的完全培养液。第9天时,每孔加入100 μL含有PMSF终浓度为1 mM的TritionX-100裂解液,裂解30 min。按照甘油三酯测试盒说明书,将裂解好的细胞样本、甘油校准品、蒸馏水各2.5 μL分别加入至96孔板,并设立对照组,各组均设6个复孔,每孔再加入工作液250 μL,混匀后于37℃下孵育10 min,用酶标仪测定510 nm处的吸光度值。同时用BCA蛋白含量试剂盒测定细胞样本的总蛋白浓度,以甘油标准液作出标准曲线,通过标准曲线测出蛋白浓度以校正TG值。
1.2.5 统计学分析
采用SPSS22.0进行统计分析,结果以(x±s)表示,两组间差异采用t检验,两组以上组间差异采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 丹参对分化不同时期的3T3-L1细胞增殖活力的影响
第4天丹参终浓度为0.6 g/L和0.3 g/L的实验组,与对照组的差异显著(P<0.05);其他浓度的实验组与对照组之间无统计学差异(P>0.05)。
第6天和第8天,实验组与对照组的差异无统计学意义(P>0.05)(图1-A)。
第4天丹参终浓度为0.02 g/L的实验组与对照组无明显差异(P>0.05),其余各浓度实验组与对照组的差异均有统计学意义(P<0.05)。
第6天丹参终浓度为0.04 g/L、0.02 g/L的实验组与对照组的差异无统计学意义(P>0.05),其余各浓度实验组与对照组的差异明显(P<0.05)。
第8天丹参终浓度为0.6 g/L、0.3 g/L的实验组与对照组的差异显著(P<0.05),其余各浓度实验组与对照组的差异无显著性(P>0.05)(图1-B)。
第10天测量吸光度值发现,第4天、第6天、第8天加入丹参的实验组和对照组的吸光度值均达到高峰。第4天加入丹参的实验组相比第6天、第8天加入丹参的实验组,以及与对照组之间的差异显著(P<0.05);第6天加入丹参的实验组与第8天加入丹参的实验组,以及与对照组之间均存在显著性差异(P<0.05)(图1-D、图1-E、图1-F)。
第11天测量吸光度值发现,第4天、第6天加入丹参的实验组与对照组存在显著差异(P<0.05)。第8天加入丹参终浓度为0.02 g/L的实验组与对照组的差异无统计学意义(P>0.05)(图1-C),其余各浓度均与对照组存在显著性差异(P<0.05)。
实验结果表明,丹参浓度越大,对3T3-L1细胞增殖的促进作用越大;丹参作用时间越长,其对3T3-L1细胞增殖的促进作用越大。
2.2 丹参对3T3-L1细胞脂质聚积的影响
油红O染色显示,终浓度0.6 g/L的实验组与其他浓度实验组相比,脂滴聚积更多、脂滴更大;对照组与实验组相比差异明显(图2)。
油红O染色阳性面积结果显示,丹参终浓度为0.02 g/L的实验组与对照组的差异无统计学意义;其他个浓度实验组与对照组均存在明显差异,且呈剂量依赖关系(图3)。
2.3 丹参对3T3-L1细胞甘油三酯含量的影响
甘油三酯含量测定显示,实验组与对照组存在显著性差异,并呈剂量依赖关系(图4)。

图1 不同分化时间各组的细胞增殖活力Fig.1Cell viability in each group at different incubation time
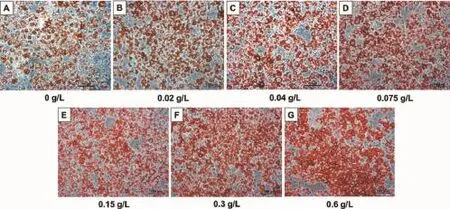
图2 油红O染色观察丹参对脂质聚积的影响(100×)Fig.2Photographs of S.miltiorrhiza-treated differentiated adipocytes stained by Oil Red O(100×)

图3 油红O染色阳性面积比较Fig.3The comparison of the positive area by Oil Red O staining
3 讨论
自体脂肪组织作为软组织填充物,具有取材简便、来源丰富、供区损伤小、填充外观好、组织相容性好等优势。但是,较高的吸收率导致了治疗效果存在不确定性。近年来,众多研究都聚焦于提高自体脂肪组织移植的存活率,特别是自体移植脂肪的成活机制等方面。
近年来,有研究探索了中药促进自体脂肪移植存活率的研究,如川穹嗪、黄芪等,获得了能够提高自体脂肪存活率的肯定结果[7]。现代药理研究发现,丹参具有扩张血管、改善微循环、防止心肌缺血和心肌梗死等作用,被广泛用于心血管疾病的治疗。经研究证实,其活性成分不但可以直接保护内皮细胞,还可以通过增加内皮祖细胞的数量,以促进内皮的修复[4]。大量研究表明,丹参可促进多种细胞的分化增殖[5]。我们探讨丹参对前脂肪细胞的分化和增殖的影响,探寻能促进ADSC分化增殖的方法,提高移植脂肪细胞的存活率。
常规的成脂诱导中,在加入诱导液后的第8~12天即可分化为成熟的脂肪细胞,即进入终末分化期,成熟脂肪细胞基本没有增殖的能力。3T3-L1前脂肪细胞的分化,首先让前脂肪细胞增殖,当细胞汇合后进入接触抑制阶段,此时细胞停止分裂增殖;然后在诱导液的刺激下,前脂肪细胞进入特定的细胞分裂期开始克隆扩增;最后进入终末分化期,分化为成熟的脂肪细胞,克隆增殖终止[8]。本研究中,我们利用CCK-8法检测3T3-L1细胞分化为成熟脂肪细胞时的增殖活力,即检测终末分化期的细胞增殖活力。结果显示,在终末分化期,实验组细胞仍存在增殖活力,丹参对3T3-L1细胞增殖活力的具有明显的促进作用。卢慧玲等[9]证实,3T3-L1细胞分化为成熟脂肪细胞时,部分含有大量脂滴的成熟脂肪细胞仍具有双核,处于细胞分裂期,尚存在分裂增殖的能力。

图4 各组甘油三酯含量Fig.4TG content in each group
我们在诱导后的不同时间点(第4天、第6天、第8天)加入丹参。结果表明,丹参作用时间越长,其对3T3-L1细胞增殖的促进作用越大。在3T3-L1细胞分化的不同时期中,丹参不仅对前脂肪细胞的增殖具有促进作用,即使在第8天,即终末分化期,仍然能促进成熟脂肪细胞的增殖。甘油三酯含量测定和油红O染色也证实了这一点。同时,丹参在促进细胞分化增殖方面具有剂量依赖性,丹参浓度越大,对3T3-L1细胞增殖的促进作用越大。
[1]Tuin AJ,Domerchie PN,Schepers RH,et al.What is the current optimal fat grafting processing technique?A systematic review [J].J Craniomaxillofac Surg,2016,44(1):45-55.
[2]曾昭卫,廖云君,鲁峰,等.游离脂肪移植后脂肪细胞的存活机制[J].中华整形外科杂志,2014,30(3):236-240.
[3]Yoshimura K,Asano Y,Aoi N,et al.Progenitor-enriched adipose tissue transplantation as rescue for breast implant complications [J].Breast J,2010,16(2):169-175.
[4]Lambiase PD,Edwards RJ,Anthopoulos P,et al.Circulating humoral factors and endothelial progenitor cells in patients with differing coronary collateral support[J].Circulation,2004,109(24): 2986-2992.
[5]崔澂,刘秀萍.丹参及其提取物促细胞增殖作用研究进展[J].医学综述,2015,21(24):4528-4531.
[6]Green H,Kehinde O.An established preadipose cell line and its differentiation in culture.II.Factors affecting the adipose conversion [J].Cell,1975,5(1):19-27.
[7]武承兴,王健,张波,等.黄芪对自体脂肪颗粒移植存活率的影响[J].组织工程与重建外科,2013,9(3):141-144.
[8]Gregoire FM,Smas CM,Sul HS.Understanding adipocyte differentiation[J].Physiol Rev,1998,78(3):783-809.
[9]卢慧玲,王宏伟,林汉华.前脂肪细胞分化为成熟脂肪细胞后的再增殖[J].基础医学与临床,2003,23(6):608-611.
Effect of Salvia Miltiorrhiza on Proliferation and Differentiation of 3T3-L1 Cells
ObjectiveTo explore the effect of Salvia miltiorrhiza on proliferation and differentiation of 3T3-L1 cells,so as to provide evidence for further research and clinical application of fat transplantation.MethodsThe differentiating 3T3-L1 cells after adipogenic induction were incubated with different concentration of S.miltiorrhiza(0.6 g/L,0.3 g/L,0.15 g/L,0.075 g/L, 0.04 g/L,0.02 g/L).After the 3T3-L1 cells differentiated into mature adipocyte,the cell proliferation viability was determined by CCK-8 assay kit.The lipid droplets accumulation of adipocyte were observed by Oil Red O staining and Image Pro Plus 6.0.The adipogenesis was quantified by measuring lipid content using triglyceride GPO-POD assay kit.ResultsS. miltiorrhiza promoted a dose-and time-dependent increase in 3T3-L1 cell proliferation viability.The earlier the dosing time was,the better the cell proliferation viability would be;The higher the concentration was,the better the cell proliferation viability would be.Within the six S.miltiorrhiza concentrations confine,S.miltiorrhiza also promoted a dose-dependent increase in 3T3-L1 cell differentiation ability,enhanced the lipid droplets accumulation of 3T3-L1 adipocyte.Conclusion S.miltiorrhiza can promote the increase of adipocyte number via the proliferation and differentiation of 3T3-L1 cells.
Salvia miltiorrhiza;3T3-L1;Cell proliferation;Cell differentiation
R622+.9
A
1673-0364(2017)01-0017-04
LIN Huaian,YU Li,WANG Jian, ZHANG Bo,ZHENG Danning,ZHOU Jia.
Department of Plastic and Reconstructive Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011,China.Corresponding author:YU Li(E-mail: youli@sh163.net)
2016年11月4日;
2016年12月20日)
10.3969/j.issn.1673-0364.2017.01.005
200011上海市上海交通大学医学院附属第九人民医院整复外科。
余力(E-mail:youli@sh163.net)。
