铬在小鼠体内的蓄积效应与毒性
2017-03-14仪民仪慧兰吴丽华
仪民,仪慧兰,吴丽华
1. 山西大学 生命科学学院,太原030006 2. 太原师范学院 生物系,太原030031 3. Department of Statistics, University of Missouri Columbia, Columbia, MO 65211, USA
铬(Cr)广泛存在于人类生存环境中,除金属铬外,最常见的价态是Cr(Ⅲ)和Cr(VI)。全球铬产量每年数千万吨,其中60%~70%的铬用于包括不锈钢在内的合金生产,15%用于化学工业生产,主要是制革、颜料和电镀[1]。工业排放及农业灌溉、施肥向环境释放铬,对环境微生物生态、动植物生理和人体健康产生了显著影响[2-6]。Cr(Ⅲ)不溶于水,移动性差,而Cr(VI)易溶于水,移动性较高,释放到土壤和水体中的Cr(VI)导致饮用水Cr(VI)超标[7-8]。近年来铬污染事件在世界各地均有发生,铬毒性受到全社会的关注。
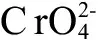
为进一步评价Cr(VI)毒性,本文采用毒理学研究方法,通过饮水染毒方式研究Cr(VI)在实验动物小白鼠体内的蓄积效应和毒性,旨在为铬污染的安全性评价提供依据。
1 材料与方法(Materials and methods)
1.1 实验动物分组
健康昆明种纯系雄性小白鼠50只,体重(18 ± 2) g,由山西医科大学提供。将小鼠随机分为5组,每组10只,称量并记录小鼠体重。
1.2 实验动物染毒
根据文献报道中小鼠铬半致死剂量(LD50=316 mg·kg-1)[14],设置小鼠饮用水中含铬(用重铬酸钾配制)浓度为15 mg·L-1,30 mg·L-1,50 mg·L-1和70 mg·L-1。
实验动物自由取食和饮水,喂食山西医科大学提供的专用全价大颗粒饲料,对照组饮用灭菌蒸馏水,铬染毒组分别饮用不同浓度的铬溶液。染毒期为30 d,观察记录期间动物的活动情况、饮食情况、精神状态和中毒症状。
1.3 实验动物解剖与取材
染毒结束后称量小鼠体重,用颈椎脱臼法处死,迅即解剖观察体内有无异常,摘取脑、心、肝、肺、肾、睾丸、脾脏等脏器,用预冷的生理盐水浸洗,吸去表面浮水后称重,置于玻璃瓶中备铬含量测定。
1.4 骨髓细胞ROS和微核检测
取小鼠股骨骨髓细胞,常规涂片,吉姆萨染液染色后镜检。每只动物观察约1 000个嗜多染红细胞(PCE),计数有微核的PCE数,计算细胞微核率。

图1 饮用含铬水对小鼠体重的影响Fig. 1 Effects of Cr (Ⅵ) intake by drinking water on body weight in mice

图2 饮用含铬水对小鼠脏器系数的影响Fig. 2 Effects of Cr (Ⅵ) intake on the ratio of organ to body weight in mice
取小鼠股骨骨髓细胞用磷酸盐缓冲液制备细胞悬液,加入活性氧特异性荧光探针DCFH-DA(终浓度5 μmol·L-1)避光孵育30 min,荧光显微镜(BX51, Japan, Olympus)观察、拍照,并用显微成像系统附带的Image Pro Plus 6.0软件对ROS荧光信号进行定量分析。
1.5 铬含量测定
取动物脏器加入体积比为5:1的硝酸:高氯酸溶液,加热硝化。三蒸水溶解硝化物,二苯碳酰二肼分光光度法(GB 7467—87)测定铬含量。
1.6 数据统计分析
采用SPSS 17.0对所得结果进行F检验后,用Duncan方法比较染毒组与对照组间的差异显著性(*P<0.05, 差异显著;**P<0.01, 差异显著)。
2 结果(Results)
2.1 对小鼠铬摄入量的影响
在整个实验期间,实验动物未出现死亡,摄食和精神状态未见异常,但随着饮用水中铬含量的升高,小鼠的平均日饮水量减少。5个实验组动物的平均周饮水量按铬浓度由低到高依次为352.3 mL、329.4 mL、294.1 mL、223.8 mL和208.2 mL。由周饮水量和体重计算各组小鼠的铬摄入量发现,随着饮用水中铬浓度的升高,小鼠对铬的摄入量递增,4个铬染毒组小鼠的铬摄入量日均值依次为1.96 mg·kg-1、3.50 mg·kg-1、4.52 mg·kg-1和5.80 mg·kg-1。

图3 饮用含铬水对小鼠脏器铬含量的影响Fig. 3 Effects of Cr (Ⅵ) intake on Cr contents in the organs of mice
2.2 对小鼠体重的影响
染毒30 d后各组小鼠的体重均有不同程度增加,其中,蒸馏水对照组体重增幅最大,为初始体重的2.08倍;4个不同浓度铬染毒组体重明显低于对照,体重增量为对照组的54.19 %~75.61%,说明饮用水中高浓度六价铬离子能影响小鼠的正常生理功能,进而抑制小鼠体重的正常增长(图1)。
2.3 对小鼠脏器系数的影响
解剖观察未发现小鼠体内异常,铬染毒组小鼠主要脏器重量与体重的比值(脏体比)发生变化,其中,脾/体比值和脑/体比值升高,15 mg·L-1铬染毒组脾/体比值显著增高,50 mg·L-1铬染毒组脑/体比值显著增加了31%;肾/体比值与肝/体比值降低,肾/体比值降幅较大,在30~70 mg·L-1铬染毒组中显著降低;而心/体比值、睾丸/体比值和肺/体比值与对照组无明显差异(图2)。
计算染毒组与对照组小鼠脏器系数的相对值发现,虽然不同脏器对铬毒性的敏感度不同,但随着剂量增加,小鼠主要脏器的脏器系数均下降,说明铬摄入量的增加是导致机体损伤的主要原因。
2.4 对小鼠不同脏器铬含量的影响
染毒30 d后,小鼠不同脏器内总铬含量的变化趋势不尽相同(图3),反映了不同脏器铬蓄积能力的不同。染毒组心脏铬含量增幅最大,浓度50 mg·L-1和70 mg·L-1的染毒组总铬含量显著高于对照组,为对照组的2.20和1.59倍。脾脏中铬累积明显,铬含量为对照组的1.43~1.81倍。染毒组的睾丸、肺脏、肝脏中铬含量与对照组无显著差异,但略有增加,其中睾丸中铬含量为对照组的1.27~1.51倍,肺脏铬含量为对照组的1.27~1.48倍,肝脏铬含量为对照组的1.06~1.16倍。染毒组肾脏未发现铬累积效应。
2.5 对小鼠骨髓细胞ROS水平和微核率的影响
不同剂量铬染毒组小鼠的骨髓嗜多染红细胞微核率均增加。在铬浓度15~70 mg·L-1范围内,细胞微核率显著高于对照组,且随着铬浓度的增大而增加(图4)。
经特异性荧光探针标记后,对照组细胞中仅可见微弱的荧光,而处理组骨髓细胞内ROS荧光信号明显增强;定量分析发现,细胞ROS水平在铬染毒组中显著增高,并具有一定的剂量依赖性(图5,图6)。这表明铬染毒组小鼠骨髓细胞ROS水平升高,也提示铬通过食道摄入能引发实验动物骨髓细胞的氧化胁迫。染毒组小鼠骨髓细胞ROS水平升高与骨髓嗜多染红细胞微核率升高同时发生,说明微核的产生与染毒组胞内高水平的ROS有关。

图4 铬对小鼠骨髓嗜多染红细胞微核率的影响Fig. 4 Effect of Cr (Ⅵ) intake on micronuclei frequency in mice marrow cells

图5 小鼠骨髓细胞活性氧(ROS)荧光密度注:A, 对照组; B, 50 mg·L-1 Cr6+组。Fig. 5 Reactive oxygen species (ROS) fluorescence intensity in mice marrow cellsNote: A, Control; B, 50 mg·L-1 Cr6+.

图6 铬对骨髓细胞活性氧水平的影响Fig. 6 Effects of chromium on intracellular ROS levels in mouse marrow cells
3 讨论 (Discussion)
本文采用昆明种小白鼠,经饮水摄入较多Cr(VI)后,出现了体重增长的抑制,与国内外学者在其他品系小鼠和大鼠中得到的结果[15-16]类似。脏器系数是实验动物某器官质量与其体重之比值,是亚慢性毒性实验的常用指标,可较好地反映化学物对该脏器的综合毒害作用,脏器系数增大,表示该器官可能出现充血、水肿或增生肥大;脏器系数下降,说明脏器萎缩或其他退行性病变[15]。饮水铬染毒出现脾脏和脑的脏器系数增大,肾脏和肝脏脏器系数下降,心脏、睾丸和肺脏脏器系数无明显改变;小鼠心脏和脾脏中铬含量明显提高,出现一定的铬蓄积,而肝脏和肾脏未检出铬蓄积,说明本研究染毒期间铬的蓄积器官为心脏和脾脏,而毒效应靶器官为肝脏和肾脏,脑和脾脏亦受到一定影响。本结果与文献报道的肝脏、肾脏为铬蓄积器官[16]不同,可能是因为实验动物的品系、染毒剂量、染毒期限不同造成的。因心脏和脾脏血流比较丰富,进入体内随血液循环而转运的铬有更多的机会滞留在其中,也有可能心和脾脏组织对铬离子有较高的亲和力,导致心脏和脾脏中铬含量较高。经口摄入的Cr(VI)因吸收率较低,多数由消化道随粪便排出,其中被机体吸收的部分主要由尿液排出[16]。肾脏的基本功能是生成尿液,它是机体清除体内代谢产物及某些废物、毒物的重要器官。肾脏中含铬尿液的滞留增加了铬对肾脏的毒性作用。肝脏是人体主要的代谢和解毒器官,铬摄入引发的氧化胁迫及代谢紊乱会增加肝细胞负担,引发对肝组织细胞的毒性作用[17-18]。因此,肝肾组织可能会因铬的氧化损伤出现细胞死亡[17-19],导致器官重量减轻,相应的脏器系数下降。
微核是细胞受遗传毒物作用后在细胞分裂过程中形成的形态学上的一种可见标识,是检测化学物质遗传毒性的主要指标之一。本研究发现,通过饮水摄入Cr(VI)可诱发小鼠骨髓嗜多染红细胞微核率升高,骨髓组织细胞内ROS水平升高,说明经消化道摄入过量Cr(VI)能引发实验动物骨髓细胞的遗传损伤和氧化胁迫。铬遗传毒性的出现,预示着细胞遗传物质的变异,及肿瘤发生或子代畸形的高风险。骨髓是动物的干细胞库,与机体造血功能、免疫细胞形成等密切相关,骨髓细胞受损会影响相关的造血过程、免疫功能等,引发机体生理异常。铬染毒组小鼠体重增长抑制可能与骨髓细胞氧化损伤,引发体内供血不足继而影响机体的正常生理过程有关。

综上所述,六价铬离子染毒30 d能引发小鼠的肝、肾毒性,使主要脏器内总铬含量改变,其中心脏和脾脏铬含量显著增高。
由消化道摄入的六价铬离子,引发了骨髓组织细胞的氧化胁迫和遗传损伤,与机体生理功能紊乱和疾病发生有关。
[1] Cervantes C, Campos-García J, Devars S, et al. Interactions of chromium with microorganisms and plants [J]. FEMS Microbiology Reviews, 2001, 25: 335-347
[2] Shanker A K, Cervantes C, Loza-Tavera H, et al. Chromium toxicity in plants [J]. Environment International, 2005, 31: 739-753
[3] Xiao W, Yang X, Zhang Y, et al. Accumulation of chromium in Pak Choi (L.) grown on representative Chinese soils [J]. Journal of Environmental Quality, 2013, 42(3): 758-765
[4] Zhang J D, Li S. Cancer mortality in a Chinese population exposed to hexavalent chromium in water [J]. Journal of Occupational and Environmental Medicine, 1997, 39(39): 315-319
[5] Lou J, Jin L, Wu N, et al. DNA damage and oxidative stress in human B lymphoblastoid cells after combined exposure to hexavalent chromium and nickel compounds [J]. Food and Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association, 2013, 55: 533-540
[6] Martí E, Sierra J, Cáliz J, et al. Ecotoxicity of Cr, Cd, and Pb on two Mediterranean soils [J]. Archives of Environmental Contamination Toxicology, 2013, 64(3): 377-387
[7] Zhitkovich A. Chromium in drinking water: Sources, metabolism, and cancer risks [J]. Chemical Research in Toxicology, 2011, 24: 1617-1629
[8] Jaishankar M, Tseten T, Anbalagan N, et al. Toxicity, mechanism and health effects of some heavy metals [J]. Interdisciplinary Toxicology, 2014, 7(2): 60-72
[9] Son Y O, Pratheeshkumar P, Lei W, et al. Reactive oxygen species mediate Cr(VI)-induced carcinogenesis through PI3K/AKT-dependent activation of GSK-3 β/β-catenin signaling [J]. Toxicology and Applied Pharmacology, 2013, 271(2): 239-248
[10] Linos A, Petralias A, Christophi C A, et al. Oral ingestion of hexavalent chromium through drinking water and cancer mortality in an industrial area of Greece - An ecological study [J]. Environmental Health, 2011, 10: 1-8
[11] Thompson C M, Proctor D M, Suh M,et al. Assessment of the mode of action underlying development of rodent small intestinal tumors following oral exposure to hexavalent chromium and relevance to humans [J]. Critical Reviews in Toxicology, 2013, 43(3): 244-274
[12] Zhitkovich A. Importance of chromium-DNA adducts in mutagenicity and toxicity of chromium (VI) [J]. Chemical Research in Toxicology, 2005, 18: 3-11
[13] Wang X, Son Y O, Chang Q, et al. NADPH oxidase activation is required in reactive oxygen species generation and cell transformation induced by hexavalent chromium [J]. Toxicological Sciences An Official Journal of the Society of Toxicology, 2011, 123(2): 399-410
[14] Katz S A, Salem H. The toxicology of chromium with respect to its chemical speciation: A review [J]. Journal of Applied Toxicology, 1993, 13: 217-224
[15] 问华肖, 魏晨曦, 陈绍恢, 等. 苯和甲醛联合染毒对小鼠脾脏的损伤[J]. 生态毒理学报,2013, 8(4): 571-576
Wen H X, Wei C X, Chen S H, et al. Spleen tissue damage in mice from combined exposure of benzene and formaldehyde [J]. Asian Journal of Ecotoxicology, 2013, 8(4): 571-576 (in Chinese)
[16] Bucher J R. NTP technical report on the toxicity studies of sodium dichromate dihydrate (CAS No. 7789-12-0). National Toxicology Program Toxicity Report Series Number 72, NIH Publication No. 07-5964 [R]. Bethesda: NIH, 2007
[17] 考庆君, 吴坤, 邓晶, 等. 三价铬和六价铬对大鼠长期慢性毒性的比较[J]. 癌变 畸变 突变, 2007, 19(6): 474-478
Kao Q J, Wu K, Deng J, et al. The chronic toxic effect of trivalent chromium and hexavalent chromium on rat [J]. Carcinogenesis, Teratogesis and Mutation, 2007, 19(6): 474-478 (in Chinese)
[18] 王晓峰, 楼建林, 邢鸣鸾, 等. 六价铬致小鼠DNA损伤及肝肾氧化应激的实验研究[J]. 环境科学学报, 2006, 26(11): 1860-1864
Wang X F, Lou J L, Xing M L, et al. Hexavalent chromium induced DNA damage in peripheral blood lymphocytes and oxidative stress in the liver and kidney [J]. Acta Scientiae Circumstantiae, 2006, 26(11):1860-1864 (in Chinese)
[19] 金立方, 袁翊朦, 胡祎瑞, 等. 六价铬的细胞毒理效应及其机制研究进展[J]. 中国细胞生物学学报, 2013, 35(3): 387-392
Jin L, Yuan Y, Hu Y, et al. Research progress in cytotoxicity and mechanism of hexavalent chromium[J]. Chinese Journal of Cell Biology, 2013, 35(3): 387-392 (in Chinese)
[20] O'Brien T J, Ceryak S, Patierno S R. Complexities of chromium carcinogenesis: Role of cellular response, repair and recovery mechanisms [J]. Mutation Research, 2003, 533(1-2): 3-36
[21] Asatiani N, Kartvelishvili T, Abuladze M, et al. Chromium (VI) can activate and impair antioxidant defense system [J]. Biological Trace Element Research, 2011, 142: 388-397
